FKBP38基因的表达对小鼠非酒精性脂肪肝发生和发展的影响
2022-04-07唐敏怡邢朝凤刘傲璐赵子建穆云萍汪丽娜李芳红
唐敏怡,王 帅,邢朝凤,刘傲璐,赵子建,穆云萍,汪丽娜,李芳红
(广东工业大学生物医药学院,广东 广州 510006)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种世界范围内最常见的慢性肝脏疾病,包括非酒精性单纯性脂肪肝(nonalcoholic fatty liver,NAFL)和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)[1]。NAFLD与肥胖、血脂异常、Ⅱ 型糖尿病等代谢疾病密切相关,因此,有专家提议将其称为代谢相关脂肪肝病[2]。因为目前尚没有获批的用于治疗NAFLD的药物,所以临床上治疗NAFLD的方法主要是治疗其合并症,如肥胖、心血管疾病、Ⅱ 型糖尿病等。因此,探寻NAFLD的有效的治疗方法已成为目前研究的热点[3]。
FKBP38结合蛋白(FK506-binding protein 38)由于具有FKBP-C结构域而属于FK506结合蛋白家族(FKBPs)成员之一,是一类参与免疫调节、蛋白折叠和转运功能的免疫亲和蛋白[4]。FKBP38蛋白具有一个跨膜结构域(TM)使其定位于线粒体等细胞内膜上,能够招募抗凋亡蛋白Bcl-2和Bcl-XL至线粒体,抑制由于线粒体外膜受损而释放可溶性蛋白(如细胞色素C),从而改善线粒体功能[5]。
研究表明,在NAFLD的发展过程中,为了抑制脂肪积累,线粒体脂肪酸氧化的增加起到了重要作用,但这种反馈会导致氧化应激,降低线粒体呼吸链活性,导致线粒体功能障碍,因此,线粒体功能在NAFLD发展过程中起着重要的作用,所以我们假设FKBP38基因的表达可能在NAFLD的发生和发展过程中起重要调控作用[6-7]。
因此,本研究使用蛋氨酸胆碱缺失饲料(methionine-and choline-deficent diet,MCD)诱导NAFLD小鼠模型,观察肝细胞特异性敲除FKBP38基因后NAFLD小鼠肝脏病理变化,阐明FKBP38基因的表达对肝脏脂肪酸代谢的作用,为进一步探讨FKBP38基因的表达影响NAFLD的发生和发展的作用机制奠定基础,并为NAFLD的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 肝细胞特异性缺失FKBP38突变小鼠在广东药科大学SPF级实验动物中心饲养,实验动物饲养设施合格证号为 SYXK(粤)2017-0125。本实验所用动物保护指南是由广东药科大学动物护理委员会所制定。
1.1.2主要试剂 蛋氨酸和胆碱缺失饲料(A02082002BR)购自江苏省协同医药生物工程有限责任公司;苏木精伊红染色试剂盒(C0105)、RIPA裂解液(P0013B)购自上海碧云天生物技术有限公司;饱和油红O染色剂(G1260)购自北京索莱宝科技有限公司;甘油三酯检测试剂盒(10010303)购自美国Cayman公司;免疫组织化学-兔二步法试剂盒(PV-6001)购自北京中杉金桥生物技术有限公司;FKBP38抗体(AF3580)购自美国RD公司;F4/80抗体(70076)购自美国CST公司;TRIzol(T9424)购自美国Sigma公司;RNA逆转录试剂(R223-01)、ChamQ Universal SYBR qPCR Master Mix(Q711-02)、One Step Mouse Genotyping Kit(PD101-01)购自南京诺唯赞生物科技股份有限公司;引物由作者在NCBI数据库中设计,并由上海生工生物有限公司合成。
1.1.3仪器 全自动生化分析仪(深圳雷杜生命科学股份有限公司);低温离心机(美国Thermo);石蜡包埋机(德国SLEE);冷冻台(中威电子仪器有限公司);石蜡切片机(美国Thermo);冰冻切片机(美国Thermo);正置显微镜(德国Leica);Cytation5多功能微孔检测分析系统(美国Biotek);Chemi Doc+XRS化学发光凝胶成像系统(美国Bio-Rad);Cycler PCR仪(美国Bio-Rad);-80 ℃冰箱(中国美菱);qTOWER3G analytic(德国Jena)。
1.2 方法
1.2.1动物分组及NAFLD模型小鼠的建立 按照基因型将6周龄的小鼠分为野生型组(WT)以及纯合敲除组(L-FKBP38-/-)2组,每组6只,所有小鼠(每笼6只)饲养在SPF可控环境内,恒温22 ℃,相对湿度60%~70%,光照、黑暗周期为12 h,并自由进食蛋氨酸和胆碱缺失饲料和高压灭菌水。小鼠喂食MCD 4周后,过夜禁食12 h,用三溴乙醇进行腹腔麻醉。从小鼠眼眶收集全血样品,并在4 ℃下以12 000×g离心20 min来收集血清,用于检测肝功能指标及血脂指标。最后,取小鼠最大肝叶分为两份固定在4 %多聚甲醛中,用于肝脏病理分析,剩余的肝脏组织在液氮中快速冷冻,并储存在-80 ℃,用于生化分析。使用以下引物对所有小鼠进行基因型鉴定,以区分野生型和纯合敲除基因型。FKBP38-Flox上游引物1:5′-TCATGCAGGCAGAGTGCACATAG-3′,下游引物1:5′-CTGGAACTGGAGACTGGCTCCA-3′;上游引物2:5′-ACTGAGGCCACACAATCTAGGT-3′,下游引物2:5′-TGGAGACAGGCATTTCAGATCACA-3′; Alb-Cre引物1:5′-GCGGTCTGGCAGTAAAAACTATC-3′,引物2:5′-GTGAAACAGCATTGCTGTCACTT-3′,引物3:5′-CTAGGCCACAGAATTGAAAGATCT-3′,引物4:5′-GTAGGTGGAAATTCTAGCATCATCC-3′
1.2.2血清中肝脏损伤及血脂指标 取小鼠血清用全自动生化分析仪检测血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬转氨酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)和总胆固醇(cholesterol,CHO)水平。
1.2.3肝脏组织病理学染色
1.2.3.1 HE染色 肝脏组织用4%多聚甲醛固定后用乙醇溶液梯度脱水,石蜡包埋,制作成厚度为5 μm的石蜡切片。使用苏木精伊红染色试剂盒进行染色。
1.2.3.2 油红染色 肝脏组织用4%多聚甲醛固定后用蔗糖溶液梯度脱水,OCT包埋溶胶包埋,制作成厚度为10 μm的冰冻切片。使用饱和油红O染色剂进行染色。
1.2.3.3 免疫组织化学染色 肝脏组织用4%多聚甲醛固定后用乙醇溶液梯度脱水,石蜡包埋,制成厚度为5 μm的石蜡切片。使用F4/80抗体和免疫组织化学-兔二步法试剂盒进行染色。
1.2.4肝脏组织甘油三酯水平检测 使用NP40裂解液裂解肝脏组织,用研磨机研磨后按照甘油三酯提取检测试剂盒说明书检测肝脏中甘油三酯的水平。
1.2.5肝脏组织基因表达水平检测 使用TRIzol法提取肝组织提取总RNA,按照RNA逆转录试剂将RNA逆转录为cDNA,按照ChamQ Universal SYBR qPCR Master Mix说明书对FKBP38、过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptors,PPAR-α)、过氧化物酶酰基辅酶A氧化酶1(Acyl Coenzyme A oxidase 1,ACOX-1)、肉毒碱棕榈酰基转移酶1α(carnitine palmitoyltransferase-1α,CPT-1α)、沉默调节蛋白3(sirtuin 3,SIRT3)基因进行实时荧光定量PCR (Quantitative Real-time PCR,qRT-PCR)实验。
1.2.6肝脏组织蛋白表达水平检测 使用RIPA裂解液裂解肝脏组织,在研磨机研磨后在4 ℃下以13 000×g离心15 min,取上清,于100 ℃金属浴变性10 min,蛋白质免疫印迹法检测组织中FKBP38蛋白的表达水平。

2 结果
2.1 肝细胞特异性敲除FKBP38模型鼠的鉴定利用本课题组前期构建的肝细胞特异性缺失FKBP38突变小鼠进行合笼实验[8],剪取子代小鼠的脚趾提取DNA,通过聚合酶链式反应(polymerase chain reaction,PCR)对小鼠基因型进行鉴定,并使用FKBP38-Flox和Alb-Cre特异性引物区分野生型、杂合敲除基因型和纯合敲除基因型小鼠(Fig 1A)。将Alb-Cre/-FKBP38fl/fl小鼠作为野生型组(WT),Alb-Cre/+FKBP38fl/fl突变小鼠作为纯合敲除组(L-FKBP38-/-),在MCD造模后,进一步利用qRT-PCR技术和Western blot技术来检测小鼠肝脏中FKBP38基因及蛋白的表达水平。本研究结果显示,与野生型组(WT)相比,纯合敲除组(L-FKBP38-/-)肝脏中的FKBP38基因转录水平和蛋白表达水平明显降低(P<0.01)(Fig 1B,C),表明L-FKBP38-/-组小鼠肝脏中无FKBP38基因的表达。

Fig 1 Generation of FKBP38 hepatocellular specific knockout
2.2 FKBP38基因的表达对MCD诱导的非酒精性脂肪肝小鼠肝脏的影响
2.2.1对小鼠肝脏损伤的影响 为了探讨肝细胞特异性敲除FKBP38基因对小鼠肝脏损伤的影响,使用全自动生化分析仪检测小鼠血清中ALT和AST的水平。发现与WT组相比,L-FKBP38-/-组小鼠血清中的肝功能指标ALT和AST水平明显升高(P<0.05)(Fig 2A,B)。进一步对小鼠肝脏切片进行HE染色观察,发现与WT组相比,L-FKBP38-/-组小鼠肝脏肝细胞气球样变、肝细胞脂肪空泡及炎症细胞浸润更为明显(Fig 2C)。以上结果表明,肝细胞特异性敲除FKBP38基因加剧小鼠由于MCD诱导的肝脏损伤。

Fig 2 Effect of FKBP38 expression on liver damage in mice with
2.2.2对小鼠肝脏脂质积累的影响 为了探讨肝细胞特异性敲除FKBP38基因对小鼠肝脏脂质积累的影响,使用全自动生化分析仪检测小鼠血清中TG和CHO的水平。与WT组相比,L-FKBP38-/-组小鼠血清中的TG和CHO升高(P<0.05)(Fig 3A,B)。进一步对肝脏切片进行油红染色观察,发现与WT组相比,L-FKBP38-/-组小鼠肝脏脂滴数量更多而且面积更大(Fig 3C)。并且检测肝脏中的TG含量,发现与WT组相比,L-FKBP38-/-组小鼠肝脏中的TG含量升高(P<0.05)(Fig 3D)。以上结果表明,肝细胞特异性敲除FKBP38基因加剧小鼠由于MCD诱导的脂肪积累。
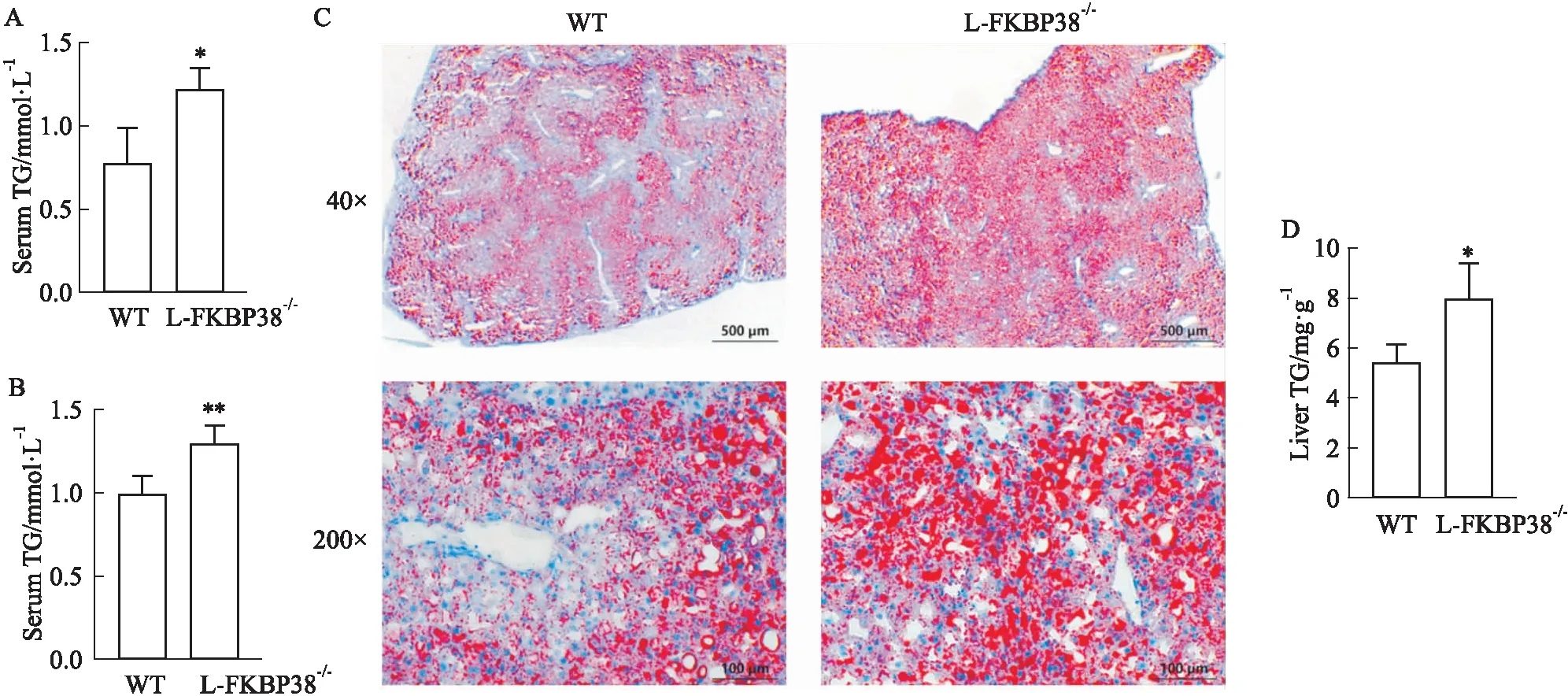
Fig 3 Effect of FKBP38 expression on liver lipid accumulation in mice with
2.2.3对小鼠肝脏巨噬细胞的影响 为了探讨肝细胞特异性敲除FKBP38基因对小鼠肝脏炎症浸润的影响,通过免疫组织化学染色标记小鼠肝脏中成熟的巨噬细胞表面糖蛋白—小鼠含生长因子的粘蛋白样激素受体1(mouse EGF-like module-containing mucin-like hormone receptor-like 1,F4/80)的表达情况。发现与WT组相比,L-FKBP38-/-组小鼠肝脏F4/80阳性率明显增加,说明L-FKBP38-/-组小鼠肝脏中成熟的巨噬细胞数量更多(Fig 4)。以上结果表明,肝细胞特异性敲除FKBP38基因加剧小鼠由于MCD诱导的肝脏巨噬细胞激活。

Fig 4 Effect of FKBP38 expression on liver F4/80
2.3 FKBP38基因的表达对MCD诱导的非酒精性脂肪肝小鼠肝脏脂肪酸氧化相关基因表达的影响为了探讨肝细胞特异性敲除FKBP38基因如何加剧小鼠非酒精性脂肪肝的发生,通过qRT-PCR检测小鼠肝脏中脂质代谢相关基因的表达情况。发现与WT组相比,L-FKBP38-/-组肝脏中PPARα的表达明显下调(P<0.01)(Fig 5A)。并且与WT组相比,L-FKBP38-/-组肝脏脂肪酸β氧化相关基因ACOX-1、CPT-1α、SIRT3的表达明显下调(P<0.05)(Fig 5B-D)。以上结果表明,肝细胞特异性敲除FKBP38基因抑制小鼠由于MCD诱导的肝细胞脂肪酸β氧化。

Fig 5 Effect of FKBP38 expression on expression of fatty acid oxidation gene in mice with
3 讨论
NAFLD是指除了酒精和其他明确的损伤肝脏因素所导致的,以弥漫性肝细胞大泡性脂肪病变为主要病理特征的疾病,NASH为NAFLD的一种严重状态,伴随着肝细胞损伤、脂质积累、炎症和纤维化,后期会发展为肝硬化和肝细胞癌[9]。在过去20年,NAFLD的全球患病率约为0.25,近年来,中国人的饮食结构向高脂高糖的西方饮食结构改变,生活水平的提高和不良生活方式的蔓延导致中国NAFLD患病率急剧上升,并呈年轻化趋势,NAFLD已超过慢性乙型肝炎成为我国第一大肝病,据估计,到2030年,中国NAFLD患者将超过3亿,中国是全球NAFLD患病率增长最快的国家[10]。大部分NAFLD患者对单纯性脂肪肝不重视,随着时间的推移,1/3的单纯性脂肪肝可能会加剧为非酒精性脂肪肝肝炎,因而提高了临床治疗的难度。
NASH的发病机制尚不明确,但是目前较为公认的是二次打击学说[11]。肝脏需要处理大量来自外周脂肪组织和胃肠道的脂质信号分子。当流入肝脏中的脂肪酸过多,而氧化和流出减少时会导致肝脏甘油三酯堆积,使肝脏脂质代谢紊乱,对肝脏进行第一次打击,产生脂肪肝。代谢紊乱会激活巨噬细胞,使巨噬细胞从抗炎型M2亚型向促炎型M1亚型转化,从而触发炎症反应,引起氧化应激、胰岛素抵抗、线粒体功能障碍等,对肝脏进行第二次打击,发展非酒精性脂肪性肝炎及纤维化[12]。
目前,治疗NASH的药物主要在Ⅱ期和Ⅲ期临床试验中,根据药物在肝脏内的作用靶点进行分类,主要包括调节脂质和葡萄糖稳态、肝细胞内氧化应激、线粒体功能障碍、炎症信号向肝细胞聚集的靶点等[3]。导致NAFLD发生和发展的分子途径有很多,因此,探讨NAFLD的发病机制及开发有效药物已成为目前研究热点。
研究表明[13],用MCD喂养C57BL/6小鼠能够诱导小鼠肝脏脂肪变性,从而产生炎症和纤维化,且其肝脏病理变化类似于人类NAFLD的组织学特征。因此,本研究采用MCD喂养小鼠4周产生NAFLD,以探讨肝细胞FKBP38基因的表达对NAFLD模型小鼠肝脏的影响。本研究结果发现,在诱导小鼠产生脂肪肝病变后,与WT组相比,L-FKBP38-/-组小鼠血清中肝功能指标ALT、AST的水平显著升高,肝细胞气球样变更严重,说明L-FKBP38-/-组小鼠肝脏受损更严重。同时,与WT组相比,L-FKBP38-/-组小鼠血清TG和CHO水平以及肝脏TG水平显著升高,肝脏中脂滴数量显著增多,说明肝细胞缺失FKBP38基因促进非酒精性脂肪肝的发生。我们进一步发现与WT组相比,L-FKBP38-/-组小鼠肝脏中F4/80免疫组织化学染色阳性比例增加,说明被激活的巨噬细胞显著增加,可能意味着NAFLD发展为NASH。由于被激活的巨噬细胞中存在抗炎型M2亚型和促炎型M1亚型,两者的比例在炎症的发展过程中起着重要的作用,因此,本研究还需要进一步检测小鼠肝脏中的被激活的M1亚型巨噬细胞的比例,以探讨FKBP38基因的表达对NAFLD发展为NASH的过程中肝脏炎症细胞浸润的影响。此外,因为MCD诱导小鼠肝脏脂质积累的同时也会使小鼠因为缺乏营养而导致体重急剧下降,不能很好地模拟人类由于长期摄入高脂和高糖的食物而导致肥胖及胰岛素抵抗等代谢疾病从而产生非酒精性脂肪肝的生理特征。因此本研究还需要进一步在小鼠营养过剩的条件下探讨FKBP38基因的表达对NAFLD发生和发展的影响。
线粒体是脂肪酸氧化的主要场所,线粒体的功能对NASH的发生和发展起着重要的调控作用[6-7]。研究表明,当线粒体外膜完整性受损时,受Bcl-2家族蛋白调控,线粒体通过释放可溶性蛋白(如细胞色素C)促进细胞凋亡[5]。而shirane等[14]的研究发现,在使用移动性离子载体A23187诱导HeLa细胞胞浆Ca2+浓度升高诱导细胞凋亡时,FKBP38基因的表达能减少发生凋亡的细胞数量,这种抑制细胞凋亡的作用是由FKBP38蛋白通过招募抗凋亡蛋白Bcl-2和Bcl-XL至线粒体来实现的。并且FKBP38蛋白能与自噬核心蛋白Atg8蛋白相互作用,将脂质化的自噬标记物LC3A募集到受损的线粒体从而诱导线粒体自噬,清除受损的线粒体[15]。因此,FKBP38蛋白可能在线粒体发挥正常功能的过程中起着重要的作用。
脂肪酸在线粒体中进行β氧化,产生三磷酸腺苷(ATP)为机体提供能量,而这个活动主要由过氧化物酶体增殖物激活受体PPARα调控[7]。在我们探讨FKBP38基因的表达如何调控肝脏脂肪酸代谢的过程中,发现小鼠肝脏中PPAR-α的转录水平在L-FKBP38-/-组小鼠中明显下调,我们猜测FKBP38基因的表达在线粒体脂肪酸β氧化的过程中发挥着重要的作用,于是我们进一步检测脂肪酸β氧化中关键基因的表达。研究表明,极长链脂肪酸在ACOX-1的催化下脱氢形成脂酰CoA,再通过位于线粒体外膜的CPT-1进入线粒体,在脂肪酸β氧化酶系催化下,进行脱氢、加水,再脱氢和硫解连续反应,最后生成乙酰CoA用于三羧酸循环提供能量[16]。在这一系列的反应中,一些脂肪酸β-氧化代谢酶如长链酰基CoA脱氢酶(LCAD)容易发生过度乙酰化修饰而失去活性,而SIRT3是肝脏线粒体中重要的去乙酰化酶,SIRT3基因表达下调会使线粒体中一些代谢酶过度乙酰化,从而抑制脂肪酸β氧化[17]。我们发现小鼠肝脏中ACOX-1、CPT-1α和SIRT3的转录水平在L-FKBP38-/-组小鼠中显著下调。说明FKBP38基因的表达在线粒体脂肪酸β氧化的过程中发挥着重要的作用,而FKBP38基因的表达如何影响线粒体脂肪酸β氧化仍需进一步深入研究。
此外,FKBP38蛋白作为一种能够调节线粒体功能和抑制细胞凋亡的蛋白,其与癌症发生和发展有着密切的关系,近年来受到研究人员广泛关注。研究表明,FKBP38基因的表达能降低AM3Ca细胞的增殖、迁移和侵袭能力,与子宫内膜癌的发生显著相关[18]。在既往的研究中,研究者大多关注FKBP38蛋白在肿瘤发生和发展过程中的作用,而没有研究针对FKBP38蛋白在脂质代谢中的作用机制,本研究为FKBP38基因的表达在脂质代谢中发挥的功能提供新思路。
综上所述,本研究结果表明,肝细胞特异性缺失FKBP38突变小鼠通过抑制肝脏脂肪酸氧化加剧脂质积累,损伤肝细胞,从而加剧非酒精性脂肪肝。通过本研究,我们首次发现FKBP38基因的表达在脂质代谢中发挥着重要作用,并为NAFLD的治疗提供理论依据。