高血压循环外泌体中关键miRNA的筛选及功能研究
2022-04-07张波涛刘晓艳钟久昌陈牧雷王红石王华光池洪杰
张波涛,袁 雯,刘晓艳,钟久昌,陈牧雷,王红石,王华光,池洪杰
(首都医科大学附属北京朝阳医院,北京市高血压重点实验室,北京 100020)
原发性高血压(essential hypertension,EH)是最常见的慢性病,也是重要的心脑血管疾病的危险因素。中国高血压调查最新数据显示,2012~2015年我国18岁及以上居民高血压患病粗率为27.9%(标化率23.2%),且患病率总体呈增高的趋势[1]。然而,由于对其机制认识不足,高血压治疗领域进展缓慢。如何预防和减少高血压病的发生,以及如何有效的控制已发生的高血压依然是世界性难题。
外泌体(exosome,exo)是最小的细胞外囊泡,由胞内多囊泡小体(multive bodies,MVB)与胞膜融合后分泌到细胞外环境中。外泌体直径为30~100 nm,能通过与靶细胞的细胞膜融合、胞吞等作用方式将携带的微小核糖核酸(microRNA,miRNA)、蛋白质等传递至受体细胞中,介导细胞间的信息交流并调控细胞的生理功能[2]。
miRNA是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,是外泌体的重要信息物质。外泌体携带的miRNA参与了多种疾病的发病过程。在心血管疾病领域,外泌体miRNA是急性心肌梗死的生物标志物和心衰的潜在预测因子,参与了心肌病的发病、在动脉粥样硬化中具有多方面的作用[3]。
外泌体与高血压的研究多集中在尿液外泌体中蛋白和miRNA的检测。部分研究提示,血液源外泌体可能在高血压的发生发展中发挥着重要的作用。血液源外泌体中哪种信息物质影响高血压的发生发展,外泌体miRNA是否参与高血压的发生发展尚不清楚。
为此,本研究提取自发性高血压大鼠(spontaneously hypertensive rats,SHR)血浆外泌体,尾静脉注射的方法注射入血压正常(Sprague Dawley,SD)大鼠体内,观察大鼠血压的变化;提取高血压患者及SHR大鼠的血浆外泌体及外泌体RNA,应用实时聚合酶链反应(real time polymerase chain reaction,RT-PCR)的方法验证本课题组前期筛选出的8个miRNAs的表达变化;Western blot的方法检测人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中转染miR-17-5p mimics后肝激酶B1(liver kinase B1,LKB1)及同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)蛋白水平的表达变化,探讨外泌体参与高血压发生的可能机制,为进一步研究外泌体在高血压的发生发展中的作用提供前期基础。
1 资料与方法
1.1 研究对象
1.1.1研究人群 收集北京朝阳医院2019年2月至2019年7月间门诊就诊的原发性高血压患者20例(高血压组),女性10例,男性10例,平均年龄(43.65±7.99)岁,年龄及性别匹配的健康对照组20例,女性8例,男性12例,平均年龄41.79±9.09岁。入选标准:根据《中国高血压防治指南2018年修订版》建议的高血压诊断标准[6],所有高血压患者需满足如下条件:① 年龄:18~60岁;② 收缩压≥140 mmHg和/或舒张压≥90 mmHg;③ 初次诊断为高血压(病史>2周),未服用过任何类型的降压药物;④ 签署知情同意书。选取20例年龄与性别匹配的正常血压健康志愿者(收缩压≤120 mmHg且舒张压≤80 mmHg)纳入对照组。排除合并其它疾病的患者,如急性感染、肿瘤、糖尿病、冠心病、慢性肾病、血液病等。
1.1.2实验动物 10周龄SPF级雄性SHR、WKY及SD大鼠购自维通利华,许可证号:SCXK(京)2016-0006。本论文遵守美国NIH发布的实验动物保护和使用指南(8th Edition,National Research Council,2011),且动物实验已通过首都医科大学附属北京朝阳医院动物实验伦理审查(2020-动-212)。
1.2 实验材料
1.2.1主要试剂 PBS缓冲液(备ZLI-9062,中杉金桥)、逆转录试剂盒(638316,TaKaRa公司,日本)、qRT-PCR试剂盒(638316,TaKaRa公司,日本)、引物设计(TaKaRa公司,日本)、BCA蛋白浓度测定试剂盒(P0010S,碧云天公司)、、预制胶(NP0321BOX,Invitrogen,美国)、Qiazol Lysis Reagent(77064,Qiagen,美国)、电泳缓冲液(NP0007,NuPAGE,美国)、Exo-Fect SEVs转染试剂盒(EXFT20A-1,SBI,美国)等。
1.2.2主要仪器 荧光定量PCR仪7500(ABI,美国)、微量分光光度计和荧光分光光度计Nanodrop(Thermo Scientific,美国)、超速离心机XPN100(Beckman,美国)、XCell SureLock 小型电泳槽(Thermo Fisher,美国)、旋涡混合仪(Vortex,美国)、酶标仪(Thermo Fisher,美国)、高压灭菌锅(松下公司,日本)等。
1.3 方法
1.3.1人血浆的收集 空腹坐位休息10 min后采集肘静脉血12 mL,置于抗凝管(含EDTA或柠檬酸钠)中,4 ℃条件下静置3~4 h,3 000 r·min-1,4 ℃离心10 min除去大的细胞碎片,取上清即为血浆,将血浆分装(1.5 mL Ep管)并标记,送样前冻存于-80 ℃冰箱。干冰运输。
1.3.2大鼠采血 腹腔注射水合氯醛麻醉,开腹暴露下腔静脉。术者右手持穿刺针,针尖斜面朝下,入针角度约25°~30°,朝向心端方向刺入,深度以5 mm左右为宜。抽血完毕,4 ℃下静置3~4 h,3 000 r·min-1,4 ℃离心10 min,取上清即为血浆,将血浆分装(1.5 mL Ep管)并标记,送样前冻存于-80 ℃冰箱。
1.3.3外泌体提取 每个标本吸取血浆1 000 μL,4 ℃条件下,300×g,离心10 min,取上清液,2 000×g,离心10 min,取上清液,10 000×g,离心30 min,取上清液至超速离心管中,用PBS配平后放入超速离心机中,设置4 ℃,100 000×g,离心70 min,取沉淀物,将沉淀物应用PBS重悬后,4 ℃条件下,给予100 000×g,离心70 min,摒除上清液得到沉淀物,此沉淀物即为血浆外泌体。
1.3.4外泌体鉴定 用50~100 μL 2%多聚甲醛固定液(Paraformaldehyde,PFA)重悬外泌体,取5 μL外泌体悬液滴加到Formvar-carbon载样铜网上,在干燥环境下让Formvar膜吸收20 min,然后放置在PBS液中清洗,然后在50 μL的1%戊二醛液中固定5 min,用100 μL的三蒸水清洗大概2 min(共洗3次),用50 μL的草酸双氧铀液滴在铜网上进行染色处理,时间5 min,并继续用三蒸水清洗3次,每次2 min。将铜网放置在空气中干燥5~10 min,在80 kV的电压下拍摄外泌体电镜照片。
1.3.5外泌体蛋白提取 向离心沉淀的外泌体样品中加入蛋白裂解液,并加入PMSF,终浓度为1 mmol·L-1。在冰上裂解30 min,4 ℃离心,设置条件为10 000 r·min-1,15 min,离心后取上清液,根据蛋白浓度测定的结果加入相应量的蛋白上样缓冲液,99 ℃加热10 min使蛋白变性。
1.3.6尾静脉注射外泌体 将10 W龄SHR和WKY大鼠血浆中的外泌体提取出来,通过尾静脉注射入同龄SD大鼠体内,25 μg·d-1,连续注射3 d。
1.3.7外泌体转染 按照Exo-Fest SEVs转染试剂盒操作,(1)Exosome转染实验:① 准备1.5 mL EP管,如下混合:10 μL Exo-Fect solution+20 μL核酸(20 pmol si/miRNA,1 μg mRNA或5 μg plasmid DNA)+70 μL无菌1xPBS+50 μL无菌1xPBS重悬好的exosome=150 μL转染反应体系。② 轻弹或颠倒EP管3次以混匀反应体系,不可涡旋。③ 将EP管置于37 ℃混合器孵育10 min后,立即置于冰上。④ 终止反应:在转染反应体系中加入试剂盒提供的ExoQuick-TC 30 μL,上下颠倒6次以混匀,不可涡旋。⑤ 将EP管置于冰上(或4 ℃)孵育30 min。⑥ 最高转速13 000~14 000 r·min-1离心3 min。⑦ 弃去上清,300 μL 1xPBS重悬转染好的exosome沉淀。⑧ 转染好的外泌体可用于添加入靶细胞,或者其他体内实验。(2)将Exo-Fect转染的exosome加入靶细胞:① 6孔板每孔使用去exosme的FBS培养约为1×105个细胞,添加至少150 μL转染好的exosome。可根据实验需求调节添加比例。② 继续细胞培养2~24 h,在荧光显微镜下观察。阳性对照Texas Red-labeled siRNA,使用荧光显微镜上标准RFP滤镜设置可观察其通过exosome运输至靶细胞的过程。
1.3.8蛋白免疫印迹 采用Invitrogen NuPAGE Bis-Tris预制胶,通过含有蛋白酶抑制剂的裂解液重悬血清外泌体后提取总蛋白进行分析,将提取后的蛋白加入NuPAGE Bis-Tris预制胶电泳中分离,将其转移到NC膜上,以5% BSA封闭1 h,anti-HSP70及anti-CD63一抗在4 ℃冰箱中孵育过夜,PBS缓冲液冲洗后二抗孵育1 h,用Bio-rad公司的显影装置系统进行曝光并记录曝光结果。
1.3.9提取外泌体总RNA 采用Qiagen公司exoRNeasy Serum/Plasma Maxi Kit,先加入Qiazol裂解,后续加入氯仿、无水乙醇并离心,加入RWT Buffer、RWE buffer至吸附柱,反复离心得到外泌体总RNA。
1.3.10RT-qPCR 采用TaKaRa公司生产的Mir-XTMmiRNA First-Stand Synthesis Kit将提取的总RNAs反转录为cDNA,反应条件为:37 ℃ 1 h,85 ℃ 5 min。PCR反应体系:9 μL TB Green Advantage Premix(2×)、0.5 μL ROX Dye (50×)、0.5 μL miRNA-specific primer(10 μmol·L-1)、0.5 μL mRQ 3’Primer(10 μmol·L-1)、2 μL cDNA、9μL ddH2O。总计25 μL。反应程序:95 ℃ 10min,95 ℃ 15 s、60 ℃ 1 min,95 ℃ 15 s、60 ℃ 1 min、95 ℃ 30 s、60 ℃ 15 s。共40个循环。仪器采用荧光定量PCR仪7500(ABI公司,美国)。实验所用引物序列由TaKaRa公司提供,TaKaRa公司作为专利未公布引物序列。以内参U6为miRNA相对定量参照基因。每份标本设置3个复孔。对每个检测目标基因设定相同的循环阈值(cycle threshold,CT值)极限和截点。计算miRNA表达量,计算公式:2-ΔΔCT来比较组间差异,其中ΔCT=CT(目的基因)-CT(内参基因)。
1.3.11脐静脉内皮细胞培养 人脐静脉内皮细胞购自ATCC公司,使用完全内皮细胞培养基(Scien Cell公司)进行培养。实验使用第4~5代细胞。
1.3.12细胞转染 使用lipofectamin 3000将miR-17-5p的模拟物转染至HUVECs中。
2 结果
2.1 基本资料高血压患者组及对照组临床特征见Tab 1。
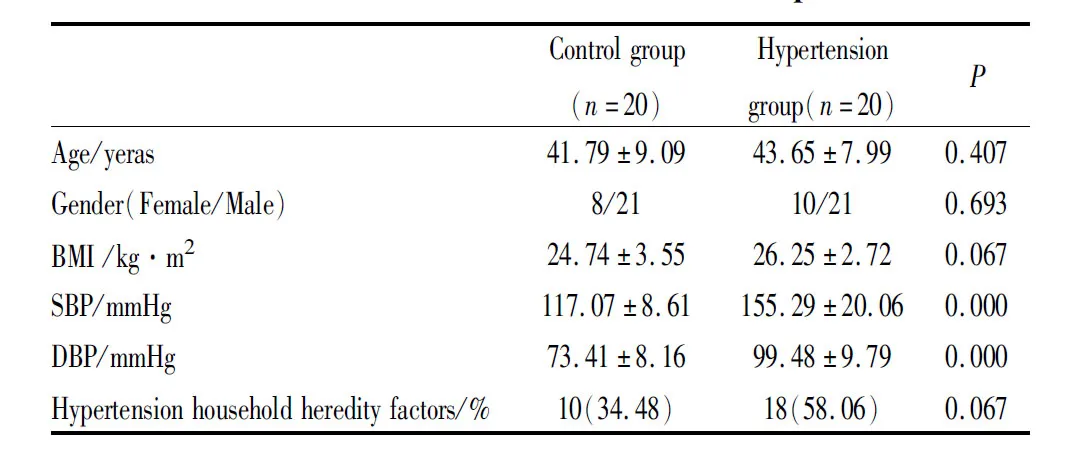
Tab 1 Clinical characteristics of selected patients
2.2 血浆外泌体的鉴定透射电镜检测的结果显示,提取的外泌体呈圆形或类圆形囊泡状,囊泡外周可见其膜性结构,可单个分布也可聚集成群,其内可见低电子密度物质,直径分布于 20~120 nm(Fig 1A)。Western blot的结果显示外泌体中表达特异性标志分子CD9、CD63和Alix(Fig 1B)。
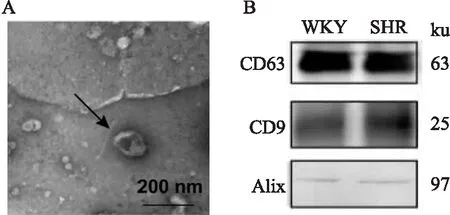
Fig 1 Identification of plasma exosomes from WKY and SHR
2.3 SHR的血浆外泌体可使SD大鼠的血压显著升高将10W龄SHR和WKY血浆中的外泌体提取出来,通过尾静脉注射入同龄SD大鼠体内,25 μg·d-1连续注射3 d。4周后颈内动脉插管法检测的结果显示,接受SHR血浆外泌体(SHR-exos)的SD大鼠(n=5)的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、以及平均动脉压(mean blood pressure,MBP)均高于接受WKY血浆外泌体(WKY-exos)的大鼠(n=6)(Fig 2)。
2.4 高血压患者组及SHR组的血浆来源外泌体miRNA荧光定量PCR验证我们从课题组前期高通量测序的结果[4]中选取了表达差异明显的8个exo-miRNAs,用real time PCR的方法在原发性高血压患者及另一批SHR大鼠中进行了验证。结果显示,miR-17-5p、miR-206-3p、miR-218-5p 3个miRNAs的结果与测序结果一致:miR-17-5p与miR-218-5p在高血压患者及SHR-exos中的表达升高,而miR-206-3p在高血压患者及SHR-exos中的表达降低(Fig 3)。
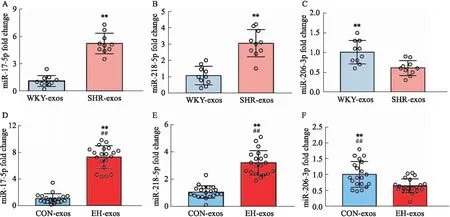
Fig 3 qPCR verification results
2.5 miR-17-5p在SHR-exos促进正常大鼠血压升高过程中发挥重要作用为了明确介导SHR血浆外泌体促进正常大鼠血压升高作用的关键miRNA,我们将miR-17-5p inhibitors、miR-218-5p inhibitors以及miR-206-3p mimics分别转染入SHR的血浆外泌体中后再通过尾静脉注射入SD大鼠体内。4周后颈内动脉插管法检测的结果显示, miR-17-5p inhibitors可以减弱SHR-exos升高血压的作用,而miR-218-5p inhibitors和miR-206-3p mimics对SHR-exos升高血压的作用则没有影响(Fig 4),提示miR-17-5p在SHR大鼠血浆外泌体促进正常大鼠血压升高过程中发挥了重要的作用。
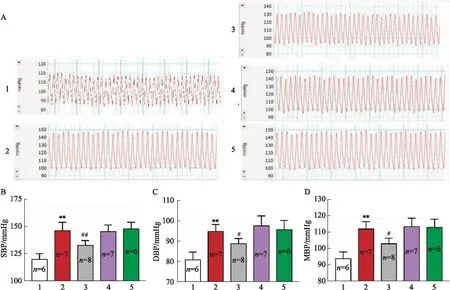
Fig 4 miR-17-5p inhibitors significantly attenuated effect of SHR-exos on raising SBP, DBP and MBP in WKYs,
2.6 miR-17-5p 可下调LKB1及PTEN的表达为了明确exo-miR-17-5p参与高血压发生发展的机制,我们用TargetScan对miR-17-5p的靶基因进行了预测,发现肝激酶B1(liver kinase B1,LKB1)可能是miR-17-5p的靶基因,并用Western blot的方法在体外培养的脐静脉内皮细胞(HUVECs)中进行了初步验证,结果表明miR-17-5p模拟物(mimics)可以下调LKB1的表达,提示LKB1很可能是miR-17-5p的靶基因。此外,已有研究证明,同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)也是miR-17-5p的靶基因,我们的结果亦表明,转染miR-17-5p mimics可以下调PTEN的表达(Fig 5)。这些结果表明,miR-17-5p很有可能是通过调控LKB1和PTEN来发挥升高血压的作用。
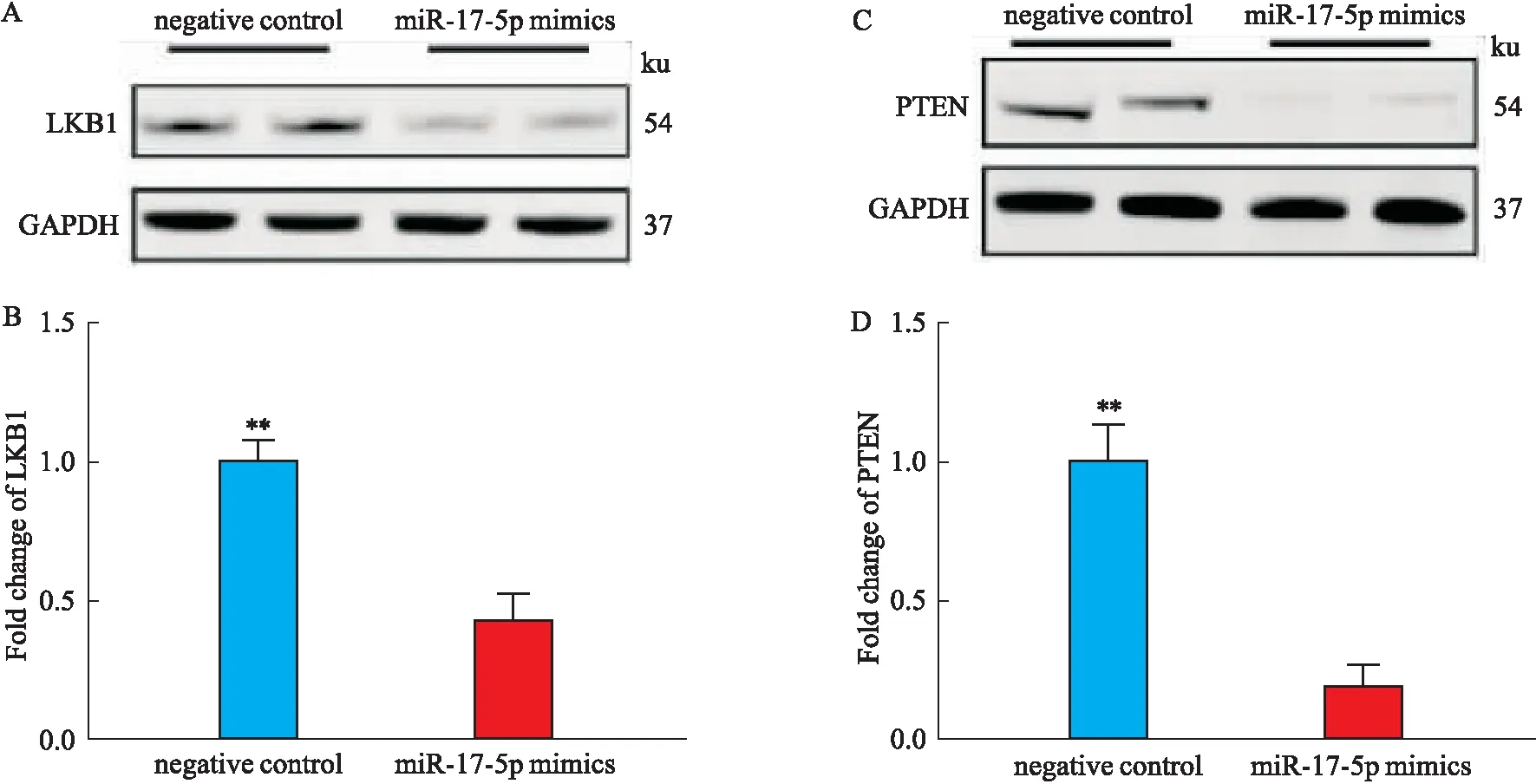
Fig 5 miR-17-5p down-regulated expression of LKB1 and PTEN
3 讨论
原发性高血压的发病机制主要与遗传机制(单基因、多基因遗传模式和基因多态性等)、大动脉弹性减退、周围血管阻力升高、肾脏排钠能力下降、交感神经系统α受体功能亢进、压力感受器功能下降和血小板功能减退等有关[5]。在分子水平上高血压发生发展的许多方面仍然未知。
外泌体的细胞微泡结构使其成为循环中遗传物质或蛋白质的运输载体,其中包含着大量的DNA、mRNA、miRNA、lncRNA、蛋白质和脂质[7],而miRNA约占外泌体总RNA的76.2%[8],miRNA是数量最多的外泌体成分。鉴于上述miRNAs在血清中的变化和其潜在生物学功能,考虑到外泌体是由被激活的或处于疾病状态下的细胞分泌到外周循环中的,我们有理由相信循环外泌体介导的miRNAs可以在高血压患者中差异表达。但是,外泌体介导的miRNA与高血压方面的研究多见于尿液方面。肾脏中多种细胞分泌的外泌体可在尿液中检测到,研究证实尿液外泌体中离子通道相关蛋白如噻嗪类敏感的钠氯离子转运蛋白(Na+-Cl-cotransporter,NCC),水通道蛋白2等与高血压相关[9]。miRNA表达谱检测发现,高血压患者尿外泌体中含有多种miRNAs[10]。
有研究报道,静脉注射到动物体内的外泌体可随血液循环到达各种组织[14-17]。Vandergriff等[11]通过尾静脉注射6×109个CHP-XO(CHP targeted exosomes,心脏归巢肽靶向外泌体)后,在d 21观察到CHP-XO促进了心脏缺血/再灌注损伤大鼠的心脏修复、增加了心脏增殖以及促进了血管生成。Zhang等[12]将25 μg间充质干细胞衍生的外泌体(mesenchymal stem cell-derived exosomes,MSC-EXO)通过尾静脉注射入肺动脉高压大鼠体内,4周后观察到MSC-EXO可降低肺动脉高压大鼠的右室收缩压、肺动脉收缩压和肺血管重构程度。因此,本研究将SHR血浆外泌体注射入血压正常大鼠尾静脉,在4周后对大鼠的血压进行了检测,与预期一致,注射SHR-exo大鼠的收缩压、舒张压、平均动脉压均明显升高,提示血浆外泌体可能参与高血压的发生发展,与Otani等[13]的研究结果一致。
课题组前期已报道,SHR大鼠血浆外泌体中miRNA表达谱与WKY大鼠相比差异明显[4],我们进一步挑选了表达差异明显的8个exo-miRNAs,用real time PCR的方法在原发性高血压患者及另一批SHR大鼠中进行了验证。结果发现miR-17-5p、miR-206-3p、miR-218-5p 3个miRNAs的结果与测序结果一致:miR-17-5p与miR-218-5p在高血压患者及SHR-exos中的表达升高,而miR-206-3p在高血压患者及SHR-exos中的表达降低。
本研究发现,循环外泌体中miR-17-5p表达升高,可能与高血压的发病机制有关。miR-17-5p属于miR-17-92基因簇,它和miR-17-3p、miR-18a、miR-19a、miR-19b、miR-20a、miR-92a被RNase Ⅲ酶切割,从而由Pri-miR-17-92加工成7个单独的成熟miRNA。miR-17-5p位于13q31.3上1个约长7 kb的初级转录本C13orf25的第一个内含子上,在淋巴瘤、结直肠癌、肺癌患者中,该位点的基因常常会高表达,发挥促癌或者抑癌的作用。
本研究结果表明,在HUVECs中miR-17-5p可下调LKB1的表达。LKB1即丝氨酸-苏氨酸激酶11(serine-threonine kinase 11,STK11),其基因定位于19号染色体短臂13.3区域,是一种保守的抑癌基因[14]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是调节能量代谢的关键分子,在多种细胞中可以被LKB1激活。AMPK被激活后会磷酸化几个关键蛋白,并介导参与代谢调节的多种下游途径:减少糖异生、脂肪酸和胆固醇合成、增加肌肉细胞葡萄糖转运、脂肪酸氧化和线粒体生物发生。LKB1可通过AMPK-小窝蛋白1(caveolin-1)-eNOS途径调节内皮细胞的功能和血压,内皮特异性敲除LKB1的小鼠表现出内皮细胞功能的障碍和高血压[15]。Dolinsky等[16]发现高剂量白藜芦醇(RESV)可通过LKB1-AMPK-eNOS信号转导轴来减少氧化应激、改善血管功能、减轻高血压并防止心脏肥大。
此外,研究报道PTEN也是miR-17-5p的靶基因[17]。PTEN是一种肿瘤抑制因子,也是突变率最高的几个抑癌因子之一,可通过其脂质磷酸酶活性来拮抗磷脂酰肌醇三激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)信号通路,从而控制一系列细胞生理过程[18]。AKT通过对内皮细胞的影响在病理和生理性血管生成中都发挥着重要作用。在内皮细胞中,P13K-AKT信号通路可被血管内皮生长因子(vascular endothelial growth factor,VEGF)强烈激活,而AKT靶标的磷酸化可能有助于内皮细胞的存活、生长及增殖。此外,通过对S1177的直接磷酸化,AKT激活内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)。活化的eNOS产生释放的NO可以刺激血管舒张、血管重塑和血管生成,在高血压中发挥着重要的作用。我们的结果表明,在HUVECs中miR-17-5p的确可以下调PTEN的表达,提示PTEN-PI3K/AKT信号通路也参与了循环exo-miR-17-5p升高血压的作用。
综上所述,本研究的结果表明循环外泌体中miR-17-5p在高血压的发生发展过程中发挥着重要的作用,且其升压作用可能是通过对LKB1/PTEN信号的调节实现的。外泌体miR-17-5p可能成为高血压新的治疗靶点。