Exendin-4通过调控SIRT1/P53信号通路改善高糖作用下的内皮祖细胞功能障碍
2022-04-07谢华强
赵 祺,涂 强,谢华强,曹 政,2
(1. 十堰市太和医院,2. 湖北医药学院,湖北 十堰 442000)
内皮祖细胞(endothelial progenitor cells,EPCs)来源于造血干细胞,在血管内皮损伤修复及出生后血管生成中扮演着重要的角色。研究表明,EPCs的循环数量可以作为心血管患者预后的预测因素,冠心病和(或)糖尿病患者EPCs数量及功能明显受损,因此,积极寻求改善EPCs数量及功能的有效手段是目前临床亟待解决的问题[1-2]。Exendin-4是胰高糖素样(glucagon-like peptide-1,GLP-1)受体激动剂,其商品名为艾塞那肽,目前广泛用于2型糖尿病的临床治疗。大量研究证实,GLP-1受体激动剂除了具有降血糖作用外,还可明显降低心血管不良事件的发生率,其保护效应与抗炎、抑制氧化应激、改善内皮功能等有关。但Exendin-4对高糖作用下EPCs是否具有有益效用尚不清楚,本研究旨在观察Exendin-4对高糖作用下EPCs功能活性的的影响,并探讨Exendin-4改善高糖作用下EPCs功能活性的可能机制。
1 材料与仪器
外周血单核细胞分离液及人纤维连接蛋白均购自美国Sigma公司;内皮细胞专用培养基(EGM-2)购自美国PromoCell公司;逆转录PCR试剂盒购自TaKaRa公司;Exendin-4(批号:HY-13443)、EX-527(批号:HY-15452)及SRT1720(批号:HY-10532)均为美国MedChemExpress公司产;甘露醇(批号:IM0040)及D-葡萄糖(批号:G8150)购自索莱宝科技有限公司;CCK-8试剂、BCA蛋白浓度测定试剂盒和RIPA蛋白裂解液、SDS-PAGE凝胶配制试剂盒及β-actin抗体均购自碧云天公司;乳酸脱氢酶(LDH)检测试剂盒及丙二醛(MDA)测定试剂盒产自南京建成生物工程研究所;SIRT1抗体、p53抗体、乙酰化p53抗体购自美国CST公司;其它试剂均为进口分装或国产分析纯。高速大容量离心机购自德国Eppendorf公司;二氧化碳培养箱购自美国Thermo Scientific公司;实时荧光定量PCR仪购自德国Eppendorf公司;多功能酶标仪购自美国BIOTEK公司;MiniProGelTM蛋白制胶、电泳与转膜套件及超高灵敏度化学发光仪均购自美国Bio-Rad公司。
2 方法
2.1 晚期EPCs分离及培养获取健康志愿者外周静脉血约30 mL,采用外周血单核细胞分离液纯化出血单个核细胞后重悬于EGM-2培养基(含配套生长因子),接种于预先包被好纤维连接蛋白(5 mg·L-1)的6孔板中,每3 d换液,培养至28 d左右的贴壁细胞即为实验所用的晚期EPCs。本实验经十堰市太和医院伦理委员会批准,所有志愿者均签署知情同意书。
2.2 实验分组将晚期EPCs置于5% CO2,37 ℃培养箱中,采用5%胎牛血清的EGM-2培养基培养,0.25%胰酶消化传代。用高糖培养基联合不同浓度Exendin-4(12.5、50、100、200 μmol·L-1)孵育EPCs 72 h,确定Exendin-4的最适浓度。在筛选出最为合适的Exendin-4浓度后,进一步将其随机分为甘露醇对照组(加入甘露醇维持和高糖组相同的渗透压)、高糖组(葡萄糖含量为25 mmol·L-1)、高糖+Exendin-4组、高糖+EX-527组、高糖+Exendin-4+EX-527和高糖+SRT1720组。各组细胞在处理72 h后进行相关指标检测。
2.3 EPCs活力检测将晚期EPCs消化重悬后接种于96孔板中(1×103个细胞/孔),在EGM-2培养基中加入或不加入Exindin-4(12.5、50、100、200 μmol·L-1)并联合高糖(25 mmol·L-1)培养,甘露醇对照组在正常培养基基础上加入甘露醇。各组细胞在处理72 h后按照说明书加入CCK-8溶液,并在37 ℃下孵育3 h。用酶标仪在450 nm处检测各孔的吸光度,根据OD值计算细胞活力大小。
2.4 EPCs迁移能力检测各组细胞在处理72 h后检测EPCs迁移能力。将各组EPCs消化后重悬,按2×104个EPCs加入Boyden小室上室,在下室中加入700 μL EGM-2培养基,细胞培养8 h后取出Boyden小室,用4%多聚甲醛溶液固定细胞10 min,0.1%结晶紫染色10 min后用棉签小心擦掉小室滤膜孔上表面上未迁移的细胞并于倒置显微镜下计数。
2.5 EPCs黏附能力检测各组细胞在处理72 h后检测EPCs黏附能力。将各组EPCs消化、重悬,按1×105/孔接种到预先包被有人纤维连接蛋白的6孔板中,细胞培养3 h后弃去未贴壁细胞,PBS清洗2次,用4%多聚甲醛溶液固定细胞10 min,0.1%结晶紫染色10 min后于倒置显微镜下拍照并计算黏附细胞个数。
2.6 EPCs小管形成实验各组细胞在处理72 h后检测EPCs小管形成能力。将Matrigel放入4 ℃融化,待Matrigel完全融化后,冰上操作,在24孔板底部各加入100 μL基质胶,在37 ℃放置2 h使Matrigel完全凝固。将各组细胞消化重悬并计数,按每孔1×105个细胞接种于24孔培养板中,培养8 h后,使用倒置显微镜拍照记录EPCs小管形成能力,并使用ImageJ软件对管腔形成情况进行分析。
2.7 乳酸脱氢酶(LDH)和丙二醛(MDA)水平检测各组细胞在处理72 h后采用RIPA裂解液裂解细胞,4 ℃ 12 000 r·min-1离心10 min后取上清。同时按照LDH和MDA检测试剂盒进行检测,按照厂家说明书建立标准曲线,于酶标仪下分别检测各组样品的OD值,并根据OD值计算出LDH和MDA的活性。
2.8 实时荧光定量PCR检测TNF-α、IL-1β及IL-6的mRNA表达各组细胞在处理72 h后检测EPCs中TNF-α、IL-1β及IL-6的mRNA表达。使用Trizol试剂提取细胞中总RNA,测定总RNA浓度,按照反转录试剂盒说明书将RNA反转录获得cDNA。PCR引物由上海生物工程有限公司合成。TNF-α的上游引物序列为5′-TGGGATCATTGCCCTGTGAG-3′,下游引物序列为5′-GGTGTCTGAAGGAGGGGGTA-3′;IL-1β的上游引物序列为5′-GGCTGCTCTGGGATTCTCTT-3′,下游引物序列为5′-ATTTCACTGGCGAGCTCAGG-3′,IL-6的上游引物序列为5′-TTTTGGTGTTGTGCAAGGGTC-3′,下游引物序列为5′-ATCGCTCCCTCTCCCTGTAA-3′;内参照β-actin的上游引物序列为5′-CATGTACGTTGCTATCCAGGC-3′,下游引物序列5′-CTCCAATGTCACGCACGAT-3′。置于实时荧光定量PCR仪中进行扩增,采用2-ΔΔCT法计算各组细胞中mRNA的相对表达量。
2.9 Western blot检测EPCs中SIRT1、p53和Ac-p53蛋白表达各组细胞在处理72 h后采用含有蛋白酶抑制剂的RIPA裂解液裂解细胞,4 ℃ 12 000 r·min-1离心10 min后取上清,BCA法测定蛋白浓度。蛋白经SDS-PAGE电泳,并转印SIRT1、p53、Ac-p53蛋白至PVDF膜上,用5%脱脂奶粉TBST溶液室温封闭1 h,用相应的特异性一抗4 ℃孵育过夜,再经洗膜,然后孵育相应二抗室温2 h后再次洗膜,最后采用ECL化学发光法显影,经ImageJ软件进行吸光度测定,并与内参β-actin吸光度相比较得到各组蛋白条带相对值。
2.10 统计学分析
3 结果
3.1 Exendin-4改善高糖作用下EPCs活力为探讨Exendin-4对高糖作用下EPCs活力的影响,本研究将晚期EPCs与含或不Exendin-4(12.5、50、100、200 μmol·L-1)的高糖培养基在37 ℃下培养72 h后检测其细胞活力并筛选最为合适的药物作用浓度。CCK-8实验结果显示,Exendin-4以剂量依赖性改善高糖作用下EPCs细胞活性,其中Exendin-4以50 μmol·L-1的浓度作用最为明显(Fig 1,P<0.05),故后续实验采用50 μmol·L-1的Exendin-4进行干预。
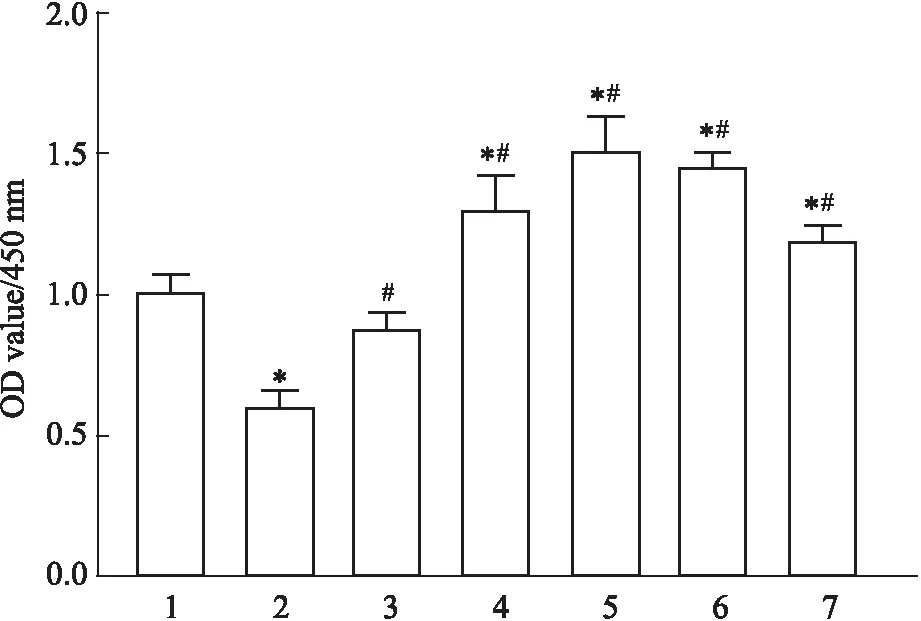
Fig 1 Effects of Exendin-4 on viability of EPCs with high glucose treatment n=5)
3.2 Exendin-4改善高糖作用下EPCs迁移能力采用Transwell小室法探讨50 μmol·L-1的Exendin-4处理对高糖作用下EPCs体外迁移能力的影响。结果显示:高糖处理可显著下调EPCs体外迁移能力(Fig 2,P<0.05),Exendin-4处理可提高高糖作用下EPCs体外迁移能力(Fig 2,P<0.05)。为进一步评估Exendin-4的作用是否依赖于SIRT1/P53信号通路,我们使用SIRT1抑制剂(EX-527)和SIRT1激动剂(SRT1720)联合处理EPCs 72 h。结果显示SIRT1抑制剂(EX-527)干预后能够抑制Exendin-4增强EPCs迁移能力的效应(Fig 2,P<0.05),单独使用SIRT1激动剂(SRT1720)也可改善高糖作用下的EPCs迁移能力(Fig 2,P<0.05)。

Fig 2 Representative photographs and quantification analysis of migratory activity of EPCs
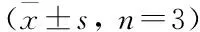
A:Control; B:HG;C:HG+EX-4; D:HG+EX-527; E:HG+EX-4+EX-527; F:HG+SRT1720.*P<0.05 vs control group; #P<0.05 vs HG group.
3.3 Exendin-4改善高糖作用下EPCs黏附能力与甘露醇对照组相比,高糖处理组EPCs黏附能力明显下降(Fig 3,P<0.05);与高糖处理组相比,Exendin-4组EPCs体外黏附能力明显提高(Fig 3,P<0.05)。而SIRT1抑制剂(EX-527)干预后能够抑制Exendin-4增强EPCs黏附能力的效应(Fig 3,P<0.05), 单独使用SIRT1激动剂(SRT1720)也可改善高糖作用下的EPCs黏附能力(Fig 3,P<0.05)。

Fig 3 Representative photographs and quantification analysis of adhesion of EPCs n=3)
3.4 Exendin-4改善高糖作用下EPCs小管形成能力体外小管形成实验显示,高糖处理可明显降低EPCs小管形成能力(Fig 4,P<0.05);Exendin-4处理则可改善高糖作用下的EPCs体外小管形成障碍(Fig 4,P<0.05),说明Exendin-4具有促进EPCs在Matrigel 上形成小管的作用。SIRT1抑制剂(EX-527)干预后能够抑制Exendin-4对EPCs的促血管形成效应(Fig 4,P<0.05),单独使用SIRT1激动剂(SRT1720)也可改善高糖作用下的EPCs小管形成能力(Fig 4,P<0.05)。

Fig 4 Representative photographs and quantification analysis of tube formation of EPCs n=3)
3.5 Exendin-4改善高糖作用下EPCs乳酸脱氢酶(LDH)和丙二醛(MDA)水平与甘露醇对照组相比,高糖处理组EPCs LDH及MDA水平明显升高(Fig 5,P<0.05)。与高糖处理组EPCs相比,Exendin-4组LDH及MDA水平明显改善(Fig 5,P<0.05)。SIRT1抑制剂(EX-527)干预后能够抑制Exendin-4对EPCs的保护效应(Fig 5,P<0.05),单独使用SIRT1激动剂(SRT1720)也可改善高糖作用下的EPCs LDH及MDA的产生(Fig 5,P<0.05)。
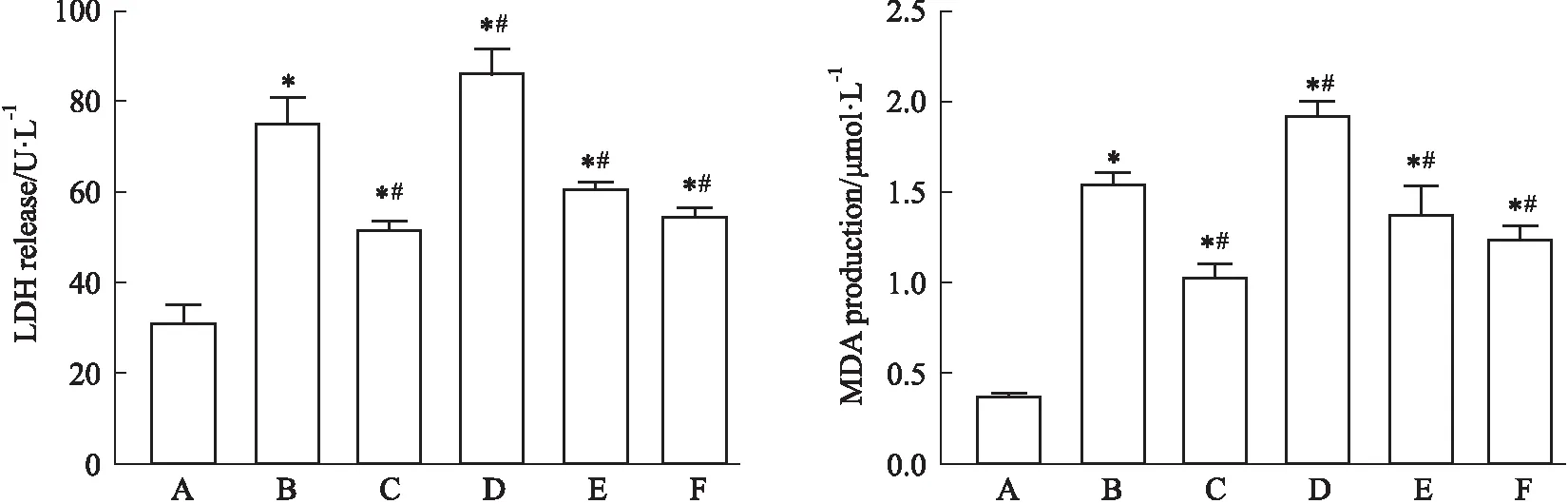
Fig 5 Effects of Exendin-4 on level of LDH and MDA with high glucose treatment n=3)
3.6 Exendin-4抑制高糖作用下EPCs炎症因子产生RT-qPCR显示,高糖处理可明显上调EPCs TNF-α、IL-β及IL-6的mRNA表达(Fig 6,P<0.05)。与高糖处理组EPCs相比,Exendin-4组EPCs TNF-α、IL-β及IL-6的mRNA表达水平明显下调(Fig 6,P<0.05)。说明Exendin-4具有抑制高糖作用下细胞炎症因子表达的作用。而SIRT1抑制剂(EX-527)干预后,Exendin-4的抗炎效应被抑制(Fig 6,P<0.05)。单独使用SIRT1激动剂(SRT1720)也可改善高糖作用下的EPC TNF-a,IL-β及IL-6的mRNA表达(Fig 6,P<0.05)。

Fig 6 Effects of Exendin-4 on mRNA level of TNF-α、IL-1β and IL-6 with high glucose treatment n=3)
3.7 Exendin-4通过SIRT1/p53信号通路调控高糖作用下EPCs功能活性Western blot结果分析显示,高糖处理可明显下调EPCs SIRT1表达并增加p53乙酰化水平(Fig 7,P<0.05)。Exendin-4处理可显著上调高糖处理组EPCs SIRT1表达并降低p53乙酰化水平(Fig 7,P<0.05)。如Fig 7所示,SIRT1抑制剂可处理可显著逆转Exendin-4的SIRT1激活效应(Fig 7,P<0.05)。这些结果提示,Exendin-4主要通过SIRT1/p53信号通路调控高糖作用下EPCs功能活性。

Fig 7 Effects of Exendin-4 on protein expression of SIRT1 and P53 with high glucose treatment n=3)
4 讨论
Asahara等[5]于1997年首次从成人外周血中分离出一类具有促进血管内皮修复及新生血管形成效应的内皮细胞前体细胞,后被命名为“内皮祖细胞”。目前,根据其表面标志物的不同,可以分为早期EPCs和晚期EPCs:早期EPCs增殖能力低下,主要通过旁分泌作用促进周围血管内皮细胞修复;晚期EPCs增殖能力旺盛,可进一步分化为成熟内皮细胞并促进新生血管形成[6-7]。作为种子细胞,EPCs在冠心病、糖尿病等缺血性疾病的治疗中具有极大的潜力。既往研究显示,EPCs在体外经过高糖处理后,迁移能力和管型形成能力受损[8-9]。糖尿病患者循环血中早期及晚期EPCs的数量均较正常人下降,其增殖、迁移、黏附和管型形成能力减弱,即使血糖纠正后EPCs功能异常仍不能完全恢复[10-11]。因此积极寻求改善糖尿病EPCs功能活性,是防治糖尿病心脑血管并发症的干预手段之一。
胰高血糖素样肽-1(GLP-1)是肠道L细胞分泌的一种多功能激素,除了控制血糖、抑制胃排空、降低食欲,还表现出对心血管疾病的保护作用。天然GLP-1半衰期极短,在血液中很快被二肽基肽酶Ⅳ(dipeptidyl-peptidase,DPP-4) 降解失活而使临床使用受限。Exendin-4是GLP-1受体激动剂,具有较长的半衰期,与GLP-1受体结合后产生与GLP-1相似的生理效应。国外已有相关研究报道Exendin-4能够改善糖尿病动物心肌的氧化应激、脂质代谢,逆转心脏重塑,但具体机制仍未完全阐明[12]。
沉默信息调节因子1(silent information regulator 1,SIRT1)为依赖于烟酰胺腺嘌呤二核苷酸的组蛋白脱乙酰酶,主要参与调节DNA损伤修复、肌肉和脂肪分化、神经发生、线粒体稳态、葡萄糖和胰岛素代谢以及细胞应激等,在生物代谢、发育、细胞存活和衰老中起重要作用[13-14]。近来研究表明,SIRT1通过调控下游转录分子,具有多重心血管保护作用。研究证实,在糖尿病小鼠模型中上调SIRT1表达可减轻氧化应激、抑制炎症反应并明显改善小鼠受损的内皮功能[15]。此外,研究发现野生型糖尿病小鼠的主动脉中超氧化物歧化酶(MnSOD)显著下调,而内皮特异性SIRT1转基因小鼠成功逆转了MnSOD的下降,从而提示SIRT1/MnSOD途径在抑制高血糖引起的内皮功能异常中起着关键作用[16]。本研究证实:高糖处理可显著抑制晚期EPCs增殖、迁移、黏附、小管形成能力,同时导致细胞乳酸脱氢酶(LDH)和丙二醛(MDA)水平升高,上调炎症因子表达,其机制与高糖诱导的SIRT1表达下调有关。Exendin-4可上调SIRT1表达,降低p53乙酰化水平,进而改善高糖的诱导的EPCs功能障碍,但其保护效应可被SIRT1抑制剂所削弱。同时SIRT1激动剂亦可模拟Exendin-4的保护效应,由此说明Exendin-4的有益效应是通过调控SIRT1/p53信号通路介导的。
综上所述,本研究通过体外构建高糖诱导的EPCs损伤模型,探讨了Exendin-4对高糖作用下EPCs功能活性的影响以及其可能机制。研究初步发现高糖可下调SIRT1表达导致EPCs功能障碍;Exendin-4可通过上调SIRT1表达,改善高糖诱导的EPCs功能障碍。本研究揭示了Exendin-4对高糖作用下EPCs的保护效应,以及SIRT1蛋白在其中所发挥的作用,为利用EPCs开展疾病治疗提供了实验依据。