博来霉素诱导的肺纤维化形成不同时期模型大鼠血清代谢组学研究
2022-04-07陈叶青仇双逸范欣生胡方媛周丽萍
陈叶青,仇双逸,范欣生,胡方媛,周丽萍
(南京中医药大学中医学院·中西医结合学院,江苏 南京 210023)
代谢组学作为一种组学检测技术,能够在特定条件如疾病或药物治疗情况下对生物体内的小分子代谢产物进行全面整体的分析[1]。气相色谱-质谱联用(GC-MS)是一种常见的代谢组学分析方法,具有样品制备方便、分析快速和重现性高等优势[2]。目前被广泛用于药理学机制,药物靶点筛选和发现疾病相关生物标志物等研究中[3-4]。
肺纤维化(pulmonary fibrosis,PF)是一种间质性肺疾病,严重的肺纤维化疾病包括特发性肺纤维化会导致肺功能不可逆性下降,除肺移植外目前尚无治愈的方法[5],常提示预后不良[6-7]。PF的发病机制尚不完全清楚,目前认为肺泡上皮细胞损伤是发病的开始,随后成纤维细胞/肌成纤维细胞的转分化[8]、活化和扩增,导致细胞外基质沉积,破坏正常的肺组织结构形成纤维化[9]。气管内滴注博来霉素(bleomycin,BLM)复制的PF大鼠模型与人体发病情况较为接近,故该模型被广泛用于对PF疾病的研究[10]。
目前,多见运用代谢组学方法进行诊断后的PF(特发性肺纤维化报道的较多)疾病生物标志物发现和鉴定研究,但该疾病发生发展过程中代谢物水平如何变化的尚无报道。在本实验中,我们以气管内滴注BLM复制PF大鼠模型,并利用GC-MS技术建立PF大鼠血清样本的分析方法以及采集PF不同时期大鼠血清代谢指纹图谱。通过多变量统计分析方法,主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)对PF不同时期大鼠血清代谢轮廓进行分析,筛选并鉴定差异代谢物以及挖掘代谢物参与的重要代谢途径,从代谢组学角度探讨PF疾病发生发展的机制。
1 材料与方法
1.1 材料SPF级♂ SD大鼠购自上海斯莱克实验动物有限责任公司(许可证号:2017-0005),注射用BLM购自瀚晖制药有限公司(批号:19033911,规格:1.5万BLM单位),羟脯氨酸(HYP)检测试剂盒购自南京建成生物工程研究所,甲氧胺、吡啶、N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)、1,2-13C2肉豆蔻酸均购自Sigma-Aldrich公司。
1.2 PF大鼠模型的复制及评价本实验采用气管内滴注BLM复制PF大鼠模型,通过组织病理学检测评价PF大鼠模型。♂ SD大鼠50只,适应性饲养3 d,随机分为空白对照组(Control)、模型7 d组(M7)、模型14 d组(M14)、模型21 d组(M21)、模型28 d组(M28),每组各6~8只。PF模型组于d 1气管滴注BLM(5 mg·kg-1),各组大鼠分别于造模d 8、d 15、d 22、d 29从组织病理学(HE、Masson染色)、肺组织HYP含量方面对PF大鼠模型进行评价。
1.3 肺组织病理学观察取固定于10%福尔马林溶液的大鼠肺脏,脱水,石蜡包埋,切片,HE和Masson染色,在光学显微镜下进行病理学观察。病变评估:根据病变由轻到重的程度标记为0分(基本正常)、0.5分(轻微)、1分(轻度)、2分(中度)、3分(重度)。
1.4 肺组织HYP含量测定精确称取肺组织湿重100 mg于试管中,准确加入1 mL水解液制备组织匀浆,按说明书方法用碱水解法测定肺组织HYP含量。
1.5 样本收集及预处理实验开始后,于模型复制d 8、d 15、d 22、d 29肝门静脉采血,收集血清,室温静置30 min后于4 ℃,4 000 r·min-1离心10 min,取上清液于-80 ℃冷冻备用。同时取大鼠右肺,用液氮速冻后放入-80 ℃冷冻备用。将存放于-80 ℃的各组血清样品置于冰上解冻,涡旋混匀后精密吸取50 μL,加入含有1,2-13C2肉豆蔻酸(12.5 mg·L-1)[11]的冰甲醇200 μL涡旋3 min,挥干2 h,再加入10 g·L-1甲氧基胺盐酸盐的吡啶溶液30 μL,混匀后于30 ℃、300 r·min-1振荡1.5 h。加入BSTFA 30 μL,混匀,37 ℃、300 r·min-1振荡0.5 h,18 000 r·min-1离心10 min,取上清50 μL进样,供GC-MS分析得到代谢指纹图谱。
1.6 GC-MS检测运用GC-MS联用仪(Trace 1310-TSQ 8000)进行血清样本检测,参数设置[12]:载气为氦气,流速为1.2 mL·min-1,采用分流模式,进样口温度250 ℃,分流比为20 ∶1,升温程序:起始温度60 ℃,保持1 min后,以20℃/min升至320 ℃后,保持5 min。EI源:离子源温度280 ℃,离子传输线温度250 ℃,电离能70 eV,采集范围m/z 50~500。

2 结果
2.1 大鼠肺组织病理学改变与空白对照组比较,各模型组(M7、M14、M21、M28)大鼠随着造模的进程,肺组织逐渐出现病变情况。HE染色显示肺组织结构被破坏,肺泡壁有炎细胞浸润,提示炎症病变。Masson染色时肺泡壁和肺内支气管、血管分支周围间质有成纤维细胞增生并形成胶原纤维,呈蓝绿色染色反应,提示纤维化病变。与空白对照组相比,模型M7组即造模d 8的模型大鼠肺组织肺泡壁和间质有炎细胞浸润;造模d 15(M14)胶原纤维增生较7 d模型呈增加趋势;造模22 d(M21)炎症病变较7 d时呈减轻趋势,胶原纤维增生较7 d时明显增加;造模29 d(M28)炎症病变较7 d模型明显减轻,胶原纤维增生较7、14 d时显著增加,见Fig 1、2,Tab 1。
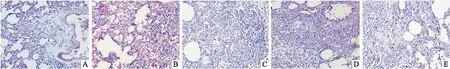
Fig 1 HE stainning results of tissue sections of right lung in rats (×200)A: Control, B: M7, C: M14, D: M21, E: M28.
2.2 大鼠肺组织中HYP含量改变与空白对照组比较,各模型组大鼠肺组织中HYP含量逐渐明显增加,造模d 22(M21)HYP含量最高,见Tab 1。
Tab 1 Comparison of HE staining, Masson staining score and HYP content in lung tissues in each group n=6)
2.3 多元统计分析对PF模型大鼠血清代谢轮廓分析,采用PCA无监督模式识别分析方法对血清样本间差异进行直观显示。如Fig 3所示,在PCA模型中,各组大鼠模型的大鼠血清样本与对照组有一定的区分。为进一步建立各组间的特异性差异模型,应用OPLS-DA表征组间真实差异,从OPLS-DA得分图(Fig 4)可知,组间样本区分显著。

Fig 2 Masson stainning results of tissue sections of right lung in rats (×200)A: Control, B: M7, C: M14, D: M21, E: M28.

Fig 3 PCA 2D score of serum samples of control group and model group

Fig 4 OPLS-DA of serum metabolites
2.4 PF模型大鼠血清生物标记物识别运用GC-MS技术,M7组大鼠血清中共鉴定出9个潜在的差异性标记物(Tab 2),与空白对照组比较,代谢物含量均明显下降,其中亚油酸是其主要的差异性代谢物。
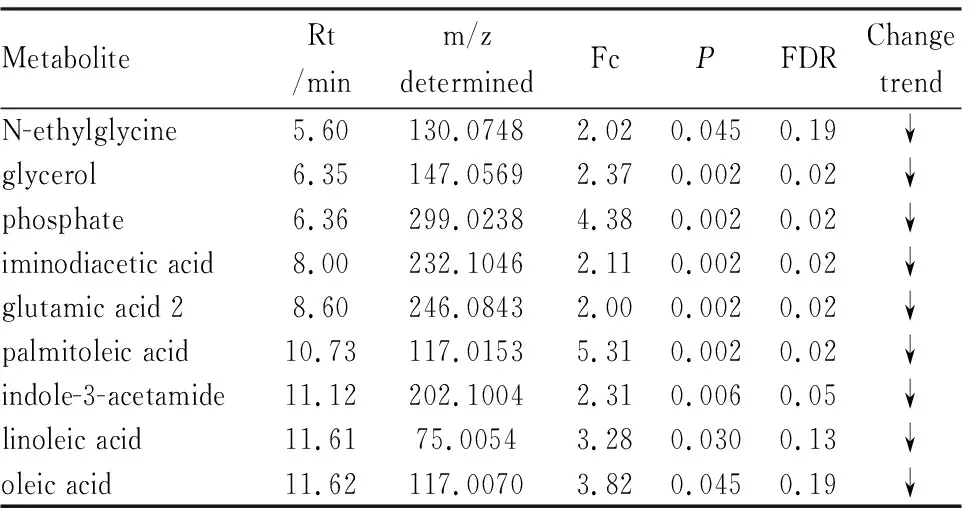
Tab 2 Identification of potential metabolites in serum of M7 rats by GC-MS
M14组大鼠血清中共鉴定出14个潜在的差异性标记物(Tab 3),与空白对照组比较,代谢物含量明显上升的6个,含量明显下降的8个,其中亚油酸是其主要的差异性代谢物。
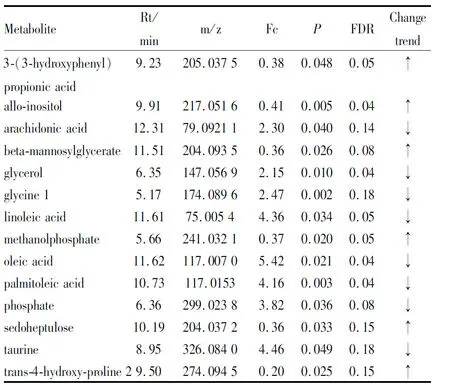
Tab 3 Identification of potential metabolites in serum of M14 rats by GC-MS
M21组大鼠血清中共鉴定出35个潜在的差异性标记物(Tab 4),与空白对照组比较,代谢物含量明显上升的9个,含量明显下降的26个,其中苯丙氨酸、酪氨酸是主要的差异性代谢物。

Tab 4 Identification of potential metabolites in serum of M21 rats by GC-MS
M28组大鼠血清中共鉴定出13个潜在的差异性标记物(见Tab 5),与空白对照组比较,代谢物含量明显上升的6个,含量明显下降的7个,其中亚油酸是该阶段主要的差异性代谢物。
各阶段血清中共有及特有的差异性代谢物见Fig 5。M7大鼠血清中共鉴定了9个潜在的差异性代谢物,M14血清中共鉴定了14个差异性代谢物,M21血清中共鉴定了35个差异性代谢物,M28血清

Tab 5 Identification of potential metabolites in serum of M28 rats by GC-MS
中共鉴定了13个差异性代谢物。其中M7与M14重叠差异性代谢物5个,分别是甘油、磷酸盐、棕榈油酸、亚油酸及油酸;M21与M28重叠差异性代谢物5个,分别是3-(3-羟基苯基)丙酸、丙氨酸、半乳糖酸、丝氨酸、亚油酸。M7特有的差异性代谢物2个:N-乙基甘氨酸、吲哚-3-乙酰胺,M14特有的差异性代谢物2个:异肌醇、花生四烯酸,M21特有的差异性代谢物24个,如脯氨酸、蛋氨酸、β-丙氨酸、异亮氨酸等,M28特有的差异性代谢物3个:谷胱甘肽、亮氨酸、肌醇。亚油酸是PF形成与发展各阶段共有的差异性代谢物。
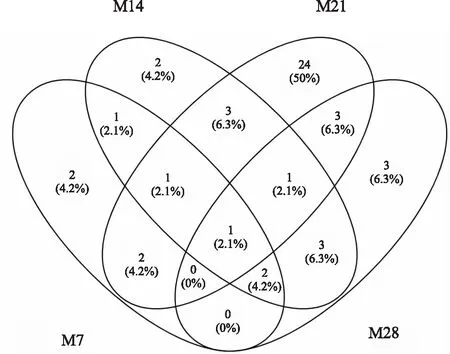
Fig 5 Overlapping analysis of differential metabolites in rat serum metabolomics of different formation and development stages
如Fig 6所示,根据重叠分析,进一步筛选出潜在的关键差异性代谢物,并根据其归一化峰值在各时间段(或各模型组)的含量变化绘制柱状分析图。3-(3-羟苯基)丙酸的归一化峰值在各模型组中总体呈上升的趋势,在M21中最高;丙氨酸归一化峰值在各模型组中总体呈下降的趋势,在M21中最低;磷酸盐的归一化峰值在M7、M14 中显著降低,在M21中显著升高;亚油酸、棕榈油酸、油酸的归一化峰值在各模型组中降低。磷酸盐、棕榈油酸、油酸及亚油酸在肺纤维化早期含量变化明显,3-(3-羟苯基)丙酸和丙氨酸在肺纤维化后期变化显著。
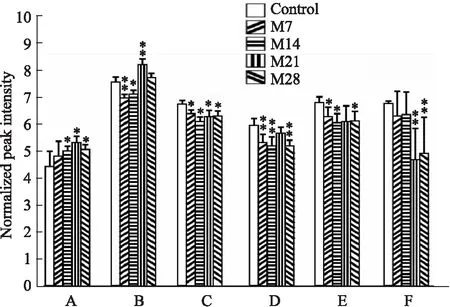
Fig 6 Potential key differential metabolite normalized peak intensity in different time periods
2.5 代谢通路分析如Fig 7所示,对PF不同时期大鼠血清差异性代谢物相关代谢通路进行了分析,代谢途径涉及脂质代谢、氨基酸代谢、其他氨基酸代谢、碳水化合物代谢、辅助因子和维生素的代谢,其中脂质代谢及氨基酸代谢异常是PF形成与发展过程中主要的代谢特征变化。各时期共有及特有的代谢通路见Fig 8,其中脂质代谢中的亚油酸代谢及其他氨基酸代谢中的谷胱甘肽代谢是不同时期的共同影响通路;花生四烯酸代谢是在肺纤维化早期,苯丙氨酸、酪氨酸和色氨酸生物合成、β-丙氨酸代谢、肌醇磷酸代谢等是在肺纤维化后期特有的代谢通路。
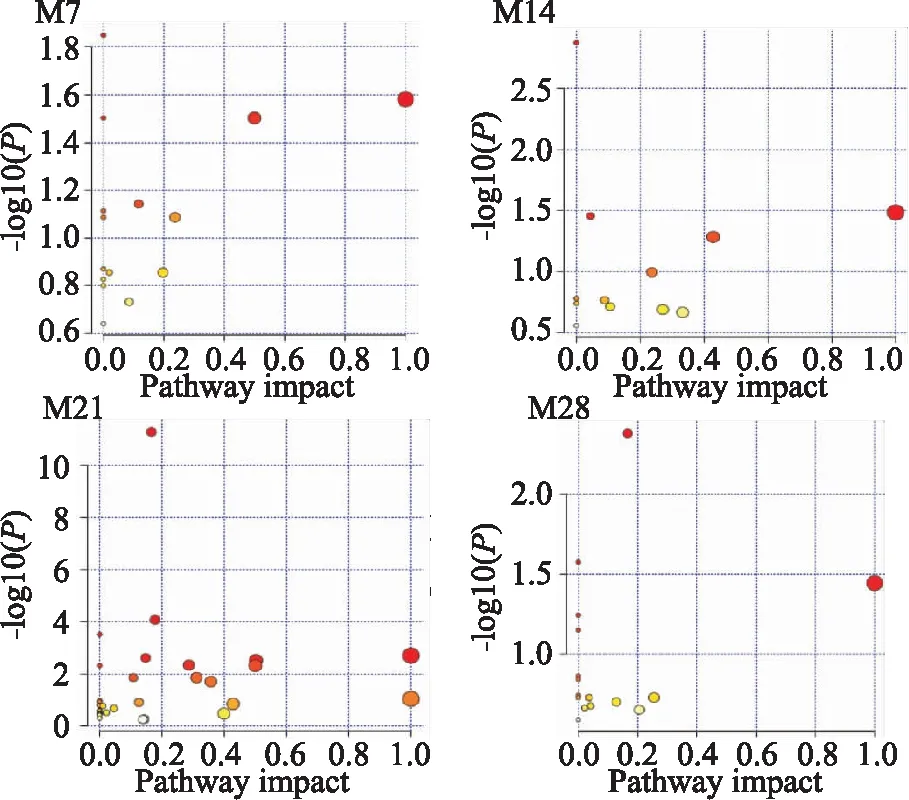
Fig 7 Metabolic pathway analysis of model differential metabolites
3 讨论
近年来,PF的发病机制及疾病防治研究不断深入,但是PF的治疗药物选择有限,尚不能完全治愈。鉴于PF诊断相对困难,代谢组学生物标志物方面的研究为PF的诊断鉴别、预后评估提供了依据,但临床实践有待进一步考察。本文通过对PF模型大鼠血清代谢指纹、代谢轮廓、差异性代谢物及相关代谢通路的研究,从代谢组学角度探讨了PF疾病形成与发展的机制。
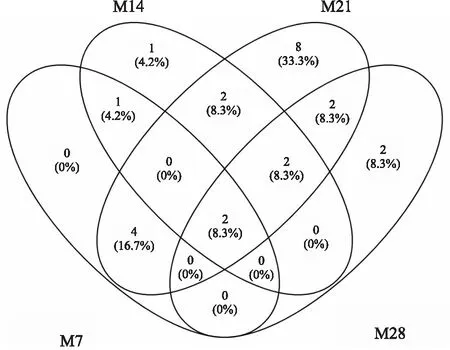
Fig 8 Overlapping analysis of different metabolite-related metabolic pathways in rat serum of different formation and development stages
本文基于代谢组学技术对PF模型大鼠的血清代谢轮廓数据进行多变量分析,采用PCA、OPLS-DA等分析方法识别模型大鼠血清数据变化模式。由PCA分析结果可知,模型组和对照组均有聚集成群的趋势;OPLS-DA结果显示,在有监视的情况下,模型组和对照组聚集趋势进一步增强,达到几乎完全分离状态,表明模型大鼠血清中代谢物种类及含量发生明显变化。各模型组(M7、M14、M21、M28)分别筛选并鉴定了9种、14种、35种、13种显著改变的代谢物,M21的差异性代谢物数量明显高于其他组,这可能与其肺组织中HYP含量较高有关,提示BLM诱导肺纤维化引起内源性代谢物改变是肺内多种因素共同作用的结果。
在差异性代谢物识别过程中,我们发现了一些关键差异代谢物。在肺纤维早期,甘油、磷酸盐水平明显降低,随着肺纤维化的形成,磷酸盐水平明显回升,3-(3-羟基苯基)丙酸水平明显升高,丙氨酸、半乳糖酸、丝氨酸水平明显降低。亚油酸、棕榈油酸和油酸水平在肺纤维化形成与发展过程中呈降低趋势,28 d较21 d有小幅度的降低,可能是机体的代偿反应,但不排除组别之间的个体差异。Nambiar等[13]和Gaugg等[14]的研究发现脂质代谢紊乱及氨基酸变化异常会导致肺部损伤和肺纤维化,与本文研究结果类似。故甘油可能是PF早期炎症阶段的潜在生物标志物,3-(3-羟苯基)丙酸、丙氨酸、半乳糖酸、丝氨酸则可能是PF晚期肺纤维化阶段的潜在生物标志物,磷酸、油酸、棕榈油酸及亚油酸可能是PF疾病发生发展全过程的潜在标志物。