丹酚酸B治疗阿尔茨海默病的作用机制研究进展
2022-04-07李延峰王洪权
李 建,李 强,李延峰,王洪权
(1. 赤峰学院附属医院神经内科, 内蒙古 赤峰 024000;2. 中国医学科学院/北京协和医学院北京协和医院神经内科, 北京 100050;3. 航天中心医院、北京大学航天临床医学院神经内科/航天医学中心, 北京 100049)
阿尔茨海默病(Alzheimer’s disease,AD) 是最常见的一种神经变性病,以进行性脑功能失调为特征的疾病,表现为记忆、认知、语言和行为障碍以及人格改变等[1]。AD的典型病理特征为由beta-淀粉样蛋白(β-amyloid, Aβ) 细胞外沉积形成的老年斑(senile plaques,SPs)和细胞内由tau蛋白过度磷酸化引起的神经原纤维缠结(neurofibrillary tangles,NFTs)[2]。AD目前没有确切有效的治疗方法,给社会和家庭带来了沉重的经济和精神负担。
目前,AD中发病机制尚不清楚,主要的发病机制假说包括淀粉样蛋白学说、氧化应激学说、线粒体功能障碍学说和胆碱能学说等,另外还有兴奋毒性损伤学说、钙学说等[3]。近年来研究显示,天然化合物通过多种机制能够抑制AD的发生,在AD中显示出多靶点治疗特性,成为近年AD治疗有益的探索。丹酚酸B(salvianolic acid B,SAB)是从丹参中提取的天然化合物,通过多种机制在AD中发挥神经保护作用。因此,本文将对近年来SAB在AD中的治疗作用的实验研究进行总结,阐述其对AD治疗的相应机制,同时指出其临床应用和将来的应用趋势。
1 SAB的来源和药理学特性
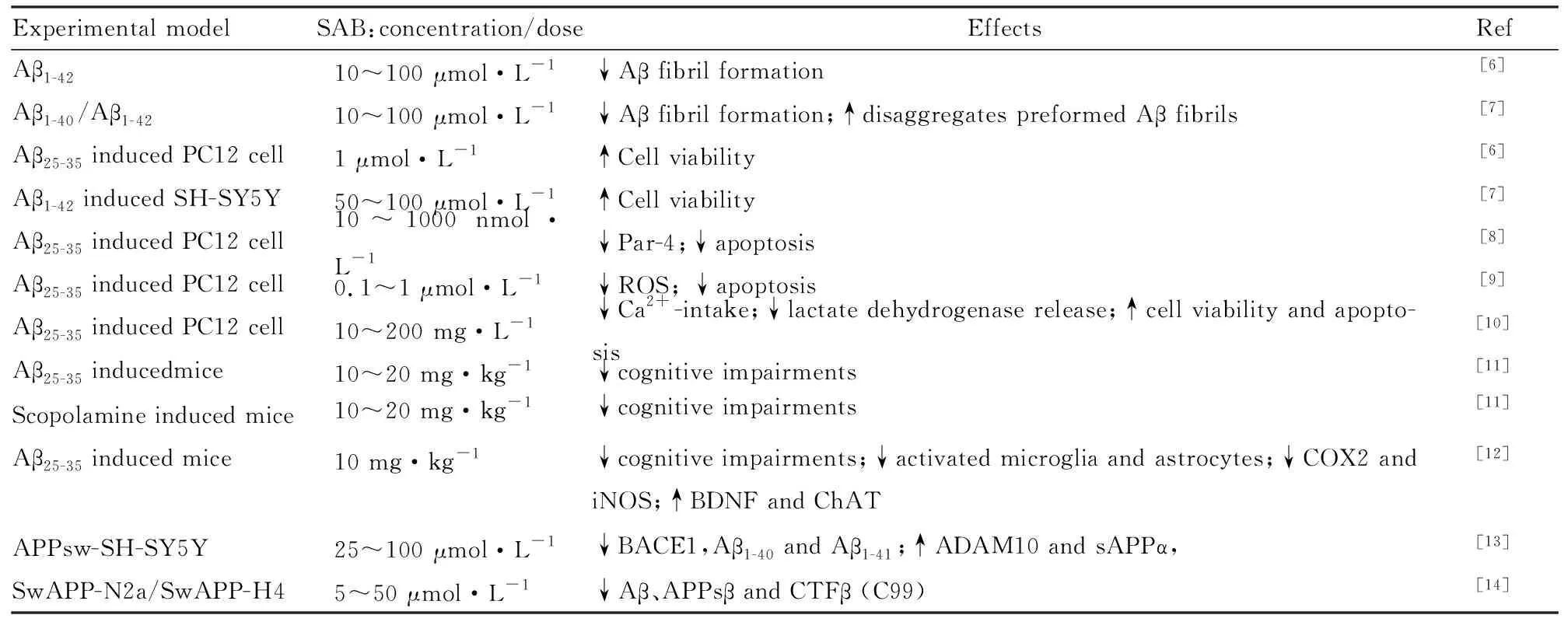
丹酚酸B为唇形科植物丹参(SalviaMiltiorrhizaBge) 的根及根茎提取而得。是丹参中含量最丰富、生物活性最强的水溶性化合物[4]。SAB分子式为C36H30O16,相对分子质量为718.62,该品为棕黄色干燥粉末。SAB为3分子丹参素与1分子咖啡酸缩合而成,是研究较多的丹酚酸之一,对心、脑、肝、肾等器官均具有重要药理作用[4]。SAB具有抗氧化、抗凋亡、抗炎等药理作用[5]。近年来研究显示,SAB在AD中通过多种机制对AD具有治疗作用(Tab 1)。
2 SAB在AD中的神经保护作用机制
2.1 对Aβ的作用
2.1.1抑制Aβ产生 Aβ是由淀粉样蛋白前体蛋白(amyloid-βprecursor protein,APP)经不同的分泌酶相继切割生成[15-16]。APP的加工方式有两种,即非淀粉样蛋白生成途径(non-amyloidogenic pathway)和淀粉样蛋白生成途径(amyloidogenic pathway)(Fig 1)。其中非淀粉样蛋白生成途径是指α-分泌酶(α-secretase)在APP的Aβ肽段内切割生成可溶性的胞外片段APPsα (soluble αAPP)和由99个氨基酸残基组成的胞内段 CTFα (C terminus fragment α,C83),再由γ-分泌酶(γ-secretase)切割CTFα生成p3片段和APP胞内结构域AICD (amyloid precursor protein intracellular cytoplasmic/C-terminal domain)片段。而淀粉样蛋白生成途径是指APP先由β-分泌酶(β-secretase)切割生成分泌到胞外的可溶性片段APPsβ (soluble βAPP)和由99个氨基酸残基组成的胞内段CTFβ (C terminus fragment β,C99),再由γ-分泌酶切割CTFβ产生留在胞内的大约50个氨基酸的AICD片段和释放到胞外的不同长度的Aβ肽段。其中,β-淀粉样蛋白前体蛋白切割酶-1(β-site amyloid precursor protein-cleaving enzyme 1,BACE-1)即β-分泌酶是Aβ生成步骤中的限速酶。
Tab 1 Summary of neuroprotective effect of salvianolic acid B in experimental AD model
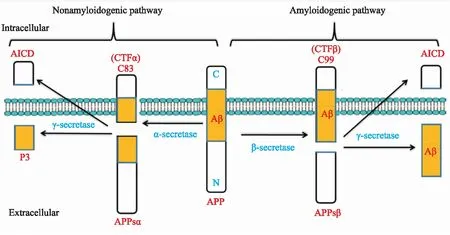
Fig 1 Schematic representation of amyloid precursor protein (APP) processing pathways
研究显示,SAB (25~100 μmol·L-1)能够在转染APPsw (APP Swedish mutant)的SH-SY5Y细胞中,通过降低BACE1表达减少Aβ1-40和Aβ1-41的产生[13]。ADAM10(anti-disintegrin and metalloprotease 10)具有α-分泌酶活性,属于ADAM家族(即一种去整合素和金属蛋白酶家族酶)。SAB上调ADAM10和sAPPα,而对APP和PS1(Presenilin-1) 的表达不产生影响,这表明SAB具有促进α-分泌酶的活性和抑制β-分泌酶的药理学作用,具有调控α-分泌酶和β-分泌酶活性的双重作用,从而减少Aβ的产生[13]。在转染APPsw的N2a或H4细胞中,SAB剂量依赖性降低细胞外Aβ、APPsβ以及CTFβ (C99)生成,而不影响APP表达和α-分泌酶以及γ-分泌酶的表达[14],进一步验证了前人研究结果,即SAB是β-分泌酶抑制剂。体内研究也显示,SAB能够通过抑制BACE1和PS1来抑制Aβ的产生[17]。以上研究表明,SAB是β-分泌酶抑制剂,能够通过抑制β-分泌酶活性从而减少Aβ的产生。但是,关于SAB对α-分泌酶以及γ-分泌酶表达影响的体内、外研究结果不统一,这可能与实验模型选择和检测方法差异有关。
2.1.2抑制Aβ的聚集以及促进纤维状Aβ的降解 早期电镜研究发现,SAB(10~100 nmol·L-1)与Aβ1-40共孵育,可以抑制纤维化Aβ1-40生成[18]。进一步使用硫磺素T(thioflavin-T,Th-T)染色显示,SAB抑制纤维化Aβ1-40的生成和促进纤维化Aβ的解聚[7]。Th-T是一种与淀粉样纤维特异性结合而荧光显著增强的染料,因而常被用来定性和定量检测蛋白质和多肽纤维的生长,以及淀粉样纤维聚集过程的检测,是最常用的淀粉样蛋白荧光探针。在发射波长482nm处,用ThT的方法检测荧光强度,该荧光强度的强弱反映了Aβ的聚集程度,荧光越强说明聚集越明显。通过Th-T染色方法发现,SAB(10~100 μmol·L-1)与Aβ1-40和Aβ1-42共孵育,能够减少荧光强度,表明SAB能够抑制Aβ的聚集,进一步透射电镜研究发现SAB(10~100 μmol·L-1)能够抑制纤维状Aβ1-40(Aβ fibril)的形成,并促进纤维状Aβ1-40的解聚[7]。而通过圆二色光谱(CD spectra)观察显示,SAB能够抑制Aβ1-40片层结构(β-sheet)的形成[7]。而主要成分为SAB(含有2.21%SAB)的丹参水提物能够抑制Aβ聚集[19]。以上研究表明,SAB能够抑制Aβ的聚集以及促进纤维状Aβ的降解,这也可能是其在AD中的神经保护作用机制之一。
2.1.3抑制Aβ诱导的氧化应激损伤和凋亡发生 SAB在AD中的神经保护作用研究最早源于中国医学科学院药物研究所张均田教授组的研究,他们发现在原代培养大鼠皮层神经元中,SAB能明显增加细胞活力,降低Aβ1-40诱导的LDH释放率,并剂量依赖地减少NO释放[20]。在PC12细胞中,SAB抑制Aβ25-35诱导的ROS产生增加[21]。在Aβ25-35诱导的PC12细胞中,SAB通过抑制前列腺凋亡反应基因-4(prostate apoptosis response-4gene,par-4)的表达来抑制Aβ25-35诱导的PC12凋亡发生[8]。SAB通过抑制凋亡和ROS产生,抑制Aβ25-35诱导的PC12细胞损伤[9]。SAB能够抑制Aβ25-35诱导的凋亡发生、钙摄取增多和LDH释放[10]。在体内,SAB(20和40 mg·kg-1)能够抑制牙龈卟啉单胞菌(porphyromonas gingivalis,Pg)导致的ROS产生,促进抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的产生[17]。这表明在AD中,SAB具有抗氧化的药理作用。
2.2 抗神经炎症作用近年来研究显示,神经炎症(neuroinflammation)是AD的重要病理进程,促进Aβ和tau蛋白病理,参与AD发病机制[22]。许多细胞因子、肿瘤坏死因子、化学趋化因子、炎性小体等参与AD相关神经炎症进程,促进AD发生[23]。而使用天然化合物通过抗炎机制对AD具有治疗作用[24-25]。
SAB在AD同样具有抗炎作用。小胶质细胞是中枢神经系统的免疫细胞,不同于外周和其他组织驻留的巨噬细胞。作为对中枢神经系统损伤(如神经元损伤或感染)的反应,小胶质细胞被激活以产生促炎因子(M1表型)或抗炎因子(M2表型),在AD中,小胶质细胞的激活,能够导致炎症加重和疾病进展加速。而星形胶质细胞是中枢神经系统中最丰富的细胞类型,它们对环境高度敏感,对CNS损伤迅速做出反应,它们还调节神经元的成熟并帮助维持其功能。星形胶质细胞对细胞因子和趋化因子等炎症分子产生反应,并能够感知如Aβ蛋白的聚集[26-28]。SAB能够减少小胶质细胞和星形胶质细胞的激活,另外,SAB能够降低COX2和iNOS的表达以及TBARS产生[12]。最近的一项研究证明,SAB具有抗神经炎症作用,在AD中发挥神经保护作用。研究显示,AD病人脑中存在的牙龈卟啉单胞菌(porphyromonasgin givalis,Pg)能够通过促进Aβ聚集,参与AD发病[17]。SAB(20,40 mg·kg-1)能够降低Pg引起的IL-1β 和IL-6生成,升高脑内脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和神经生长因子(nerve growth factor,NGF)的mRNA水平[17]。
2.3 SAB调控Nrf2/HO-1通路Nrf2系统与线粒体生物发生和线粒体质量控制正相关,活化的Nrf2直接或间接上调线粒体生物发生相关基因的表达,如过氧化物酶体增殖物激活受体γ共激活物1-α(PGC-1α),从而促进线粒体发生,保护线粒体功能。SAB在AD中神经保护作用机制可能与其对线粒体保护和激活Nrf2/HO-1通路有关[21]。SAB对Aβ诱导的线粒体异常具有保护作用。 SAB可显著减轻Aβ诱导的神经元内谷胱甘肽(GSH)和脂质氧化产生,并抑制线粒体过多的超氧化物生成。此外,SAB促进膜电位的恢复和ATP生成的增加,以及恢复细胞色素C氧化酶和F1F0-ATP合酶的活性。SAB减轻Aβ诱导的轴突线粒体断裂和降低线粒体动力样蛋白DLP1(dynamin-like protein 1) 的磷酸化。最后,SAB能够恢复Aβ导致的神经元突触密度的减低。总之,SAB具有调控线粒体功能,在AD中发挥神经保护作用[29]。而在APP/PS1转基因小鼠中,SAB上调细胞核中Nrf2及HO-1蛋白表达,下调Keap-1蛋白表达,表明SAB具有激活Nrf2/HO-1通路的作用。
2.4 改善AD认知功能障碍最近研究显示,SAB (10 mg·kg-1)口服给药,能够明显改善Aβ25-35(10 nmol/5 μL)或东莨菪碱(scopolamine,SCO)诱导的小鼠认知功能障碍[11]。SCO (1 mg·kg-1)型胆碱受体拮抗剂,可阻断大脑皮层和海马区乙酰胆碱对M受体的激动作用,从而对记忆获得产生阻抑效应,诱导痴呆发生。目前SCO已经被广泛应用在评估神经营养药物。腹腔给药3 mg·kg-1后可造成动物记忆功能障碍,东莨菪碱用于诱导动物记忆障碍模型具有简单、经济、方便等优点,故常应用于抗AD活性化合物的初步筛选。进一步研究显示,而GABAA型受体激动剂(muscimol or diazepam)拮抗SAB对小鼠认知功能障碍的改善作用,这表明,SAB可以通过GABA能神经递质系统来改善胆碱能功能失调或Aβ25-35诱导的记忆损害[11]。最近研究显示,SAB(10 mg·kg-1)能够改善Aβ25-35诱导的小鼠认知功能障碍[12]。进一步机制研究发现,SAB抑制Aβ25-35诱导的胆碱乙酰转移酶(choline acetyltransferase,ChAT)和脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的降低有关[12,30]。总之,SAB能够在AD模型中发挥对认知的改善作用。
3 结语
综上所述,SAB能够通过抑制Aβ产生、聚集,促进Aβ清除,抑制Aβ诱导的氧化应激损伤和凋亡发生机制对AD具有治疗作用。同时其可以保护线粒体,调控Nrf2/ARE通路,进而上调HO-1参与对AD的治疗作用(Fig 2)。
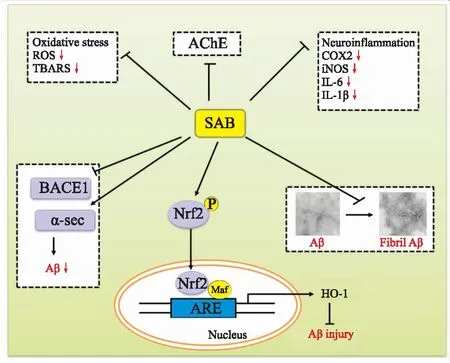
Fig 2 Schematic representation of SAB-mediated neuroprotection in AD
目前临床研究注册网站(clinicaltrials.gov)有4项关于丹酚酸的临床注册研究,分别是对脑卒中、糖尿病、糖尿病周围神经病和健康受试者的研究,其中3项是关于丹酚酸A的研究。而中国临床试验注册中心(https://www.chictr.org.cn/index.aspx) 目前还没有关于丹酚酸的临床注册研究。中国医学科学院药物研究所杜冠华研究员课题组关于国家1类新药丹酚酸A片治疗糖尿病周围神经病变的II期多中心临床试验研究正在北京协和医院开展之中。尽管目前研究显示,SAB具有明确的抗AD作用,但是目前尚无关于SAB治疗AD的临床研究,鉴于丹酚酸的良好药理作用,对于SAB在AD患者水平的治疗探索研究值得期待。