肺炎支原体感染对川崎病患儿心血管损伤特点分析
2022-04-07杨轶男马执彬杜红梅李建建赵怡妮李晓敏卓婷婷胡晓斌
杨 超,杨轶男,马执彬,杜红梅, 钭 丰, 李建建,赵怡妮,李晓敏,卓婷婷,胡晓斌
(1. 兰州大学公共卫生学院,甘肃 兰州 730000;2. 兰州大学第二医院小儿心血管科,甘肃 兰州 730030;3. 兰州大学第二临床医学院,甘肃 兰州 730030)
川崎病(Kawasaki disease, KD)作为一种以全身性血管炎为主要病变的儿科常见疾病,发病率逐年升高,已成为发达国家和我国部分地区儿童获得性心脏病的主要病因[1],其心血管并发症严重威胁着KD患儿远期的生命健康,是导致患儿死亡的主要原因[2]。目前KD的病因尚不明确,有学者认为病原体感染与KD发生密切相关[3],其中肺炎支原体(Mycoplasmapneumoniae, MP)即为潜在的致病菌之一[4]。MP作为小儿呼吸道感染常见的病原体,除主要损伤呼吸系统外,还可累及诸多系统引发肺外并发症[5]。近年来研究[6]发现,KD患儿常伴有MP感染,从而加重疾病对患儿健康的影响;但目前国内外鲜有比较全面的关于MP感染后KD患儿心血管损伤的文献报道,故本研究对某三级综合医院小儿心血管科收治的270例KD患儿进行回顾性分析,了解MP感染对KD患儿心血管损伤特点,以期指导临床对患儿采取个体化治疗。
1 对象与方法
1.1 研究对象 选取2018年1月—2021年3月收治于某三级综合医院小儿心血管科的KD患儿为研究对象,并根据MP感染情况分为KD合并MP感染组(KD-MP组)和KD未合并MP感染组(KD组)。纳入标准:(1)符合KD的诊断标准;(2)初次确诊KD的患儿;(3)年龄≤14岁。排除标准:(1)临床病历资料不全者;(2)入院前已静脉注射丙种球蛋白(IVIG)者;(3)合并其他病原体感染者(如柯萨奇病毒、EB病毒、轮状病毒、副流感病毒、金黄色葡萄球菌、链球菌等);(4)先天性心脏病患者。
1.2 诊断标准 KD的诊断参照2017年美国心脏协会(AHA)更新的标准[7]。由于本研究所纳入的病例包含部分未使用冠状动脉内径Z值判断冠状动脉损伤(coronary artery lesion,CAL)及冠状动脉瘤(coronary artery aneurysm, CAA)分级的病例,故仍将冠状动脉内径的绝对值作为诊断依据,主要参考2015年出版的《诸福棠实用儿科学》第八版[8]:0~3岁≥2.5 mm、3~9岁≥3.0 mm、9~14岁≥3.5 mm定义为CAL;其中<4 mm为轻度扩张,4~7 mm为中型CAA ,≥8 mm为巨大CAA。MP感染诊断依据《儿童肺炎支原体肺炎诊治专家共识(2015年版)》[9],经九项呼吸道感染病原体检测肺炎支原体IgM呈阳性,且血清抗体滴度≥1∶160,并结合临床表现综合判断。
1.3 研究方法 通过患者的病案号查阅电子病历系统,回顾性收集KD患儿的临床资料。主要包括,(1)一般资料:性别、年龄、是否合并MP感染;(2)血小板参数:血小板计数(PLT)、血小板分布宽度(PDW)、平均血小板体积(MPV)、血小板压积(PCT);(3)凝血相关指标:凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT)、抗凝酶Ⅲ(AT-Ⅲ)、D-二聚体(D-D)、纤维蛋白原降解产物(FDP);(4)心肌酶谱:天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH);(5)超声心动图:冠状动脉内径、血栓形成、心脏增大、心包积液、二尖瓣反流、三尖瓣反流、主动脉瓣反流、心功能降低。若患儿首次使用IVIG治疗前有多次检查结果,则取最差值。

2 结果
2.1 一般资料 2018年1月—2021年3月共收治确诊KD患儿376例,依据纳入、排除标准共排除106例,其中52例临床资料不全,43例合并其他病原体感染,7例入院前已行IVIG治疗,4例患有先天性心脏病。最终纳入270例KD 患儿,其中KD-MP组70例,男性43例(61.43%),女性27例(38.57%),年龄为[2.28(1.68,3.76)]岁;KD组200例,男性140例(70.00%),女性60例(30.00%),年龄为[2.14(1.36,3.40)]岁,两组患儿在性别、年龄分布上比较,差异均无统计学意义(均P>0.05)。
2.2 KD-MP组与KD组患儿血小板参数比较 KD-MP组MPV中位水平[10.00(9.08,11.00) fL]较KD组[9.60(8.83,10.68) fL]更高,差异有统计学意义(P<0.05);两组患儿PLT、PDW、PCT水平比较,差异均无统计学意义(均P>0.05)。见表1。
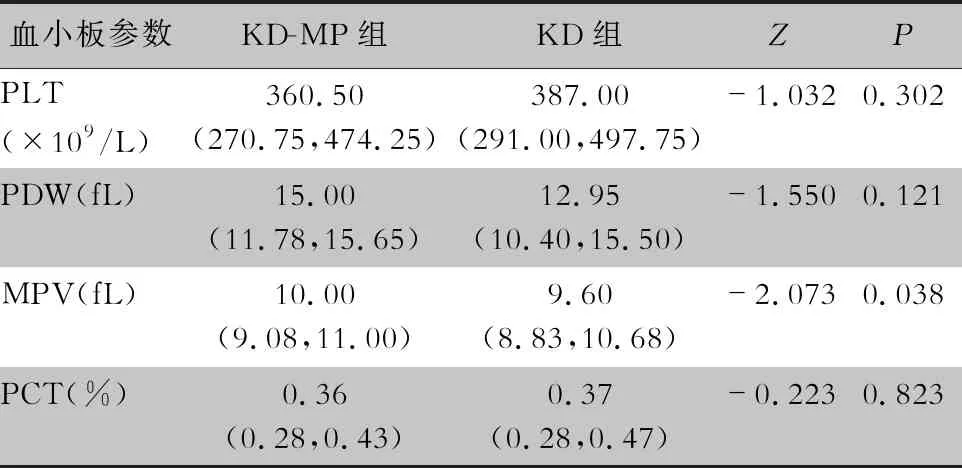
表1 KD-MP组与KD组患儿血小板参数水平比较 [M(P25,P75)]
2.3 KD-MP组与KD组患儿凝血相关指标比较 在凝血相关指标中,KD-MP组与KD组患儿除FIB、D-D外,结果多在正常参考范围内,两组患儿所有凝血指标比较,差异均无统计学意义(均P>0.05)。见表2。

表2 KD-MP组与KD组患儿凝血相关指标比较 [M(P25,P75)]
2.4 KD-MP组与KD组患儿心肌酶谱比较 KD-MP组与KD组患儿的心肌酶水平比较,差异均无统计学意义(均P>0.05)。见表3。

表3 KD-MP组与KD组患儿心肌酶水平比较 [M(P25,P75)]
2.5 KD-MP组与KD组患儿不良结局指标分析 KD-MP组CAL、冠状动脉轻度扩张、心包积液的占比分别为55.71%、47.14%、15.71%,高于KD组的38.50%、30.50%、5.50%,差异均有统计学意义(均P<0.05);两组患儿心脏增大、中型CAA、巨大CAA、二尖瓣反流、三尖瓣反流、主动脉瓣反流及心功能降低等不良结局占比比较,差异均无统计学意义(均P>0.05)。见表4。
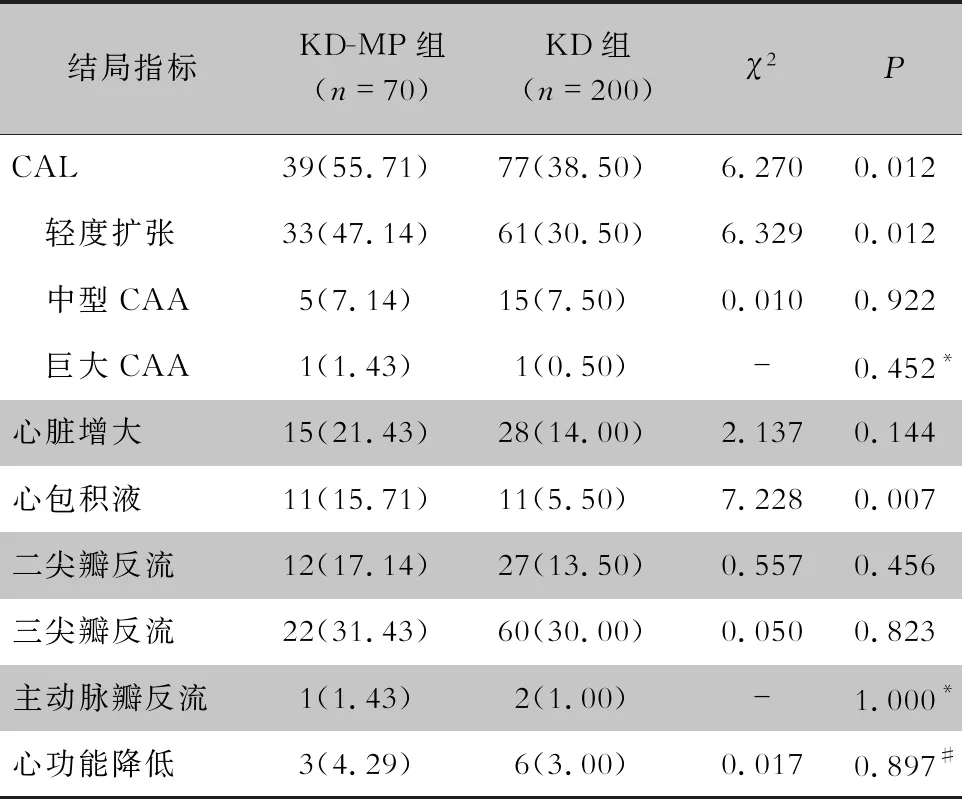
表4 KD-MP组与KD组患儿不良结局指标比较[例(%)]
3 讨论
自1967年首次报告KD以来,医学界对其病因进行了广泛的研究,其主要集中在病原体感染、遗传倾向、免疫失调和环境因素四方面[10],特别是KD的流行病学特征高度提示感染源起重要作用,目前研究报道可能与KD发病有关的病原体达数十种[11],MP为其中之一[12]。本研究中KD-MP感染患儿共70例,占纳入研究对象的25.93%,与既往研究[13]报道相近,但远低于林翊君等[14]研究中报道的38.91%,主要原因可能是MP感染流行具有周期性,但每个地区的流行高峰不一致,同时也说明在KD患儿中,呈现出MP高感染率的现象。
KD易侵犯中小血管,尤以并发CAL最为常见。本研究显示,KD-MP组患儿中CAL占比为55.71%,高于KD组的38.50%,提示KD-MP患儿更易发生CAL,与国内相关研究[15-16]结果相符。50多年来,KD并发CAL的机制尚无统一定论,有学者认为是KD患儿免疫系统异常活化,免疫细胞释放大量的细胞因子和炎性介质,促进基质金属蛋白酶的表达上调,进而降解细胞外基质,导致血管结构的重建[17]。当合并MP感染时,MP所致的间接组织损伤会触发炎症反应[18],炎性因子过度表达,加重免疫损伤,最终导致冠状动脉扩张,甚至CAA的发生。
在KD病程发展过程中,特别是对于存在冠状动脉异常的患儿,需要积极的进行抗血小板及抗凝治疗,以预防血栓的形成[19],因此,急性期的血小板及凝血功能监测对于KD患儿显得尤为重要。本研究发现KD-MP组患儿MPV高于KD组,MPV作为反映血小板年龄和体积大小的指标,提示KD-MP组患儿血小板代谢更加活跃。但在此次研究中,对于血栓形成意义较大的指标,如PLT、D-D,两组比较差异无统计学意义,与仲辉等[20]的研究结果一致。同时仅在KD组发现1例血栓患儿,说明尚未发现合并MP感染会增加KD患儿血栓形成的风险。
当前,国内外关于MP感染对KD患儿心血管损伤的研究大多仅关注冠状动脉病变,但需明确的是,KD还可并发累及心包、心肌和心内膜的非冠状动脉心脏异常(noncoronary cardiac abnormality,NCA),指南中也特别提出对心室形态和功能、心包积液、膜瓣反流的评估在KD诊治及长期管理过程中同样不可忽视[7]。一项基于中国KD患儿的研究显示,有高达74.65%的患者出现NCA,提示NCA在急性KD中普遍存在[21],应引起儿科医生的高度重视。有关KD-MP患者的NCA研究报道较少,本研究发现KD-MP组存在心包积液的占比为15.71%,高于KD组的5.50%,差异有统计学意义(P<0.01)。一项多中心、回顾性队列研究指出,约有3%的KD患儿出现心包积液[22],同时MP感染在对小儿心血管损伤过程中,同样可引起心包积液的发生[23],这就导致合并MP感染的KD患儿更易并发心包积液。
此外,心肌酶谱作为反映心肌功能的一组指标,可用于评估KD患儿心肌受损的严重程度。本研究显示,KD-MP组与KD组患儿心肌酶水平比较,差异均无统计学意义,与Wang等[24]研究结果一致。同时此次研究中尚未发现两组患儿在心脏增大、二尖瓣反流、三尖瓣反流、主动脉瓣反流及心功能降低的占比上存在统计学差异,可能需要更大的样本量来验证MP感染与其之间的关系。
综上所述,合并MP感染的KD患儿更易并发CAL和心包积液,面临更大的心血管损伤风险。因此,在KD诊治过程中,需及时筛查KD患儿是否存在MP感染,同时积极采取抗感染治疗,减少心血管并发症的发生。由于本研究为回顾性研究,因果关系论证力度相对不足,加之样本量有限,所得结论还需在前瞻性大样本研究中进行验证。
利益冲突:所有作者均声明不存在利益冲突。
