新型冠状病毒肺炎康复期感染肺孢子菌肺炎一例并文献复习
2022-04-07韩俊彦张德荣李世闻莫晓能
彭 辉,陈 沐,韩俊彦,张德荣,李世闻,莫晓能,彭 平
(广州医科大学附属市八医院呼吸内科,广东 广州 510060)
随着新型冠状病毒(SARS-CoV-2)Delta变异株的全球流行,新型冠状病毒肺炎(COVID -19)病例仍在快速增加,人们越来越多地认识到真菌混合感染将使COVID -19治疗更复杂化。虽然曲霉菌似乎是COVID -19患者合并真菌感染的常见病原体[1],但也有新的报告称COVID -19可同时或之后合并肺孢子菌肺炎(Pneumocystis pneumonia, PCP)[2-3]。
本研究报告1例COVID -19(Delta变异株)患者,在康复期出现咳嗽、呼吸困难、呼吸衰竭加重,经支气管镜肺泡灌洗液(BAL)病理检查诊断合并PCP。同时回顾性分析COVID -19合并PCP的文献,探讨其临床特征,为临床诊断及治疗提供参考依据。
1 病历资料
1.1 病史 患者男性,56岁,既往有磺胺过敏、慢性支气管炎、肺结核病史,2021年6月6日因“发热、咳嗽、咳痰半天”入院。
1.2 体格检查 体温 37.4℃,脉搏101次/min,呼吸20次/min,血压119/72 mmHg。发育正常,营养中等,神志清楚,精神可。双肺呼吸音清晰,未闻及干湿啰音。心、腹查体无明显异常。
1.3 实验室及影像学检查 入院鼻拭子SARS-CoV-2核酸检测阳性(N基因Ct值为13.284,ORF1a/b基因Ct值为14.504);SARS-CoV-2抗体阴性,基因测序为SARS-CoV-2 delta变异株(B.1.617.2进化分支)。人类免疫缺陷病毒(HIV)抗原、抗体定量检测阴性。血常规:白细胞计数3.66×109/L,中性粒细胞计数2.09×109/L,淋巴细胞计数0.69×109/L(下降),血小板计数128×109/L,血红蛋白157 g/L。C反应蛋白(CRP)<10 mg/L,血清淀粉样蛋白A(SAA)7.28mg/L,白细胞介素6(IL-6)5.23 pg/mL,降钙素原(PCT)0.057 ng/mL;T 淋巴细胞(CD3+CD45+)585个/μL(下降),辅助性 T 细胞(CD3+CD4+)286个/μL(下降),细胞毒性 T 细胞(CD3+CD8+)262个/μL(下降),辅助/细胞毒性T淋巴细胞比值(CD4+/CD8+) 1.09(下降),B 淋巴细胞(CD3+CD19+)48个/μL(下降);D二聚体 0.58 mg/L,乳酸脱氢酶(LDH)221 IU/L,动脉氧分压148 mmHg(氧合指数510 mmHg);6月7日胸部CT考虑双下肺散在炎症,双肺间质性改变,双肺多发肺大泡(见图1a)。
1.4 治疗过程 患者入院后予以高流量湿化氧疗、胸腺法新、塞来昔布、氨溴索、复方甲氧那明等治疗,6月10日复查CT提示双肺炎症加重,加用人丙种球蛋白、俯卧位通气治疗。6月14日开始出现进行性呼吸困难,6月15日胸部CT示双肺多发斑片状磨玻璃影较前明显增多,6月16日氧合指数165 mmHg,诊断为重型COVID -19。6月17日予以地塞米松(10 mg,qd)抗炎,哌拉西林/他唑巴坦(4.5 g,q8h)抗感染。6月19日升级为亚胺培南/西司他丁钠抗感染,甲强龙抗炎(40 mg,qd×3 d)。6月20日出现发热,体温波动在37.7~38.8℃,6月21日氧合指数为120 mmHg,淋巴细胞计数最低至0.33×109/L,CD4+T细胞最低至70个/μL,胸部CT示双肺多发炎症,较前明显加重,右肺下叶实变,提示双肺炎症快速进展(见图1b),予以气管插管+有创呼吸机辅助通气,万古霉素抗感染。6月22日PCT 6.13 ng/mL,氧合指数102 mmHg,开始静脉-静脉体外膜肺氧合(VV-ECMO)治疗,调整抗感染治疗方案为万古霉素+美罗培南+卡泊芬净,治疗后患者病情逐渐好转。6月27日SARS-CoV-2核酸检测结果转阴性,于7月1日停止VV-ECMO治疗,7月7日停止机械辅助通气,改为高流量湿化氧疗。7月9日胸部CT示双肺炎症较前好转(见图1c),予转康复病区。
7月14日患者再次出现咳嗽、咳痰、气促,伴有食欲下降,痰培养出肺炎克雷伯菌、铜绿假单胞菌,血清1,3-β-D葡聚糖(BDG)347 pg/mL。7月19日胸部CT示双肺多发炎症,右上肺后段及右下肺实变加重,双肺内多发囊状无纹理透亮影(见图2a),予以美罗培南抗细菌感染,伏立康唑抗真菌感染,以及对症支持治疗,但患者咳嗽、咳痰等呼吸道症状及纳差、疲乏等中毒症状持续加重,并出现气促,血清SAA、CRP等炎症指标持续升高,氧合指数下降,最低为223 mmHg,血清BDG>1 000 pg/mL。7月24日行床旁电子支气管镜检查,留取BAL送病原学及病理检查,7月27日检查结果回报:六胺银染色见少量类圆形及个别瓜子样或新月形病原体,依据形态考虑可能为肺孢子菌(见图3)。7月28日复查胸部CT提示肺部病灶较前增大(图2b),结合影像学结果考虑为PCP,遂开始予卡泊芬净(50 mg,qd,首剂70 mg)+克林霉素(0.6 g, q12h)抗肺孢子菌感染治疗,以及小剂量甲强龙抗炎,患者咳嗽、咳痰、气促改善,精神、体力、食欲恢复正常。8月3日复查胸部CT提示双肺多发炎症较前吸收好转(见图2c),炎症指标降至正常, 8月5日患者血清BDG降至31 pg/mL,准予出院。出院后继续口服克林霉素(0.3 qid)+氨苯砜(100 mg qd)1周。9月7日随访,患者精神、食欲、睡眠、体力良好,无咳嗽、咳痰、呼吸困难及其他不适,由于当地条件限制未能复查胸部CT检查。
2 文献复习

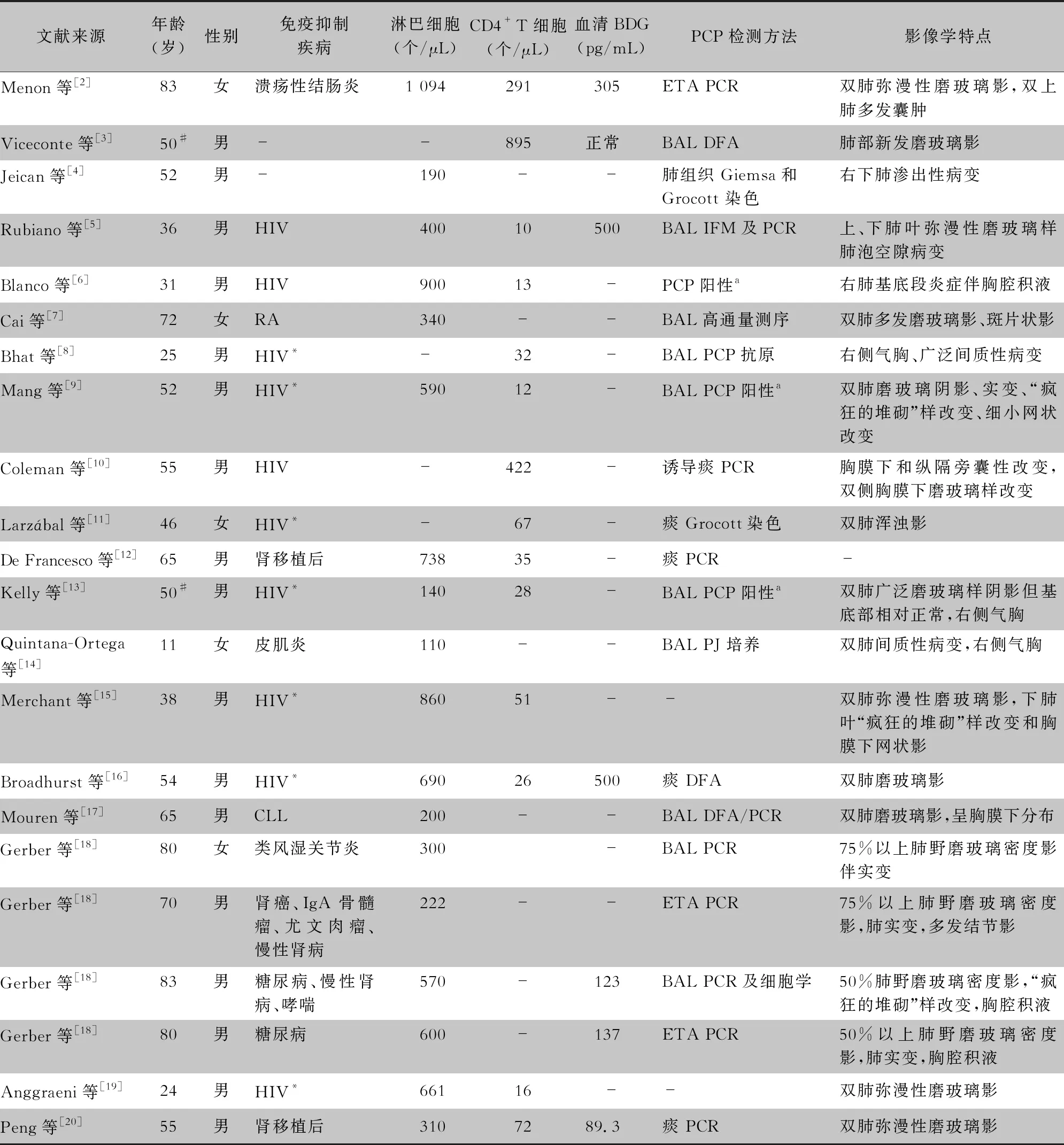
表1 22例COVID -19合并PCP患者的临床特点

表2 22例COVID -19合并PCP患者的治疗及转归
3 讨论
PCP是一种由耶氏肺孢子菌(之前称为卡氏肺孢子虫)引起,主要发生于免疫功能抑制患者的机会性感染。临床有两类人群易感,一类是HIV感染人群,尤其是外周血CD4+T淋巴细胞<200/mm3者;另一类是血液肿瘤、器官移植、自身免疫性疾病以及其他使用免疫抑制剂治疗的非HIV感染的免疫缺陷患者[21],特别是使用糖皮质激素患者[22]。
COVID -19患者常常存在淋巴细胞减少,重症患者需要使用糖皮质激素和/或免疫调节剂治疗急性呼吸窘迫综合征,这些均是感染肺孢子菌的易感因素[23]。本研究22例COVID -19合并PCP患者中,18例为HIV感染或使用免疫抑制剂治疗者,提示存在上述基础病史的COVID -19患者发生PCP的风险增加,需要高度警惕。即使是在已知风险组之外的COVID -19患者,由于严重的COVID -19相关淋巴细胞减少或应用免疫调节治疗也可能出现PCP感染[3-4]。三项关于重症COVID -19患者肺标本中肺孢子菌检出率与PCP发病率相关性研究显示,采用PCR技术检测肺孢子菌的阳性率分别为1.4%、2.6%、9.3%[24-26],其中两项研究中,所有肺孢子菌阳性标本中都观察到相对较低的真菌负荷,因此被认为是肺孢子菌定植[24, 26];另一项研究未进一步确认是肺孢子菌定植还是感染[25],说明COVID -19合并PCP的发病率仍不明确。
PCP和COVID -19有许多共同的临床特征,两者均常表现为发热、咳嗽和呼吸困难,均可出现LDH升高,胸部CT均可见双侧对称性磨玻璃影[27],使得两者很难区分。但在临床上PCP有更亚急性的病程,更早期的缺氧状态。在已确诊的PCP且胸部X线正常或接近正常的患者中,静息时80%的患者存在低氧血症,运动时存在低氧血症患者高达94%[28],而COVID -19只有重症患者才有明显缺氧。另外,口腔鹅口疮与PCP有很强的相关性,在COVID -19中尚无相关报道[27]。血清BDG可用于PCP的诊断[29],但需考虑静脉免疫球蛋白、白蛋白或静脉注射β-内酰胺类抗生素等因素的干扰。在HRCT影像上区分PCP与COVID -19的微妙线索可能是PCP中更集中的磨玻璃分布,外周可无异常,双肺上叶好发,以及高达三分之一的病例中出现形状、大小和壁厚不同的肺囊肿,并可出现自发性气胸,严重者可出现实变、“疯狂堆砌”征[30]。而在COVID -19中,最具特征性的表现是肺外周磨玻璃影,呈多叶分布[31],肺囊肿并不常见。
诊断PCP仍有赖于病原学诊断,其诊断方法是在呼吸道标本中找到病原体。检测技术包括Grocott银染色、吉姆萨染色、甲苯胺蓝染色、免疫荧光染色、PCR技术[32]。常规PCR比显微镜观察具有更高的灵敏度,但特异度低,阳性预测值低,更多的意义在于其高阴性预测值;定量PCR意义更大,可以通过临界值区分定植和感染[32]。呼吸道标本包括痰、诱导痰、BAL和各种肺活检标本。据报道找到病原体诱导痰的灵敏度为74%~90%,支气管肺泡灌洗液(BALF)的灵敏度为89%~98%[29]。目前BAL找到病原体仍是PCP诊断的金标准,但通过支气管镜检查获取支气管肺泡灌洗标本是一种侵入性检查,在严重缺氧的患者中并不容易施行,而且由于SARS-CoV-2存在气溶胶传播的风险,因此需要特别谨慎操作[5]。
治疗上,TMP/SMZ 是治疗PCP的首选药物,标准治疗疗程为3周,常见不良反应包括过敏、血细胞减少、肝肾功能异常、高钾血症、胃肠功能紊乱。二线治疗药物包括氨苯砜、克林霉素、伯氨喹、阿托伐醌、卡泊芬净。对于中重度PCP患者在正规抗PCP感染的基础上加用糖皮质激素治疗可降低病死率,其指征为PaO2<70 mmHg,肺泡动脉血氧分压差[P(A-a)O2]>35 mmHg[29]。
本研究报告的病例为COVID -19恢复期患者,双肺磨玻璃样病灶明显吸收,但出现双下肺实变及新增肺囊肿样病变,血清BDG明显升高,伴有呼吸衰竭再次加重,多次复查PCT不高、鼻拭子SARS-CoV-2阴性、痰涂片及培养为正常菌群,一般抗细菌、真菌感染治疗无效。由于患者影像学表现不典型,原有肺气肿与新增肺囊肿样病变重叠,在影像学上更不易与PCP鉴别,同时患者存在SARS-CoV-2复阳气溶胶传播风险,未能及时行支气管镜检查查找病原学证据,患者病情逐渐加重,经全科讨论后医务人员在正压头套保护下行支气管镜及诊断性肺泡灌洗检查,由于存在传播风险未能外送标本进行PCR检测,最后在六胺银染色下找到肺孢子菌而诊断为PCP。因为患者对磺胺类药物过敏,故予以卡泊芬净+克林霉素及糖皮质激素治疗,患者病情快速改善并于抗PCP感染治疗9 d后出院,出院后口服克林霉素、氨苯砜治疗,1月后随访患者恢复良好。
结合相关文献复习,从本例COVID -19合并PCP患者的诊疗过程中获得以下体会:(1)重症COVID -19患者有合并PCP的风险,其发病基础为免疫抑制,高危人群为既往存在HIV或其他免疫抑制疾病患者。既往免疫功能正常的重症COVID -19患者,住院期间如出现淋巴细胞减少及使用糖皮质激素、免疫抑制剂如IL-6单克隆抗体也可能合并PCP感染,COVID -19恢复期患者也可继发,值得警惕。(2)COVID -19和PCP有很多共同的临床特征,两者不易鉴别,血清LDH、BDG升高,HRCT在在原发磨玻璃影上出现多发囊肿样改变有一定的提示意义。(3)最终确诊仍有赖于病原学诊断,BAL检出肺泡子菌仍是PCP诊断的金标准,但SARS-CoV-2的存在给临床诊断带来了困难。
利益冲突:所有作者均声明不存在利益冲突。
