鞘内注射胶质细胞源性神经营养因子对大鼠糖尿病神经病理性疼痛的影响
2022-04-07陈艺舟刘永哲郭文治高明龙
陈艺舟,王 影,赵 丹,孙 立,刘永哲,郭文治,高明龙,
糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是一种最常见的糖尿病慢性并发症,与血糖的代谢紊乱有关,临床特征为诱发痛、自发痛、异常性疼痛、痛觉过敏和痛觉超敏等,患病率为10%~26%。迄今为止,DNP的发病机制仍未完全明确。
胶质细胞源性神经营养因子(glail cell line-derived neurotrophic factor,GDNF)是从大鼠胶质细胞系B49的无血清培养液中分离出来的糖基化的二硫键结合的同源二聚体蛋白质,属于转化生长因子β超家族成员。GDNF最初被确定为中脑多巴胺能神经元的神经营养因子,并被认为可以用于治疗帕金森病。有研究表明,GDNF不仅对多巴胺能神经元有促活、促分化作用,还对发育和成熟的运动神经元具有营养作用。近年来,GDNF对神经病理性疼痛(neuropathic pain,NP)的镇痛作用受到人们的广泛关注,随着对GDNF镇痛作用机制的不断阐明,GDNF及其受体有望成为治疗NP的新靶点。DNP属于一种典型的NP,因此对GDNF及其受体的深入研究也有利于拓展治疗DNP的新思路。
本研究利用链脲佐菌素(streptozocin,STZ)建立DNP大鼠模型,观察大鼠行为学变化,脊髓中磷酸化PI3K、p-AKT、p-mTOR、p-S6K表达变化以及鞘内注射GDNF后对大鼠行为学变化和上述蛋白表达变化有无影响,探讨鞘内注射GDNF对DNP的影响及其机制。
1 材料与方法
1.1 实验动物饲养条件 50只健康雄性SD大鼠,体重(290±10)g,由斯贝福提供,实验动物生产许可证号:SCXK(京)2019-0010。适应性饲养3 d后用于实验。
1.2 DNP模型制备 50只健康SD大鼠随机分为两组,模型组(=40)和对照组(N组,=10)。模型组单次腹腔注射2% STZ缓冲液55 mg/kg (STZ+柠檬酸-柠檬酸钠缓冲液,pH=4.2);对照组单次腹腔注射柠檬酸-柠檬酸钠缓冲液2.5 ml/kg,pH=4.2。两组大鼠同条件下饲养21 d。21 d后,鼠尾静脉血糖稳定>16.7 mmol/L且TFT下降值>20%基线值的大鼠视为成功DNP模型,并将其归于新模型组。
1.3 实验分组 在新模型组中随机抽出20只,分为DG组和DC组,每组10只。用10%水合氯醛+七氟醚对大鼠进行复合麻醉,以L间隙为穿刺点,用30 G细针头穿刺,观察有抬足或甩尾反应后,DG组注射2 μg GDNF+10 μl PBS缓冲液;DC组注射10 μl PBS缓冲液;N组不作任何干预处理。给药或PBS均为隔天一次,共7次。
1.4 血糖测定 用采血针在距尾尖0.5 cm处取鼠尾静脉血,利用便携式血糖仪和快速血糖试纸测定血糖浓度。血糖测定时间点为造模前、造模后第3、21 天,上午9:00-11:00,所有测定均由同一人完成。将造模后第21 天鼠尾静脉血糖稳定>16.7 mmol/L的大鼠视为糖尿病大鼠。
1.5 行为学测定
1.5.1 压尾机械阈值(TFT)测定 在大鼠尾巴上距尾尖10 cm处做一标记,保持标记点在楔形压痛模块下方,待大鼠安静后开始测量,大鼠出现明显躁动或甩尾反应时,记录压力值(g),重复测量2次,每次间隔15 min,取2次平均值作为大鼠的TFT,为避免组织损伤,将实验终点的最大值设为600 g。
1.5.2 热痛缩爪潜伏期(PWL)测定 将热板仪温度设定为(52.0±0.2)℃,到达设定温度后将大鼠左后足贴于热板,并开始计时,当感觉大鼠有明显的逃避动作时,停止计时,重复测试2次,取平均值作为该大鼠的PWL,两次测试间隔不应小于15 min。为防止大鼠后足烫伤,最大值设置为30 s。
各组均应测定造模前,造模后第3、21天,首次给药或PBS后的第1、3、7、14天的TFT和PWL。其中以测定的造模前TFT和PWL为基线值。每次测定时间为上午9:00-11:00,所有测定均由同一人完成。
1.6 Western blot法测定磷酸化PI3K、p-AKT、p-mTOR、p-S6K表达 将大鼠断头处死,在冰上取L脊髓组织,转移至-80 ℃冰箱中冷冻保存。采用Western blot法测定磷酸化PI3K、p-AKT、p-mTOR、p-S6K表达,脊髓组织中加入RIPA裂解液(AR0105)和磷酸酶抑制剂(AR1183),冰上匀浆后离心,取上清液,用BCA蛋白定量试剂盒(AR0146)进行蛋白浓度测定。以50 μg蛋白在SDS-PAGE胶上电泳,转印至NC膜上。用BSA-TBS缓冲系统封闭液封闭2 h,加入用一抗稀释液(AR1017)稀释的一抗(P-mTOR抗体,1∶ 800;p-AKT抗体,1∶800;p-S6K抗体,1∶1000;PIK3CA抗体,1∶1000),摇床上4 ℃孵育过夜,TBS-T洗膜10 min 3次,加入稀释过的二抗(HRP-羊抗兔,1∶5000;HRP-羊抗小鼠,1∶5000),室温下孵育2 h,TBS-T洗膜10 min 3次,用ECL化学发光试剂(AR1196)进行发光显色,应用成像分析仪自动成像,运用ImageJ软件分析蛋白条带灰度值。以β-Actin、GAPDH为内参。
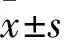
2 结 果
2.1 大鼠生理变化情况 造模前,模型组的体重与N组比较,差异无统计学意义;造模后第3、21天,模型组与N组的体重比较具有统计学差异(<0.01);给药后第3、7、14 天,与N组相比较,DC组以及DG组的体重均明显下降(<0.01),而DG组与DC组的体重相比较,差异无统计学意义(>0.05,表1、2)。


2.2 大鼠血糖变化情况 造模前,N组与模型组的血糖比较,差异没有统计学意义;造模后第3、21 天,模型组与N组相比较,血糖均明显升高(<0.01,表3)。
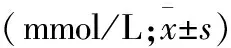
2.3 压尾机械阈值(TFT)及热痛缩爪潜伏期(PWL)的变化情况 造模前,N组与模型组的TFT、PWL比较,差异均无统计学意义;造模后第3天,模型组的TFT和PWL值开始降低;造模后第21天,模型组的TFT和PWL值明显降低,与N组比较,差异均具有统计学意义(<0.01,表4)。
给药后第3 天,DG组的TFT和PWL值开始升高;给药后第7 天,DG组的TFT和PWL值明显升高,与DC组比较,差异均具有统计学意义(<0.01),且DC组明显低于N组(<0.01);给药后第14天,DG组的TFT和PWL值与N组相比较,差异均无统计学意义,且DC组明显低于N组(<0.01,表5)。
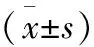
2.4 脊髓磷酸化PI3K、p-AKT、p-mTOR、p-S6K表达变化情况 DC组与N组比较,DC组脊髓背角磷酸化PI3K、p-AKT、p-mTOR、p-S6K均明显升高(<0.01);DG组与DC组相比较,DG组脊髓背角磷酸化PI3K、p-AKT、p-mTOR、p-S6K均降低(<0.01);DG组与N组相比较,差异无统计学意义(表6,图1)。
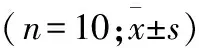
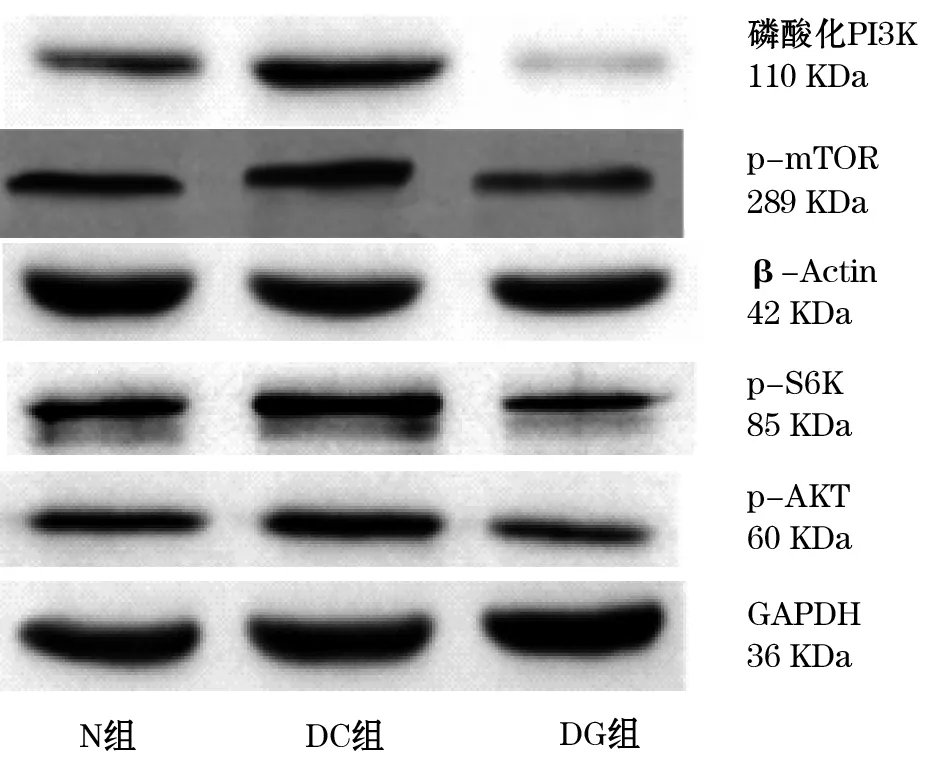
3 讨 论
GDNF是新发现的一种神经营养因子,也是目前已知对受损多巴胺能神经元以及运动神经元作用最强的神经营养因子,并且有实验研究发现GDNF对NP有一定的镇痛作用。GDNF发挥生物效应依赖于与其受体的结合,即各种神经元对GDNF产生应答的前提是必须有GDNF受体存在。目前普遍认同的GDNF作用机制为:GDNF首先与固定于细胞膜外层的GFRα-1特异性结合,引起GFRα-1二聚体化,形成复合物,该复合物与Ret的细胞外结构域结合,激活Ret蛋白磷酸化,磷酸化的Ret进一步激活其存在于细胞内的下游底物,如丝裂原活化蛋白激酶(MAPKs)、PI3K等,从而发挥GDNF的生物学效应。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种广泛存在于各种生物细胞中的非典型丝氨酸/苏氨酸磷酸化激酶,属于磷脂酰肌醇激酶相关激酶(phosphatidylinositol kinase-related kinase,PIKK)蛋白质家族成员。其通过参与转录、翻译、核糖体合成等多种生物过程,调节细胞的代谢、增殖、分化、凋亡等多种生理过程,同时mTOR也参与细胞因子、生长因子、谷氨酸等刺激诱发突触可塑性的过程。
近年有研究发现,mTOR通过调控蛋白合成,参与外周敏化和中枢敏化,在维持慢性疼痛状态中扮演重要角色。在癌痛、炎性痛、神经病理性疼痛等多种疼痛模型的脊髓背角表层发现AKT信号通路处于激活状态,且mTOR激活并大量表达,表明PI3K-AKT-mTOR信号通路广泛参与这些疼痛模型中突触可塑性的形成过程以及疼痛信号转导过程。AKT是PI3K下游的重要信号物质,王存金等利用CCI大鼠模型,注射GDNF后的CCI大鼠热痛敏程度明显降低,体内p-AKT表达也明显下降。表明GDNF能通过调控PI3K-AKT信号通路,降低p-AKT表达水平,从而达到镇痛的作用。mTOR是AKT的下游因子之一,有研究观察到DNP大鼠脊髓背角中mTOR的大量激活与DNP机械痛阈过敏时间一致,通过鞘内持续注射雷帕霉素,治疗组p-S6K逐渐下降,而机械缩足阈值开始逐渐升高,实验表明DNP慢性疼痛状态的维持依赖于mTOR和S6K的表达和磷酸化,大鼠脊髓mTOR上调并活化可能是DNP的发病机制之一。
在现有的关于DNP发病机制的研究中,已经阐明了TNF-α等炎性因子在DNP的发生及发展过程中发挥重要作用,而有研究发现TNF-α等炎性因子与mTOR的激活存在一定的联系,并且mTOR控制着转录因子NF-κB的活动。此外,还有发现mTOR还参与调控P38MAPK调节蛋白的合成,而P38MAPK的激活目前也被认为在DNP发生中起重要作用。根据以往的研究我们还可以推测mTOR通过介导P38MAPK调节蛋白的大量合成以及上调TNF-α等炎性因子参与DNP的发生及发展过程,具体情况还需进一步实验研究。
本研究利用由STZ诱导的DNP大鼠模型,探究GDNF对DNP大鼠行为学的影响,以及脊髓背角磷酸化PI3K、p-AKT、p-mTOR和p-S6K表达水平的影响。实验结果显示,鞘内注射GDNF能有效缓解DNP大鼠的疼痛,并且降低磷酸化PI3K、p-AKT、p-mTOR和p-S6K的表达水平,提示GDNF发挥镇痛作用的机制可能是GDNF与GFRα-1特异性结合形成复合体,该复合体再与Ret细胞外结构域结合,激活跨膜受体Ret磷酸化,进而激活细胞内PI3K/AKT信号通路,下调p-AKT表达水平,从而抑制p-mTOR及mTOR下游底物p-S6K的表达,之后可能通过减少P38MAPK的合成以及下调TNF-α等炎性因子,最终达到缓解DNP的目的。本实验结论可以为进一步明确GDNF的镇痛作用机制提供支持,为临床治疗DNP提供新思路。
