拟南芥bHLH转录因子在根毛发育中的作用
2022-04-06武家颂崔欣茹张景荣何丹宁顾芝瑕吴玉环俞志明
武家颂,崔欣茹,张景荣,徐 菲,陈 媛,周 洁,何丹宁, 顾芝瑕,吴玉环,俞志明
(1. 杭州师范大学生命与环境科学学院,浙江 杭州 311121; 2. 杭州师范大学生命与环境科学学院植物RNA信号传导研究中心,浙江 杭州 311121)
根毛是由根表皮单细胞发育而成的管状凸起,其极性生长的特点是研究细胞分化的理想模型[1].根毛是根的重要组成部分,当植物遇到缺水或者养分不足(尤其是缺磷)的情况下,往往会通过增加根毛的长度和密度来缓解不利因素[2].根毛使植物更好地锚定在土壤中,并为土壤微生物提供与植物互作的场所[3].
模式植物拟南芥(Arabidopsisthaliana)具有基因组小、生育期短、遗传材料多等优点,是根毛发育调控机制研究最清楚的植物.现有的根毛发育调控模型表明,拟南芥根毛发育是由根毛细胞的位置和转录因子复合物的侧向运输共同决定的[4].该模型涉及众多转录因子家族,其中碱性-螺旋-环-螺旋(basic helix-loop-helix, bHLH)在其中起重要作用.这些bHLH基因在根毛发育过程中起正向或负向调控作用.目前关于bHLH家族功能研究进展的报道主要集中在逆境胁迫、生长发育及信号转导[5-6],针对bHLH参与根毛发育调控的报道较少[7].为了更好地追踪最新研究进展,本文对近期相关研究成果进行归纳总结,阐述bHLH在拟南芥根毛发育调控中的作用.
1 根毛的发育
拟南芥根尖成熟区从内到外依次为木质部、韧皮部、中柱鞘、内皮层、皮层及表皮细胞[8](图1).根毛主要分布在成熟区,其发育过程分为4个阶段:根毛细胞命运决定、起始、伸长(尖端生长)和成熟[2].

图1 拟南芥根成熟区横切面[2,9]Fig.1 Cross section of the Arabidopsis root maturation region[2,9]
根毛细胞命运决定主要有3种模式:随机模式、小细胞模式和聚类排列模式[10].在随机模式中,任何位置的表皮细胞都能产生根毛,代表植物有竹子和芦苇等单子叶植物、绝大多数双子叶植物[11];在小细胞模式中,根表皮细胞不对称分裂产生的较小细胞发育为根毛,代表植物有水鳖[11];在聚类排列模式中,根毛细胞与非根毛细胞交替分布,根毛细胞呈队列式排列.
与两个皮层细胞接触的表皮细胞形成根毛,称之为H细胞(root hair cell);只与一个皮层细胞接触的表皮细胞不能形成根毛,称之为N细胞(non-root hair cell).这种类型的根毛细胞在十字花科等植物中广泛存在,代表植物有拟南芥[11].
根毛起始是指根毛母细胞在靠近根尖端形成凸起的过程[12].Rho GTP酶极性化地定位在即将凸起的细胞质膜上,决定根毛起始的部位[13],跨高尔基网络定位蛋白YIP4a及YIP4b对Rho GTP酶的激活及在质膜上的积累起关键作用[14].同时,根毛起始区域会产生高Ca2+浓度区,高Ca2+浓度能一直持续到根毛伸长阶段[13].根毛起始区呈酸性(pH<4.5),酸性条件能够为富集在根毛凸起处的EXPANSIN等细胞壁作用蛋白发挥功能提供最佳环境,细胞壁膨松,根毛凸起[15].另外,F-actin大量富集在凸起部位,也被认为是根毛起始形成的关键因素[16].
根毛伸长是指从起始部位向外继续延伸,形成管状细胞结构的过程.在根毛伸长过程中,新质膜和细胞壁合成所需的原料等都堆积在根毛尖端,而此时根毛尖端伸长区内的Ca2+浓度是细胞质内浓度的10倍左右,当Ca2+浓度差异消失时,根毛伸长随即停止[17].肌动蛋白在肌动蛋白解聚因子和Profilin协同作用下,动态地完成重组装[16].而在根毛起始中起关键作用的酸性条件,似乎在根毛的伸长阶段并不是特别重要,因此根毛起始和伸长被认为是完全不同的2个阶段[15].
根毛成熟是指根毛伸长到一定长度后不再生长的阶段.细胞质和液泡聚集在根毛圆盖形顶端处,Rop GTP酶[13]和钙离子浓度降至基线水平[18],钙离子通道蛋白随后消失[19].至此,根毛细胞成熟.
2 与拟南芥根毛发育相关的bHLH转录因子
bHLH是植物第二大转录因子家族,可以形成同源或异源二聚体[20].通过共同基序预测拟南芥有147个成员,归为21个亚家族[21];还有报道[22]称有133个成员,其中113个能被检测到.与动物bHLH相比,植物bHLH是由B类祖先进化而来,拟南芥bHLH分成12个亚家族.整合以上二者的数据并进一步分析后认为,拟南芥有162个成员[23].利用十字花科18种代表植物替换早先的9种代表植物,再进行序列比对分析后发现,拟南芥中含有225个bHLH转录因子[24].
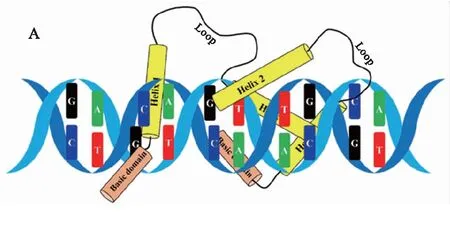
bHLH由两个不同的功能域组成:氨基端(N端)为约15个碱性氨基酸残基组成的DNA结合结构域(basic region),识别并结合DNA核心基序E-box (5’-CANNTG-3’) (图2A)和G-box (5’-CACGTG-3’) (图2B),典型的碱性区内含有极保守的HER元件(His5th-Glu9th-Arg13rd)[22];羧基端(C端)是由疏水氨基酸残基组成的HLH区域(helix-loop-helix),是形成同源或异源二聚体的亲和结构域.其中,两个α-螺旋被一个可变长度的环状结构分隔[21].
在植物中,bHLH在根[25]、茎[26]、叶[27]、花[28]、果实[29]、种子[30]的生长与发育,信号转导[31]和逆境胁迫[32]等调控过程中均具有重要的生物学功能.截至目前,已发现有11个AtbHLH基因在根毛发育过程中起重要作用,见表1.本文将对这11个成员在根毛发育调控网络中所扮演的角色进行详细阐述.

表1 拟南芥中参与根毛发育的bHLHsTab.1 Members of bHLH family involve in root hair development in Arabidopsis
2.1 AtbHLH1(GL3), AtbHLH2(EGL3), AtbHLH12(MYC1)
与野生型相比,纯合突变体gl3-1或egl3-1根下半部分的根毛无显著差异,但根上半部分的根毛明显增多,而纯合双突变体gl3-1egl3-1不论在根的下半部分还是上半部分的根毛都增多.35S:GL3及35S:EGL3转基因植株只产生极少量的根毛.由此可见,GL3与EGL3基因功能是冗余的,且无论根毛细胞还是非根毛细胞,都对根毛发生起抑制作用.由甲苯胺蓝染色结合GUS报告基因的结果可以得知,GL3/EGL3基因在根表皮细胞发育早期表达[34].Atmyc1表现为短根毛表型[36],处于WER、CPC基因下游,但不受GL2的调控[33].EGL3、GL3、MYC1都属于Ⅲf亚家族[33].
2.2 AtbHLH66 (AtLRL1), AtbHLH69 (AtLRL2), AtbHLH82 (AtLRL3)
百脉根突变体Ljrhl1-1及Ljrhl1-2的表型为无根毛或极少根毛,是由LjRHL1基因(ROOTHAIRLESS1)突变导致.RHL1属于bHLH家族,与拟南芥AT2G24260(AtLRL1,AtbHLH66)、AT4G30980(AtLRL2,AtbHLH69)、AT5G58010(AtLRL3,AtbHLH82)处在进化树的同一个分支(Ⅺ亚家族),这3个同源基因都能完全回复百脉根根毛突变表型[35].Atlrl1-2和Atlrl2-2突变体根毛与野生型无明显差异,但Atlrl1-2、Atlrl2-2-/+或Atlrl1-2-/+、Atlrl2-2双突变均表现出短根毛的表型[35].纯合突变体Atlrl3-1根毛与野生型相比无明显差异,Atlrl1-2-/+、Atlrl3-1及Atlrl2-1Atlrl3-1双突变体表现为短根毛.相对而言,Atlrl2-1Atlrl3-1的根毛突变表型更为明显.三突变体Atlrl1-2-/+、Atlrl2-1、Atlrl3-1的根毛极少[35].因此认为AtLRL1、AtLRL2、AtLRL3功能冗余,且对根毛发育起正调控作用.AtbHLH66、AtbHLH69基因突变后,会出现根毛分叉表型[33].
2.3 AtbHLH83(RHD6), AtbHLH86(RSL1)
拟南芥不同生态型(Col-0,Ler,WS)的rhd6突变体根毛少且短[39].rhd6在根毛凸起部位表现出明显的基部位移,还能观察到同一个细胞内产生多根毛的现象,并占有一定的比例.因此,RHD6与根毛极性发育及根毛起始关系密切[40].RSL1与RHD6同属bHLH的Ⅷc亚家族[22],存在功能冗余现象.与野生型相比,Atrsl1-1突变体根毛不论长度和密度的差别均不明显;Atrhd6-3Atrsl1-1纯合双突变体几乎无根毛.AtRSL1只能部分回复Atrhd6-3Atrsl1-1双突变的根毛表型[39].
2.4 AtbHLH54(RSL4), AtbHLH84, AtbHLH85(RSL2)
rsl4-1纯合突变体根毛变少变短,RNAi植株是短根毛且少根毛,35S启动子过表达RSL4后,根毛明显伸长.与野生型的根毛细胞核比较,过表达RSL4后的根毛细胞核并未发现明显变大,说明RSL4是通过延长工作时间达到伸长根毛的效果,对根毛伸长起正调控作用[38].RSL2与RSL4在bHLH结构域上的相似度为89%,而两个蛋白质之间的相似度为40%.rsl2-1表现为少且短根毛表型.rsl2-1rsl4-1双突变在体视镜下为无根毛表型,但冷冻扫描电镜显示,与周围的非根毛细胞相比,根毛细胞存在明显凸起,说明RSL2、RSL4基因只在根毛伸长过程中起作用[38].分别用RSL2和RSL4基因回复rsl2-1rsl4-1突变体,RSL2只能部分回复少根毛及短根毛表型,RSL4可以在较大程度上回复根毛突变表型,但是与野生型相比仍存在差异[38].RSL4、AtbHLH84、AtbHLH85都属于Ⅷc亚家族[22],其中Atbhlh84、Atbhlh85突变体根毛会出现分叉表型[33].
3 拟南芥bHLH转录因子在根毛发育调控网络中的作用
根毛细胞命运决定过程涉及侧向运输和位置决定两种根毛发育模型,即转录因子在细胞间的侧向运输和位置决定基因SCM对根毛的命运起调控作用[4].截至目前,已知在根毛发育调控中起重要作用的基因如表2所示.

表2 根毛发育调控的重要基因Tab.2 Key genes of root hair development regulation
3.1 非根毛细胞发育
只与一个皮层细胞接触的表皮细胞发育成非根毛细胞.在非根毛细胞 (N细胞) 中,GL3/EGL3蛋白能与TTG1及WER结合,形成WER-GL3/EGL3-TTG1三元复合物[36].WER-GL3/EGL3-TTG1复合物正调控转录因子GL2的表达[4,46-47](GL2是同源域/亮氨酸拉链转录因子蛋白[48],是根毛发育的负调控因子[43,48]),使N细胞最终成为非根毛细胞(图3).
GL2通过两条途径抑制根毛生成:①GL2直接靶向作用于RHD6(AtbHLH83)、RSL1(AtbHLH86)、RSL2(AtbHLH85)、LRL1(AtbHLH66)、LRL2(AtbHLH69)基因启动子,抑制这5个基因的表达,从而抑制根毛的产生[38](图3); ②GL2正调控C2H2型锌指蛋白转录因子AtZP1的表达,而AtZP1直接抑制RHD6(AtbHLH83)、RSL4(AtbHLH54)和RSL2(AtbHLH85)的表达[49](图3).WER-GL3/EGL3-TTG1复合物还可诱导CPC表达[4],CPC蛋白可以从非根毛细胞转运到邻近的根毛细胞[50-51].与CPC蛋

当拟南芥根表皮细胞同时与两个皮层细胞接触时,将发育成根毛细胞(粉色背景),而只与一个皮层细胞接触的表皮细胞则成为非根毛细胞(淡蓝色背景).
白的移动方向相反,GL3/EGL3蛋白从根毛细胞移动至邻近的非根毛细胞[52].
3.2 根毛细胞发育
当根表皮细胞与两个皮层细胞接触时,特异表达位置信号感受器蛋白SCM[44],使该细胞发育成根毛细胞.SCM抑制WER基因的表达,导致WER在与CPC蛋白竞争结合GL3/EGL3-TTG1过程中处于劣势[52],而从非根毛细胞移动至根毛细胞的CPC蛋白则处于竞争优势地位,最终大量形成CPC-GL3/EGL3-TTG1三元复合物.这个三元复合物抑制根毛负调控基因GL2的表达[53-54],使GL2抑制的下游根毛正调控基因得到表达,最终生成根毛[36,55](图3).
4 展望
4.1 bHLH在其他根毛诱导条件下的功能
根毛发育受内部基因控制外,还受到激素、缺素等外界因素的影响,比如:缺磷条件下,生长素从根尖运输至分生区,调控RSL2及RSL4基因表达,增加根毛密度,诱导根毛伸长[55];与RSL4启动子直接结合的MYB30是根毛发育负调控因子,乙烯信号通路主效转录因子EIN3(ETHYLENE INSENSITIVE3)是正调控因子,MYB30与EIN3之间具有互作关系,缺磷会诱导EIN3与MYB30对抗性竞争驱动RSL4表达,从而诱导根毛伸长[56].与缺磷条件诱导根毛发育的机制研究相比,其他条件诱导因素的研究还相对比较薄弱[50-52,57].这些诱导因素中是否还存在新的根毛调控机制,以及bHLH在其中的功能还有待深入研究.
4.2 与根毛发育相关新bHLH基因的挖掘
拟南芥bHLH转录因子家族成员众多、功能各异.除了文中提到的11个成员外,寻找更多与根毛发育调控直接相关的bHLH将是未来需要解决的问题.Bruex等[33]从拟南芥17个根细胞命运突变体出发,通过转录组数据挖掘到与根毛发育相关的208个核心基因,其中AT3G26744(AtbHLH116)还未被实验证实.Zhang等[58]基于微流控及Barcoding技术开发的单细胞转录组测序(single-cell RNA sequencing, scRNA-Seq)技术[59],发现AT5G15160(AtbHLH134)在表皮细胞(18#细胞簇)及干细胞龛(19#细胞簇)特异表达,预示其可能在表皮细胞命运决定中起作用[58].单细胞测序技术更精准地再现了不同类型根细胞内bHLH基因表达的差异,以及在根毛/非根毛细胞内差异表达的基因,这些信息将为理解bHLH在根毛发育调控网络中的作用提供线索[58,60].
随着越来越多植物基因组测序工作的完成,bHLH家族增添了更多的新成员:水稻(Oryzasativa)有211个bHLH成员[24],已知OsbHLH115与根毛伸长直接相关[61];玉米(ZeamaysL.)有208[62]~308个[24]bHLH成员;马尾松(Pinusmassoniana)有88个bHLH成员[63];芒果(MangiferaindicaL.)中有212个bHLH成员[64];欧洲葡萄黑比诺(Vitisviniferacv. Pinot Noir)中预测有113个bHLH成员[65].这些新基因将为bHLH调控根毛发育研究提供新的思路.
