Msx1在小鼠腭板发育中的作用及机制研究
2022-04-06房郁坤朱晓静羊雪芹
刘 达,房郁坤,朱晓静,羊雪芹
(杭州师范大学生命与环境科学学院浙江省器官发育与再生技术研究重点实验室,浙江 杭州 311121)
腭裂是常见的先天性颅面畸形之一,是由于胚胎在发育过程中受到遗传和环境因素的影响而造成[1-3].在小鼠胚胎发育的第10.5天(E10.5),中央鼻突与侧鼻突和上颌突融合形成上唇和初生腭.E11.5两个上颌突向口腔内侧生长形成左右腭原基突起,先在舌侧向下垂直生长,然后在舌上方的水平生长,最终在中线处融合形成次生腭,至此形成完整的腭板(palate shelf).E16开始腭板分化成熟,在次生腭前部与初生腭融合骨化形成硬腭,在后部肌肉层与鼻中隔融合形成软腭[4-6].腭板的器官发生和发育由上皮组织和相邻的间充质相互作用形成,并且受到多个信号通路和不同转录因子组成的复杂网络信号的调控,参与腭板发育过程中发生、提升、融合的重要基因的突变都可能导致腭裂[7-8].
腭板的发育是一个精密调节的过程,期间多个信号分子和转录因子(如WNT5A、MSX1、PAX9、SHOX2、FOX和TBX22)在腭板形态发生和器官形成中发挥作用[6-13].例如,介导非经典Wnt信号通路的WNT5A能够调节细胞增殖和迁移,影响小鼠腭板的发育[12];转录因子SHOX2能够调节小鼠硬腭发育过程的成骨分化和形成模式[9,14];转录因子PAX9和FOXF在腭板间充质中能调节腭上皮发育,突变小鼠腭板发育畸形[15-17].特异表达于后腭的TBX22最早在X染色体的转录定位中发现,人类TBX22突变与X连锁的腭裂和唇腭裂相关[18-20],小鼠Tbx22的上游转录因子MN1通过促进Tbx22的表达调节小鼠腭板的发育[21].同源盒转录因子MSX1是腭板发育的关键因子[13].有研究报道,作为中国人群的易感基因,唇腭裂现象中的MSX1遗传力高于10%[22],人类MSX1突变会导致唇腭裂和牙齿发育不全[23-24].小鼠Msx1缺陷会导致一些严重的颅面缺陷,包括腭裂、牙齿缺失和延迟骨化[25-26].有报道[26]显示,Msx1-/-胚胎在妊娠期间短暂的缺氧应激后发生唇裂.在Msx1-/-小鼠中,腭裂表型可以通过异位表达Bmp4诱导上皮细胞表达Shh,激活腭板间充质Bmp2表达,刺激细胞增殖得到挽救[13].研究表明,在腭板前段(anterior palate,AP),外源性BMP可有效诱导Msx1表达,并促进细胞增殖[13].
尽管已有研究明确了Msx1与腭板发育密切相关,但Msx1在腭板发育和生长模式中的分子调控机制仍然有待进一步研究.本研究建立Msx1条件性过表达小鼠,使用Wnt1-Cre工具小鼠与之交配,获得在神经嵴来源的间充质细胞中过表达Msx1的子代小鼠,研究Msx1在小鼠腭板发育中的作用及调控腭板发育的分子机制,以期为人类Msx1突变造成的腭裂的发病机制提供线索.
1 材料和方法
1.1 实验动物及繁育鉴定
Msx1条件性过表达小鼠(Rosa-Flag-Msx1)为杭州师范大学生命与环境科学学院颅面部器官发育实验室构建[25],研究所用小鼠均饲养于杭州师范大学实验动物中心SPF级饲养间内,受到杭州师范大学实验动物福利与伦理委员会的监督.
通过碱裂解法提取基因组DNA,加入2 μL作为PCR反应的模板,PCR反应体系为20 μL.利用引物P1:5’-CCGACTTGAGTTGCCTCAAG-3’,P2:5’-TAAGCCTGCCCAGAAGACTC-3’和P3:5’-TCGCCTTCTTGACGAGTTCTTC-3’扩增,进行小鼠基因型鉴定.
1.2 荧光定量PCR
使用RNA抽提试剂TRIzol (Invitrogen,美国)提取小鼠腭板组织的RNA,通过PrimeScript 1st Strand cDNA Synthesis反转录试剂盒(Takara,日本)合成cDNA.以组织cDNA为模板,18s作为内参基因,采用SsoFast EvaGreen Supermix实时荧光定量PCR试剂盒(Bio-rad,美国)和实时荧光定量PCR仪 (Bio-Rad,美国)进行实时荧光定量聚合酶链式反应.每个样品3个重复,总反应体系为20 μL,其中cDNA 1 μL.反应条件为:95 ℃预变性10 min;95 ℃ 5 s,60 ℃ 20 s,72 ℃ 10 s,40个循环;95 ℃ 15 s,60~95 ℃溶解曲线,0.3 ℃增量.定量引物来自美国哈佛大学q-PCR引物数据库Primerbank.
1.3 HE染色
收集E16.5的Msx1过表达小鼠和同窝野生型小鼠的腭板,经4%多聚甲醛(PFA)固定后石蜡包埋,制备厚度为7 μm的组织切片.组织切片通过二甲苯—乙醇—苏木精—伊红—乙醇—二甲苯等不同试剂不同梯度染色处理后,由中性树脂封片固定,显微镜观察.
1.4 免疫组化
收集小鼠腭板,经4%PFA固定、石蜡包埋.制备厚度为5 μm的组织切片,经脱蜡、抗原修复、封闭后使用PHH3(Cell Signaling Technology,美国)、SP7 (Abcam,英国)、RUNX2 (Santa Cruz,美国)抗体进行免疫染色.
1.5 RNA-seq测序
从E12.5的Msx1过表达和同窝野生胚胎中分离出腭板,提取总RNA.由华大基因公司进行文库构建并进行RNA-seq测序分析.样品收集和测序共进行了2次独立重复实验,差异表达基因的筛选标准是Fold change(FC)≥1.5.原始序列数据已保存于中国科学院国家生物信息中心/北京基因组研究所国家基因组数据中心基因组序列档案库(https://bigd.big.ac.cn/gsa),编号为CRA005453.
1.6 统计学分析
用Graphpad Prism8软件进行统计学分析,采用Studentt检验进行显著性分析,结果用M±SD表示,P<0.05为差异有统计学意义.
2 结果与分析
2.1 Msx1过表达小鼠的构建和验证
Msx1条件性过表达小鼠构建见图1.通过基因型鉴定,PCR鉴定结果为野生型258 bp条带,Msx1纯合条件性过表达小鼠为569 bp条带,杂合鼠为258 bp和569 bp条带.为获得Msx1过表达的突变鼠,将Wnt1-Cre和Rosa-Flag-Msx1交配,获得神经嵴细胞来源的间充质细胞中过表达Msx1的突变小鼠(RosaMsx1Wnt1-Cre)(图2A),如果过表达成功,该小鼠组织里也会有EGFP的表达.为进一步验证Msx1在RosaMsx1Wnt1-Cre小鼠间充质的过表达,使用荧光定量PCR分析了E12.5和E13.5腭板Rosa的荧光标记基因EGFP以及Flag-Msx1的相对表达量(图2B和2C).

图1 Rosa-Flag-Msx1小鼠构建示意图Fig.1 Schematic diagram of Rosa-Flag-Msx1 mouse construct
荧光定量PCR结果显示,和对照野生型小鼠比,RosaMsx1Wnt1-Cre小鼠E12.5和E13.5腭板组织中EGFP和Flag-Msx1的表达均显著增高,提示Msx1在突变鼠腭板中成功过表达(图2B和2C).E16.5,RosaMsx1Wnt1-Cre小鼠腭板的腭裂现象明显,腭板前中后部均未融合(图2A),提示Msx1过表达可导致腭裂.
2.2 细胞增殖和细胞分化
为寻找Msx1过表达造成腭裂的生物学原因,分析了Msx1过表达和同窝野生型小鼠的腭板细胞增殖情况.使用PHH3抗体对小鼠腭板进行免疫荧光检测发现,与野生型小鼠相比,Msx1过表达小鼠腭板在E12.5和E13.5,PHH3表达量有所降低,说明腭板细胞增殖减少(图3A).在E14.5,野生鼠腭板上抬并对向生长,但是Msx1过表达小鼠腭板抬升并未完成.E14.5,PHH3表达量无明显变化(图3A),在E12.5和E13.5,腭板细胞增殖显著下调,E14.5无明显变化(图3B).
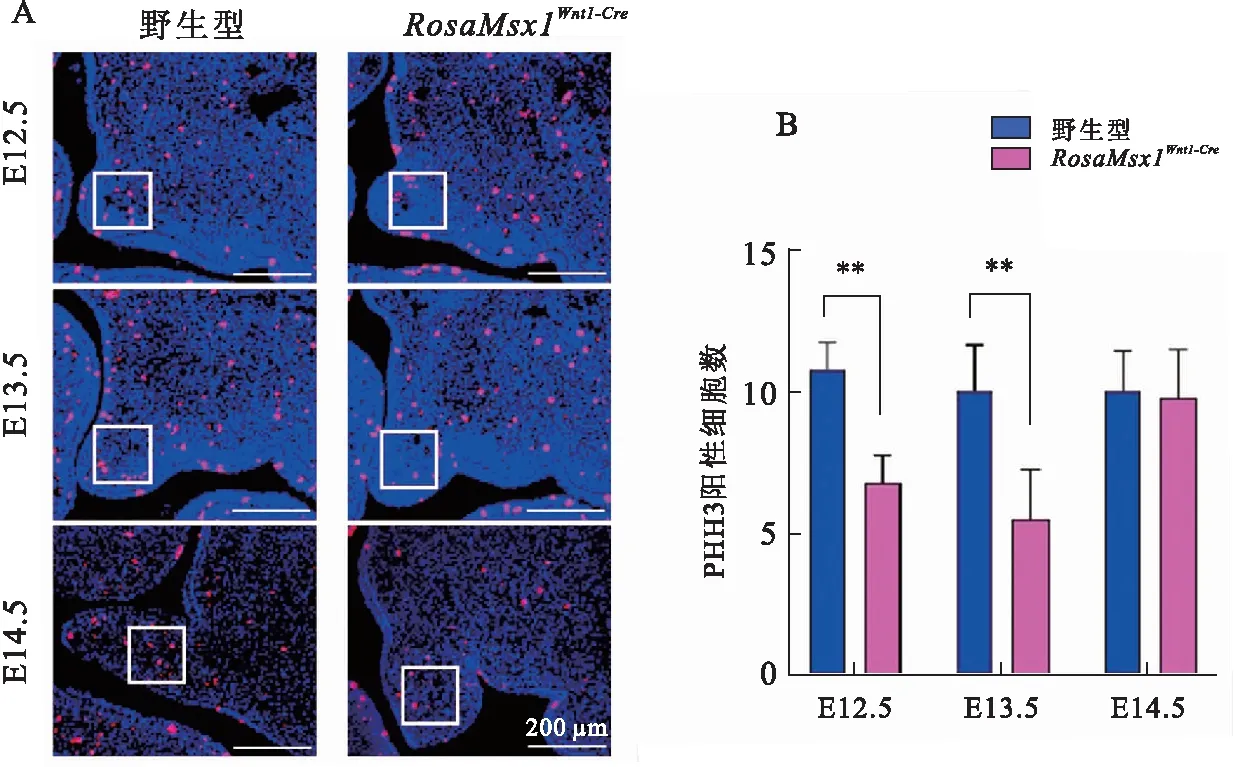
A: E12.5—E14.5腭板PHH3免疫荧光染色;B:A中腭板特定区域(方框)内PHH3阳性细胞数统计分析;**P<0.01.

图4 RosaMsx1Wnt1-Cre和同窝野生型小鼠腭板的 成骨细胞分化因子RUNX2和SP7的表达情况Fig.4 Expression of osteoblast differentiation factors RUNX2 and SP7 in palatal shelves of RosaMsx1Wnt1-Cre and their WT littermates
腭板发育过程中涉及成骨过程,本文研究Msx1过表达是否会影响腭板分化,选取骨分化的关键因子RUNX2和SP7作为研究对象.RUNX2又名核心结合因子(core-binding factor alhpal1),是间充质干细胞向成骨细胞分化的特异性转录调节因子,在成骨过程中起重要作用.SP7即OSTERIX,是一种新型含锌指的成骨细胞特异性转录因子,对成骨细胞增殖、分化和骨形成至关重要.结果表明,与野生型小鼠相比,Msx1过表达小鼠腭板细胞RUNX2表达无显著变化,SP7的表达明显下调(图4),提示MSX1可能通过影响SP7来调节腭板骨分化.
2.3 RNA测序分析及验证
收集E12.5Msx1过表达胚胎和同窝野生胚胎的腭板组织,进行RNA测序分析.RNA测序结果提示Msx1过表达腭板中有311个基因表达上调,471个基因表达下调.其中,Foxc2、Foxl1、Foxd1、Foxd2、Alx3、Wnt2、Wnt16、Bmp3、Fgf7、Fgf14、Tbx22等基因在过表达Msx1腭板中均发生了显著的表达变化(表1).结果表明,过表达Msx1与Foxc2、Foxl1、Foxd1、Foxd2和Alx3等的表达正相关,与Wnt2、Wnt16、Bmp3、Fgf7、Fgf14和Tbx22等的表达负相关.采用荧光定量PCR对相关基因进行验证(图5),结果提示Msx1对腭板发育关键基因的表达具有调控功能.
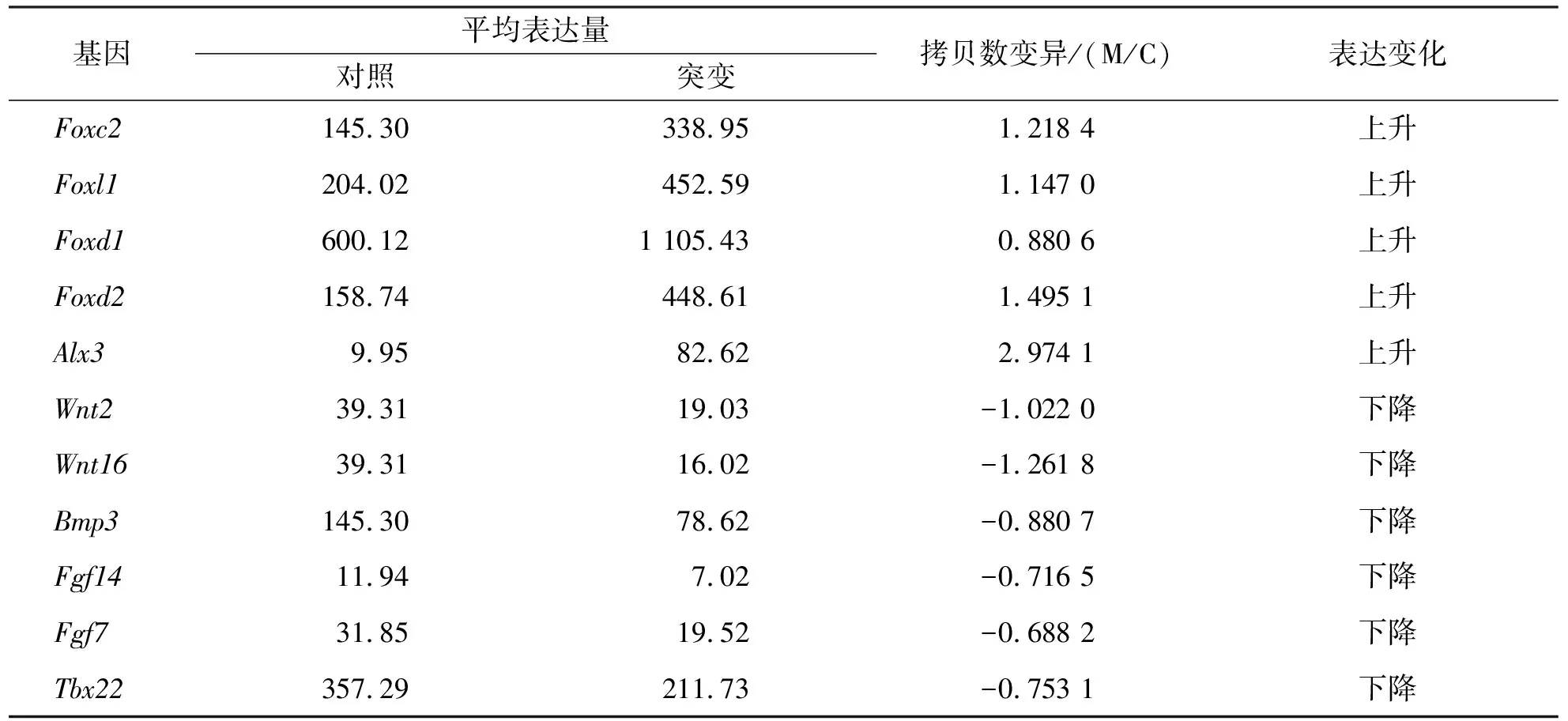
表1 Msx1过表达腭板和对照腭板组织关键差异表达基因Tab.1 Key differentially expressed genes in palates with Msx1 overexpression and control

**P<0.01.
3 讨论
腭板发育是一个复杂过程,涉及许多基因及其编码的生长因子和受体、相关转录因子等调控,导致腭裂的基因突变和调控机制也不尽相同[10,27].研究[28-29]发现,转录因子Msx1对腭板严格的时空发育模式具有重要的调控作用.除基因敲除外,组织特异性过表达是研究基因与器官发育相互作用很好的研究方法[30-32].本研究结果表明,小鼠间充质中过表达Msx1会导致腭裂,突变小鼠腭板细胞增殖下调,成骨细胞分化调节因子显著下调,与之关联的颅面部器官发育重要调节因子FOX、ALX、BMP、WNT和TBX等家族分子的基因表达也发生显著变化.结果说明,Msx1在腭板发育的细胞增殖、细胞分化等方面起关键调控作用,并调控多种重要颅面器官发育基因的表达.
研究表明Msx1的表达与细胞增殖相关.分离野生型小鼠胚胎的牙齿间充质细胞并对Msx1进行RNA干扰,发现Msx1表达下调会造成细胞增殖减少[33].在小鼠胚胎的肢芽发育中,Msx1能结合并上调成纤维细胞生长因子9(FGF9)和FGF18,促进细胞增殖[34].乳腺癌细胞中,抑制MSX1的表达,可诱导细胞周期变化和细胞凋亡,抑制乳腺癌细胞增殖[35].PHH3是细胞核分裂的特异性标志物,是构成染色体主要成分的核心蛋白,能够特异性识别磷酸化的组蛋白H3,因此PHH3常被用于识别真正的细胞有丝分裂[36].本研究通过检测PHH3的表达,发现过表达Msx1小鼠的腭板细胞增殖水平有所降低,表明Msx1与腭板发育过程中细胞增殖密切相关.
细胞分化对于器官功能的实现非常关键,腭板发育中骨细胞分化对于硬腭形成和腭板融合非常重要.研究表明Msx1与细胞分化关系密切,细胞模型中发现Msx1抑制成肌细胞分化[37],小鼠模型中Msx1能够调节颅骨骨细胞分化[38],敲除小鼠中Msx1可促进成牙细胞分化[33],在人类乳牙中MSX1参与并调节牙髓干细胞的成骨细胞分化过程[39].RUNX2和SP7都是影响成骨细胞分化的重要因子,Sp7是Runx2的下游基因[40].在腭板发育过程中,RUNX2能诱导细胞增殖,促进不成熟骨细胞向成骨细胞分化并调节肌肉发育[41-42].SP7可以上调成熟骨细胞下游标志物的表达,影响成骨细胞的迁移、凋亡和死亡,是腭板骨组织矿化所必需的[43-44].本研究中过表达Msx1小鼠腭板成骨的异常,主要原因可能不是腭板骨细胞增殖受到影响,而是调控腭板骨细胞分化和成熟的SP7表达降低,进而导致腭板成骨缺陷造成腭裂.
Msx1对介导哺乳动物颅面部器官发育中上皮-间充质相互作用的生长因子网络有重要的调控作用[45].哺乳动物胚胎发育中,涉及颅面部器官发育的基因有很多,例如:小鼠中敲除Alx3会抑制BMP诱导的成骨过程,下调成骨细胞分化,影响颅面部结构和发育[46];在颅面部间充质表达的Fox家族基因充分参与颅面部器官的发育,小鼠Foxc2缺失会导致腭裂和颅面发育畸形,人类FOXC2缺陷会导致腭裂[47-49];Tbx22敲除后小鼠成骨细胞成熟延迟,腭板间充质骨化严重减少[50-51];BMP信号通路对于颅面部器官发育也至关重要,其中BMP3是骨密度的负调控因子,对于骨发育和成骨具有调控作用[52];以上研究结果与本研究RNA-seq测序结果相对应,表明腭板发育中这些基因与Msx1的表达高度相关,协同调控哺乳动物腭板的发育.
综上所述,本研究通过建立Msx1过表达小鼠模型,分析Msx1过表达小鼠腭裂的表型,研究其细胞增殖和腭板骨分化情况,进一步分析Msx1过表达小鼠腭板基因表达变化,研究结果为预防和治疗腭裂提供新的思路.
