膜诱导技术治疗胫骨慢性感染性骨缺损的临床疗效
2022-04-06陈星宇徐永清杨晓勇张曦娇岳正华何晓清李军石健
陈星宇,徐永清,杨晓勇,张曦娇,岳正华,何晓清,李军,石健
感染性骨缺损的治疗需要同时控制骨感染及重建骨缺损,且两者互相交织,给临床医师治疗带来极大的挑战[1]。尽管感染性骨缺损的治疗技术不断发展,但术后并发症及二次入院率仍很高。2000 年,Masquelet 首次报道了膜诱导技术治疗骨缺损的方法。由于其具备操作简单、成骨快、肢体畸形发生率低、不易发生接触点骨不连、尤其适用于大段骨缺损的治疗等优点,受到广泛关注。膜诱导技术治疗分两个阶段:第一阶段清创,在骨缺损部位置入骨水泥间质体并诱导局部产生异物反应膜;第二阶段在膜内进行骨移植修复骨缺损[2-4]。2017年1月至2020年1月,解放军联勤保障部队第九二〇医院(以下简称“我院”)收治了42例胫骨感染性骨缺损患者,均采用膜诱导技术分两阶段手术分期治疗。本研究通过回顾性分析,探讨膜诱导技术治疗胫骨感染性骨缺损的临床疗效。
1 资料与方法
1.1 纳入与排除标准
纳入标准:①Cierny-Mader 解剖分型Ⅲ型、Ⅳ型的胫骨骨感染;②年龄为16~65岁;③一般情况良好,无严重并发症且治疗意愿强烈;④两期手术均使用内固定;⑤Cierny-Mader生理分级A级和B级。
排除标准:①严重合并症(糖尿病、肝肾功能不全等)无法进行手术的患者;②患肢无功能者(如截瘫、神经损伤等);③感染累及关节的患者;④肢体严重畸形或短缩超过5 cm 的患者;⑤随访资料不完整或随访时间小于12个月的患者。
本研究经解放军联勤保障部队第九二〇医院医学伦理委员会审批[批准号:2019-091(科)-01)]。所有患者均签署知情同意书。
1.2 研究对象
回顾性分析2017 年1 月至2020 年1 月我院收治的42 例胫骨感染性骨缺损患者,均采用膜诱导技术分两阶段手术分期治疗。其中男33例,女9例,年龄17~64 岁,平均年龄(41.4±13.9)岁,Cierny-Mader 解剖分型Ⅲ型11例,Ⅳ型31例,入院前手术次数0~6次,平均(1.8±1.5)次。软组织完好6例,有窦道及软组织缺损28例,清创后需要行皮瓣修复22例。术前下肢功能量表(lower extremity function scale,LEFS)评分13~79 分,平均(52.6±18.1)分。病程3~216 个月,平均(34.0±43.1)个月。
1.3 手术方法
1.3.1 术前准备
患者入院后停用抗生素至少1 周以提高细菌培养阳性率,对于有外固定的患者拆除外固定架等待钉道愈合。常规进行血清学检查及影像学检查,包括X线、MRI、CT、核素骨扫描、单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT-CT),如存在皮肤缺损或大面积瘢痕需行皮瓣覆盖则进行下肢动脉CT 血管成像(computed tomography angiography,CTA)。术前根据MRI确定软组织清创范围,根据CT、SPECT-CT确定骨组织清创范围。
1.3.2 第一阶段手术
首先进行软组织清创,软组织清创时一并处理窦道,清创范围需超出正常软组织2 mm,可以将感染灶视为囊性结构,清除内容物的同时需一并切除囊壁。骨组织清创标准为断端无硬化且骨皮质渗血(paprika sign 征)[5,6]。对于髓腔的处理,如果术中见髓腔封闭且MRI 及SPECT-CT 未见髓腔内病变时不打通髓腔,钉道及螺钉孔可以使用粗钻头磨削周围骨皮质。清创完成后使用锁定加压接骨板(locking compressing plates,LCP)内固定稳定断端,将聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥与万古霉素混合(每40 g PMMA 加入4 g 万古霉素[7]),制备成含抗生素的骨水泥,置入骨缺损处,并覆盖内植物和两断端部分骨质。对于创面无法闭合的患者同时行皮瓣覆盖。
1.3.3 第二阶段手术
通常在第一阶段手术后6~8 周时进行。术前需评估患者感染控制情况,同时满足以下几点则可以进行第二阶段手术治疗:①软组织完全愈合且无大块结痂、窦道、渗出液;②红细胞沉降率、C反应蛋白、降钙素原、白细胞计数连续检测2 次正常;③无不明原因发热、疼痛。手术中应小心分离膜并保护其完整性。取出所有内植物,多点取软组织样本进行冰冻切片检查再次确认有无感染存在,每高倍镜视野中性粒细胞数量<5 个时认为没有感染。打通两侧髓腔使髓内血供与移植物接触,处理两断端皮质直至渗血从而减少接触点骨不连的发生,然后将移植物填充于骨缺损处。选择内固定(通常使用髓内钉加LCP)固定。无张力缝合膜并将引流管置入膜内使其形成一个密闭的腔隙。
1.3.4 术后处理
术后引流管常规留置7 d,如7 d后引流量仍超过200 ml/d,则延长引流管留置时间。根据第一阶段手术获取的细菌学标本,应用敏感抗生素8周。切口拆线后允许患者进行功能锻炼及部分负重。第二阶段手术后根据LEFS 评分评价下肢功能,术后每4 周复查1次,直至X线检查可见3层皮质连续后,允许患者完全负重,并将随访周期改为每12周1次。
1.4 随访及观察指标
每2 周随访,记录LEFS 评分以确定下肢功能恢复情况,同时检测患者血清学感染指标变化趋势,确定有无感染复发并排除低毒性感染的存在。每4 周X 线检查复查,评估骨愈合情况并记录骨愈合时间(即X线检查显示3层皮质连续视为骨愈合),骨愈合后随访周期改为每12周1次,X线检查显示移植物完全塑形后取出内植物。
2 结果
本组42 例患者均获得随访,随访时间13~36 个月,平均随访(21.6±6.7)个月。第一阶段手术后骨缺损长度3.7~17.0 cm,平均(8.8±3.7)cm,清创次数1~4次,平均(1.3±0.8)次,皮瓣覆盖22 例,5 例皮瓣部分坏死后再次行筋膜皮瓣或游离植皮治愈;第二阶段手术后感染复发5例,4例经再次清创后感染控制,3例再次行第二阶段手术治疗,1例清创后联合骨搬移治疗获得骨愈合;1 例清创后感染再次复发,患者要求截肢治疗。本组患者除1例截肢外,其余均获得了骨愈合且末次随访时感染无复发,骨愈合时间4~13个月,平均(6.6±1.9)个月,5例患者移植物塑形后取出内固定物,取出时间30~34个月,平均(31.8±1.8)个月。末次随访时LEFS评分30~80分,平均(68.8±11.4)分,高于术前,且差异有统计学意义(t=5.804,P<0.001),表明下肢功能明显改善(LEFS评分减少>9分,可表明患者下肢功能有改善)。典型病例见图1。
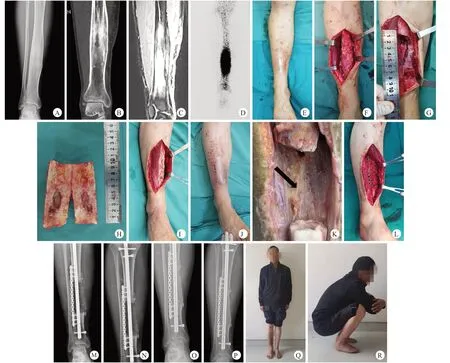
图1 患者,男,47岁,胫骨骨髓炎Cierny-Mader Ⅳ型,采用膜诱导技术治疗
3 讨论
感染性骨缺损的治疗一直是临床难题。患者病程漫长且经过多次手术治疗,通常合并软组织缺损、骨不连、肢体畸形等其他临床表现。对于感染性骨缺损的治疗,Huntington等在1905年首次描述了腓骨段的胫骨化和胫骨的双极融合治疗骨感染[8]。1951年Gavriil A.Ilizarov 研制了多用途环形骨外固定器,并发现牵拉成骨技术的生物学理论,随后将其应用于感染性骨缺损的治疗中[9]。此后,治疗广泛性骨干骨缺损最常用的方法是血管化游离骨移植及Ilizarov技术,两者均有较高的治愈率,前者的优点是成骨快,但需要较高的显微外科基础,且成骨后移植骨塑性能力有限,移植骨直径小于健康骨使其容易再次发生骨折。后者最大的优势是不需要骨源,但需要患者长时间佩戴外固定架并需要患者自行调整,常因调整外固定架不当导致肢体畸形,并容易出现接触点骨不连、成骨不全等并发症[10]。直至2000 年,Masquelet 首次报道了膜诱导技术治疗骨缺损的方法。该技术操作简便、重复性高,适用于各种类型的骨缺损,得到广泛应用。
本组患者第一阶段手术后6例复发,第二阶段手术后5例复发,彻底清创是治疗感染性骨缺损以及降低复发率的关键。既往治疗方法强调清除死骨、消灭死腔、改善局部血供来治疗骨感染,但仍有较高的复发率,主要是因为忽略了生物膜的存在。成熟的生物膜对抗生素及其他化学杀菌剂有着很强的抵抗力,一旦形成较难清除[11]。因此彻底清除生物被膜被视为治愈感染的关键步骤。整段切除病变骨质、扩大清创软组织等措施都有利于从物理上清除生物膜,局部高浓度抗生素的长期缓释则有利于消除残存的生物膜[12]。
抗生素PMMA间质体植入骨缺损区域后被证实可以长期高浓度的释放抗生素[13-15],与清创后直接覆盖创面或开放换药相比,植入抗生素PMMA 可以杀灭蜉蝣细菌、抑制生物膜的形成,从而更有效的控制感染并降低复发率。
本组根据患者术前各项影像学检查结果,确定感染范围,结合术中观察,彻底清除感染组织,感染控制率明显提高。但是慢性骨感染的治疗仍然难度较大,有部分患者需要反复清创才能最终实现感染的消除。所以无论治疗处于哪个阶段,如考虑有感染存在,应尽早处理,第一阶段手术后感染复发应尽早再次清创,第二阶段手术后感染复发,如无脓毒症状、局部皮肤无破损,可使用敏感抗生素2周,如症状缓解则继续使用抗生素4周,无好转则需重复第一阶段手术直至感染控制。无论感染是否复发,使用敏感抗生素的同时可联合应用利福平来增加抗生素疗效[16]。除清创及抗生素治疗外,稳定的力学环境也有利于感染的控制[17]。
彻底清创后造成的骨缺损,在预防感染复发的同时,还需要考虑重建的策略。通常认为如果将骨移植物直接放置在一个血管丰富的肌肉环境中,会出现部分或完全吸收,尤其是移植物长度超过4~6 cm会被完全吸收无法成骨[18-20]。膜诱导技术修复骨缺损时操作简便,直接将移植物填充至骨缺损处即可,膜内的丰富的血管不仅不会造成移植物吸收,还能促使移植物血管化和皮质化[21,22],其分泌的血管内皮生长因子、转化生长因子-β1及骨形成蛋白-2可以刺激骨髓细胞增殖并向成骨细胞分化[23],且骨愈合时间不受缺损长度的影响。
Fitoussi 等[24]认为治疗胫骨骨缺损时,放入的骨水泥间质体应该同时应用于腓骨,以获得更加稳定的力学环境并增加生物腔的容积,植骨时也应该植入胫腓间,这样可以利用骨间动脉来增加局部血供,并通过增加移植物与膜的接触面积来获得更好的皮质化,提高骨愈合速度。然而这无疑增加了对植骨量的需求。以往研究表明双侧髂前上棘取骨量约为20 cm3,双侧髂后上棘约为(36.9±1.7)cm3,应用扩髓冲洗抽吸系统约为37 cm3[25]。虽然可以添加部分同种异体骨以获得更大的植骨量,但以往的经验表明自体骨与同种异体骨之间的比例不能超过3∶1。通过在缺损中心区域放置占位器(如髓内钉、明胶海绵、磷酸钙等)也减少植骨量,但所占用的体积仍然有限。出于控制手术创伤、减少手术时间、简化手术操作的目的,本研究全部患者均未进行胫腓间融合,绝大多数患者术后4~6个月即实现了移植骨的矿化,获得了较好的骨愈合率。这可能与本组大多采用坚强的内固定有关。内固定增加了骨缺损区域的局部稳定性,有利于移植骨早期的皮质化,从而减少骨不愈合的发生。对于临界尺寸的骨缺损以及既往取自体骨移植的病例,仍然可能面对自体骨量不足的问题。对于Cierny-Mader Ⅲ型病例,感染骨段仅有部分骨质破坏时本组会尝试保留健康的骨皮质,对缩小手术创伤,减少自体骨取骨量及取骨后并发症有积极意义。但也需要更精确地判断骨感染的范围,以及承担更高的失败风险。
在使用膜诱导技术治疗胫骨感染性骨缺损的过程中,需要注意以下问题:①保证良好的软组织覆盖:良好的软组织覆盖是确保生物膜完整性的关键[26]。在胫骨由于胫前软组织较为薄弱,容易出现大面积缺损,常需要应用各种小腿皮瓣进行覆盖,因此需要术者具有熟练的皮瓣应用经验;②选择稳定的固定方式:稳定的力学环境有助于感染的控制及移植骨的愈合[27,28]。髓内钉除了具有较好的稳定性外,还可以填充植骨空间,减少植骨量,因此是内固定的首选材料。但在一些较大骨缺损区域,合并有骨质疏松时,锁定髓内钉后,两断端间仍然会有微动,在一侧皮质使用重建锁定板可以进一步稳定断端,对诱导膜的遮挡也相对较小,不会影响接骨板侧的成骨;③髓腔的处置:对于感染波及髓腔内的病例可以在髓腔彻底清创后内插入抗生素PMMA。若术中见髓腔封闭且MRI 及SPECT-CT 未见髓腔内病变时在一期清创时不打通髓腔,应该将其视为封闭且未被感染的一部分,此时处理髓腔可能导致原本清洁的髓腔被污染而造成髓内感染;而在二期进行骨重建时,必须将其打通,以有利于髓腔内血管的爬入,有利于骨愈合。
本研究的局限性:未从细胞水平分析骨愈合的过程,研究类型为回顾性研究,样本量小、随访时间短,后续需要更为严谨的前瞻性随机对照实验来深入探讨膜诱导技术治疗胫骨感染性骨缺损的临床疗效。
4 结论
使用膜诱导技术治疗胫骨感染性骨缺损具有确切的临床疗效、骨愈合时间相对较短等优点,应用内固定可以提高患者舒适性,减少植骨量。
【利益冲突】所有作者均声明不存在利益冲突
