重组Tet-on COLIA1基因腺病毒骨组织靶向表达对大鼠骨质疏松骨折愈合生物力学影响的实验研究
2022-04-06吴元刚曾羿李明阳刘渊裴福兴沈彬
吴元刚,曾羿,李明阳,刘渊,裴福兴,沈彬
骨质疏松是一种以骨量下降、骨显微结构破坏为特征的退行性疾病,严重危害中老年人群的生命健康[1-3]。研究证实,骨质疏松的发生发展与Ⅰ型胶原结构和含量的病理改变密切相关[4,5]。Ⅰ型胶原主要由2 条α1 链(由COLIA1基因编码)和1 条α2 链(由COLIA2基因编码)形成三螺旋纤维状结构,广泛存在于骨骼组织中[6,7]。本课题组前期的研究发现,经Tet-on 转染后的COLIA1基因在骨组织中具有靶向表达能力,能够增加成骨细胞COLIA1mRNA 表达量及Ⅰ型胶原含量,促进成骨形成[8]。因此,本研究在构建大鼠骨质疏松骨折动物模型的基础上,拟进一步研究重组Tet-onCOLIA1基因腺病毒对大鼠骨质疏松骨折愈合生物力学的影响。
1 材料与方法
1.1 主要实验仪器及药物
1.1.1 实验仪器
超净工作台(丹麦Heto-Hoten 公司),1.0 mm 克氏针(上海医疗器械有限公司),游标卡尺(北京仪器厂生产),外科手术器械[上海医疗器械(集团)有限公司],双能X 线骨密度测量仪(美国DMS 公司),电子万能材料试验机-5967(美国Instron 公司),Micro-CT(瑞士Scanco Medical公司)等。
1.1.2 实验药物
10%水合氯醛(四川大学华西医院科技园),重组Tet-onCOLIA1基因腺病毒(上海吉凯公司),盐酸强力霉素(美国Sigma公司)等。
1.2 大鼠骨质疏松骨折动物模型的建立
健康雌性SD大鼠(清洁级)40只,体重241~282 g,平均(264±10)g,购自四川达硕生物有限公司,饲养于四川大学华西校区基础动物实验中心。
40只健康雌性大鼠按照随机数字表法分为手术组和假手术组,其中手术组36只,假手术组4只。手术组大鼠切除双侧卵巢,建立骨质疏松动物模型。假手术组大鼠仅切开皮肤,不切除双侧卵巢。
手术组36 只大鼠切除双侧卵巢3 个月后,随机选取4只并处死,同时处死假手术组4只大鼠。收集其胫骨标本,采用双能X线测量假手术组和手术组大鼠骨密度,以证实大鼠骨质疏松模型建立成功。
随后,将其余32 只骨质疏松大鼠用薄电锯片从胫骨中段横行切断骨干,保证骨折断端光滑整齐,然后使用1.0 mm 克氏针固定胫骨骨折断端,以构建大鼠骨质疏松骨折模型。
1.3 实验方法
将32 只骨质疏松骨折大鼠按照随机数字表法随机分为4组,每组各8只。
实验分组如下:A 组,重组Tet-onCOLIA1基因腺病毒+强力霉素组;B组,重组Tet-onCOLIA1基因腺病毒组;C组,强力霉素+Tet-on空白腺病毒组;D组,空白对照组。
骨质疏松骨折大鼠用药方法如下:A组,使用强力霉素(100 mg/kg)以灌胃的方式喂养骨质疏松骨折大鼠1 周,随后在胫骨骨折断端局部注射重组Tet-onCOLIA1基因腺病毒,剂量为1.5×108ifu/kg;B 组,采用实验室的普通饲料喂养骨质疏松骨折大鼠1 周,随后在胫骨骨折断端局部注射重组Tet-onCOLIA1基因腺病毒,剂量为1.5×108ifu/kg;C 组,使用强力霉素(100 mg/kg)以灌胃的方式饲喂骨质疏松骨折大鼠1 周;随后在胫骨骨折断端局部注射空白Tet-on腺病毒,剂量为1.5×108ifu/kg;D 组,采用实验室的普通饲料喂养骨质疏松骨折大鼠1 周,随后在胫骨骨折断端局部注射生理盐水。
1.4 取材及检测方法
分别于注射腺病毒6、8 周后每组各处死大鼠4 只,收集胫骨标本后行micro-CT 扫描和生物力学试验。
术者仔细剔除标本表面的肌肉、筋膜等软组织成分,小心地取下克氏针,在对标本编号后,采用生理盐水浸透的纱布包裹后行micro-CT 扫描,以观察骨痂形态、连续性、皮质厚度等。
在电子万能材料试验机上进行胫骨三点弯曲试验,用游标卡尺测量胫骨标本中段外径。将标本放在有一定距离的两个支撑点上,在两个支撑点中点上方向标本施加向下的载荷,标本的三个接触点形成相等的两个力矩时即发生三点弯曲。实验过程中设定加载速率为2 mm/min,支点跨距为20 mm,用函数记录仪描记载荷-变形曲线。根据载荷-变形曲线和皮质骨内外径分析骨的生物力学性能参数。实验测得的力学指标包括:最大载荷、弹性模量、屈服点最大应力。
1.5 统计学方法
采用SPSS 22.0统计学软件进行统计学分析。数据经统计学分析均符合正态分布,以表示。采用t检验比较假手术组和手术组大鼠骨密度的差异;采用方差分析比较A、B、C、D 四组大鼠不同时间点生物力学指标的差异,进一步组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠骨质疏松模型建立
术后3个月,手术组大鼠胫骨骨密度低于假手术组大鼠[(0.262±0.048)g/cm2vs(0.381±0.024)g/cm2],且差异有统计学意义(P=0.005),表明大鼠骨质疏松模型制备成功。
2.2 最大载荷
腺病毒转染6、8周后,A组大鼠胫骨三点弯曲试验最大载荷均高于B、C、D 三组大鼠,且差异均有统计学意义(P<0.05)。B、C、D 三组大鼠的最大载荷两两比较差异均无统计学意义(P>0.05)。见表1。
表1 4组大鼠转染腺病毒后胫骨三点弯曲试验最大载荷比较(n=4,,N)

表1 4组大鼠转染腺病毒后胫骨三点弯曲试验最大载荷比较(n=4,,N)
注:△P<0.05,与A组比较
2.3 弹性模量(自动杨氏)
腺病毒转染6、8周后,A组大鼠胫骨三点弯曲试验弹性模量均高于B、C、D 三组大鼠,且差异均有统计学意义(P<0.05)。B、C、D 三组大鼠的弹性模量两两比较差异均无统计学意义(P>0.05)。见表2。
表2 4组大鼠转染腺病毒后胫骨三点弯曲试验弹性模量(自动杨氏)比较(n=4,,MPa)

表2 4组大鼠转染腺病毒后胫骨三点弯曲试验弹性模量(自动杨氏)比较(n=4,,MPa)
注:△P<0.05,与A组比较
2.4 屈服点最大应力
腺病毒转染6、8周后,A组大鼠胫骨三点弯曲试验屈服点最大应力均高于B、C、D 三组大鼠,且差异均有统计学意义(P<0.05)。B、C、D三组大鼠的屈服点最大应力两两比较差异均无统计学意义(P>0.05)。见表3。
表3 4组大鼠转染腺病毒后胫骨三点弯曲试验屈服点最大应力比较(n=4,,N)
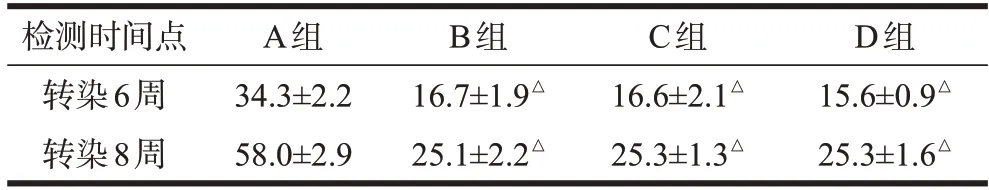
表3 4组大鼠转染腺病毒后胫骨三点弯曲试验屈服点最大应力比较(n=4,,N)
注:△P<0.05,与A组比较
2.5 骨折断端Micro-CT检测
在腺病毒转染6周后,A组大鼠骨折断端更加模糊,骨痂形成好。转染8周后,A、B、C、D四组大鼠骨痂骨折线基本消失,其中A组大鼠骨皮质光滑、较厚、较连续;B、C、D三组大鼠骨痂略欠光滑,局部残留大小不等的腔隙(图1)。

图1 腺病毒转染6周、8周后四组大鼠骨折断端micro-CT检测结果
3 讨论
骨有机质中含有大量的胶原纤维,其中以Ⅰ型胶原纤维为主,约占90%[9,10]。研究表明,Ⅰ型胶原数量、质量的减少会造成骨细胞中有机质含量的下降,最终导致钙盐沉积不足和钙结节数量下降[11,12]。对绝经后妇女的研究进一步证实,雌激素分泌减少也会造成成骨细胞和Ⅰ型胶原纤维形成因子合成减少,导致骨有机质含量降低,骨脆性增加,易发生骨折[13-15]。因此,作为骨骼支架、矿化核心和形成骨力学强度最基本的有机质蛋白,Ⅰ型胶原纤维减少,即使钙盐沉积充足,仍会造成骨强度降低,诱发骨折[16-18]。
本课题组在前期对髋、膝关节置换患者松质骨培养原代成骨细胞的基因型鉴定研究中,成功筛选出COLIA1基因-1997G/T 位点多态性存在3 种基因型——GG型(野生纯合子型)、GT型(杂合突变型)、TT型(纯合突变型)的成骨细胞株,测定出GG型、GT型成骨细胞的COLIA1mRNA表达量、Ⅰ型胶原含量、钙结节数量及细胞基质钙含量均高于TT型成骨细胞。随后构建过表达COLIA1基因的腺病毒载体,并转染到TT型成骨细胞,结果发现,经COLIA1基因的腺病毒转染后的TT型成骨细胞主要表现为Ⅰ型胶原α1链mRNA的表达水平、Ⅰ型胶原的含量、细胞基质钙含量等较未感染组有显著提高[19,20]。但是,腺病毒的过表达也可能会给身体其他部位带来危害。近年来研究表明,Tet-on系统不但能够控制基因表达,同时利用四环素衍生物强力霉素对骨组织具有较高的亲和性的特点,在基因调控系统中起到“开关”作用[21-24]。
生物力学性能增强能从侧面反映腺病毒基因治疗骨质疏松,提高Ⅰ型胶原含量,增强骨矿化和密度,使骨的抗压缩抗折弯能力增强。国外的诸多学者也证实了Ⅰ型胶原纤维与生物力学有密切关系,主要表现为其抗机械性的变化。Connizzo 等[25]通过对2型糖尿病小鼠模型肌腱的研究发现,因2型糖尿病引起Ⅰ型胶原结构改变,如不规则的纤维形态及密度等,与非糖尿病组小鼠对比,其横截面积、刚度和弹性模量均降低,说明在改变Ⅰ型胶原的含量和结构后,肌腱的机械性能和载荷发生明显的下降。Fazaeli 等[26]的研究也得到了胶原纤维能影响骨组织的生物力学的相似结论,他们通过研究猪颞下颌关节盘中胶原纤维在颞下颌关节盘机械压缩性能中的结构功能作用发现,通过消化酶分解关节盘中的胶原纤维后,关节盘的瞬时抗压模量减少多达50%~90%。此外,进一步对标本进行生化分析,胶原蛋白和黏多糖含量的下降平均分别达到14%和35%。研究者得出结论:即使轻度破坏胶原纤维,也可以导致大量的机械软化颞下颌关节盘破坏和机械稳定性下降。
本研究采用胫骨的三点弯曲试验,发现A组大鼠的生物力学指标要明显优于B、C、D 三组大鼠。其中,A组大鼠的最大负荷、弹性模量、屈服点最大应力在腺病毒转染6、8周后,高于B、C、D三组大鼠,且差异均有统计学意义。同时,micro-CT显示A组大鼠骨痂愈合的情况均优于其余三组大鼠,说明通过Tet-on调控的COLIA1基因可以有效促进大鼠骨质疏松骨折的骨痂形成、缩短骨折愈合的时间。因此,本研究证实,重组Ten-onCOLIA1基因腺病毒在骨组织靶向表达不仅能有效地增加骨折断端愈合能力、缩短骨折愈合的时间,还能有效地提高骨折愈合后的生物力学性能,达到最终治疗骨质疏松,提高骨强度的目的。
本研究仍存在一定的不足:①骨组织标本的制作及其实际操作对生物力学特性测定的结果有重要的影响,也是实验成败与否的重要步骤。因此,在标本的制作过程中,考虑到操作者的主观因素,可能会对实验结果造成偏差;②有研究认为骨质疏松骨折愈合时间长,骨痂生长较慢,再到骨折塑形可能长达12周以上,本研究转染后仅观察了8周,因此,观察的时间可能较短。
4 结论
本研究成功构建了大鼠骨质疏松骨折动物模型,将重组Tet-onCOLIA1基因腺病毒成功转染至胫骨骨折断端。在转染6、8周后,通过胫骨三点弯曲试验测定,发现经重组Tet-onCOLIA1基因腺病毒转染的大鼠,在强力霉素的作用下,能有效改善其生物力学性能,提高骨强度,最终促进骨质疏松骨折愈合。
【利益冲突】所有作者均声明不存在利益冲突
