先天性脊柱侧凸患者骨髓间充质干细胞差异表达microRNAs的鉴定分析
2022-04-06杨阳王升儒朱乾坤郭建伟林莞锋仉建国
杨阳,王升儒,朱乾坤,郭建伟,林莞锋,仉建国
先天性脊柱侧凸(congenital scoliosis,CS)是最常见的脊柱畸形类型之一[1],是指由于脊椎结构异常引发脊柱生长不平衡进而导致的脊柱侧凸[2]。文献报道CS的总患病率为活产婴儿的(0.5~1)/1000[3]。研究表明脊柱发育过程中的基因突变[4]或妊娠期的有害环境因素[5]均可导致CS的发生。目前CS的确切发病机制仍不清楚,也缺乏公认的早期诊断生物标志物。
microRNAs(miRNAs)是一系列长度为19~25 个核苷酸的短链非编码RNA[6]。miRNAs 由RNA 酶Dicer切割的较大前体产生,是mRNA的关键转录后调节因子[7]。通过与目标mRNA的3'非翻译区(3'UTR)结合,miRNAs可以促进mRNA的降解和/或抑制蛋白质翻译,从而发挥其生物学功能。据估计,miRNAs的潜在生物学作用与转录因子的5'调控区的作用相当[8,9]。大量证据表明,miRNAs可以调节广泛的生物学过程,包括细胞分化、增殖、凋亡和血液生成[10]。miRNAs的表达也与很多疾病的发生有关。研究表明miRNAs 与骨密度[11]、椎间盘退变[12]和特发性脊柱侧凸[13]等密切相关。此外,miRNAs还参与了成骨细胞、破骨细胞、软骨细胞和其他间充质细胞的调节[14-16]。因此,miRNAs很可能参与了CS的发病机制。目前关于CS患者中的差异表达miRNAs仍不明确,其表达谱仍然未知。本课题组认为,与健康人相比,CS患者骨髓间充质干细胞中存在差异表达的miRNAs,这些差异miRNAs可能为进一步探索CS的发病机制和生物标志物提供新的线索。本研究的主要目标是鉴定CS患者与健康人之间差异表达的miRNAs,并对差异miRNAs进行深入的生物信息学分析。
1 材料与方法
1.1 研究对象
本研究为单中心的病例-对照研究。
CS患者的纳入标准为:有CS的临床表现,且脊柱X线片显示脊柱侧凸超过10°;排除标准为:特发性脊柱侧凸、神经肌肉性脊柱侧凸或已知的综合征(如Alagille 综合征、Goldenhar 综合征、Klippel-Feil 综合征、脊椎软骨发育不良、脊椎胸廓发育不良等)。CS患者分为形成障碍和分节障碍两个亚组。
健康对照组受试者的种族、性别和年龄与CS组患者相匹配。其纳入标准为:无先天性畸形、神经肌肉疾病、骨骼发育不良、结缔组织异常和神经系统等疾病。
本研究经北京协和医院伦理委员会审批(批准号:JS-098),受试者(≥18 岁)或其父母(<18 岁的受试者)均签署知情同意书。
1.2 细胞培养及鉴定
经髂后上棘穿刺抽取约10 ml 骨髓,然后通过Ficoll 梯度离心分离单核细胞,在37°C、5%CO2的环境中培养骨髓间充质干细胞,培养基成分包括Dulbecco 改良的Eagle 培养基(DMEM,美国Sigma-Aldrich 公司)、10 mmol/L Hepes(美国Sigma-Aldrich公司)、100 U/ml 青霉素/链霉素(P/s,美国Gibco 公司)和10%胎牛血清(美国Gibco公司)。经过CD29、CD31、CD34、CD44、CD45、CD73 和CD105 抗体孵育后,应用FACS Calibur流式细胞仪鉴定间充质干细胞免疫表型标记物的表达(美国BD Bioscience 公司)。通过茜素红染色和油红-O染色分别评估间充质干细胞的成骨分化和成脂分化能力。
1.3 总RNA提取
使用TRIzol(美国Invitrogen 公司)提取总RNA,并使用miRNeasy 试剂盒(美国QIAGEN 公司)纯化。采用分光光度法检测RNA 纯度,光密度(optical density,OD)中OD260/OD280为0~2和OD260/OD230>1.8视为符合标准。凝胶电泳确定RNA完整性,28S/18S>2被认为符合标准。
1.4 miRNAs标记
从样本中分离RNA后,使用miRCURYTM Hy3TM/Hy5TMPower labeling kit(丹麦,Exiqon 公司)标记miRNAs。3 μl H2O体积中,取3 μg RNA与0.5 μl CIP缓冲液和0.5 μl CIP酶混合。使用PCR循环器将混合物在37°C下培养30 min。在95℃下终止反应5 min。然后,添加3 μl标记缓冲液、1.5 μl荧光标记、2 μl二甲基亚砜和2 μl标记酶,启动标记反应。16°C反应60 min,65°C孵化15 min后终止。
1.5 miRNAs阵列杂交和扫描
利用Hy3TM标记反应进行阵列杂交。25 μl标记的样品与90 μl 2×杂交缓冲液和65 μl去核酸酶缓冲液混合,95°C下避光孵育2 min,然后冰上孵育2 min。将杂交试剂在56°C 下进行反应持续16~20 h。之后在56°C 下,在缓冲液A 中反应并洗涤2 min,进一步在室温条件下在缓冲液B中清洗2 min。以200×g离心干燥载玻片5 min。使用Axon GenePix 4000B 微阵列扫描仪(美国Axon Instruments 公司)和GenePix pro V6进行扫描,提取图像原始密度。
1.6 miRNAs分析
通过前景减去背景来计算信号强度。取同一载玻片的每个探针上的4 个重复点的平均值。在计算归一化时,只计算强度>30的样本,即(前景-背景)/中值。使用R软件进行统计分析,统计方法包括未配对的Studentt检验(假设方差和正态分布相等)、WelchT检验(假设正态分布但方差不相等)或Wilcoxon检验(假设偏态分布或方差不相等)。确定差异表达miRNAs 的标准为:倍数变化≥2 或≤0.5,且P<0.05。倍数变化为CS 患者组标准化强度的平均值除以健康对照组的平均值。
1.7 生物信息学分析
使用Blast2GO 软件对差异表达的miRNAs 进行基因本体注释。绘制火山图显示总体miRNAs 和差异表达的miRNAs。对各组间差异表达miRNAs进行层次聚类分析(hierarchical clustering analysis,HCA),并构建树状图。应用KEGG数据库富集与差异表达miRNAs的靶基因相关的通路。
1.8 qRT-PCT验证
根据表达谱和和生物学功能的分析结果,本课题组从差异表达的miRNAs 列表中挑选出7 个miRNAs,使用qRT-PCR技术进行进一步验证。使用2-ΔΔCT方法分析基因表达。U6 RNA为内部对照。以P<0.05为差异有统计学意义。
2 结果
2.1 受试者的一般临床资料
如表1所示,本研究共纳入了3例形成障碍的CS患者(形成障碍亚组,均为单一半椎体畸形)和3例分节障碍的CS患者(分节障碍亚组,均为胸段脊柱分节障碍)。健康对照组纳入了5 名年龄、性别匹配的受试者。两组CS患者年龄与健康对照组比较差异均无统计学意义(P=0.401、0.829)。所有受试者均为中国北方汉族。

表1 入组受试者的一般情况
2.2 间充质干细胞培养和鉴定
光镜下观察培养的细胞均呈梭形。免疫表型鉴定表明,培养细胞的CD31、CD34 和CD45 表达呈阴性,CD29、CD44、CD73 和CD105 表达呈阳性。茜素红染色和油红-O染色证实了细胞的成骨和成脂分化能力,说明本实验分离的细胞是间充质干细胞。
2.3 CS组与健康对照组之间miRNAs的差异表达
在差异表达的候选miRNAs 鉴定过程中,差异miRNAs需要同时满足2个标准(倍数变化≥2或≤0.5,且P<0.05)。根据此标准,在形成障碍亚组与健康对照组之间共有29 个差异miRNAs,包括14 个表达上调的miRNAs 和15 个表达下调的miRNAs。在分节障碍亚组与健康对照组之间共有27个差异miRNAs,包括6 个表达上调的miRNAs 和21 个表达下调的miRNAs。在这两组显著差异表达的miRNAs之间有10个为共同出现的miRNAs(图1,表2)。
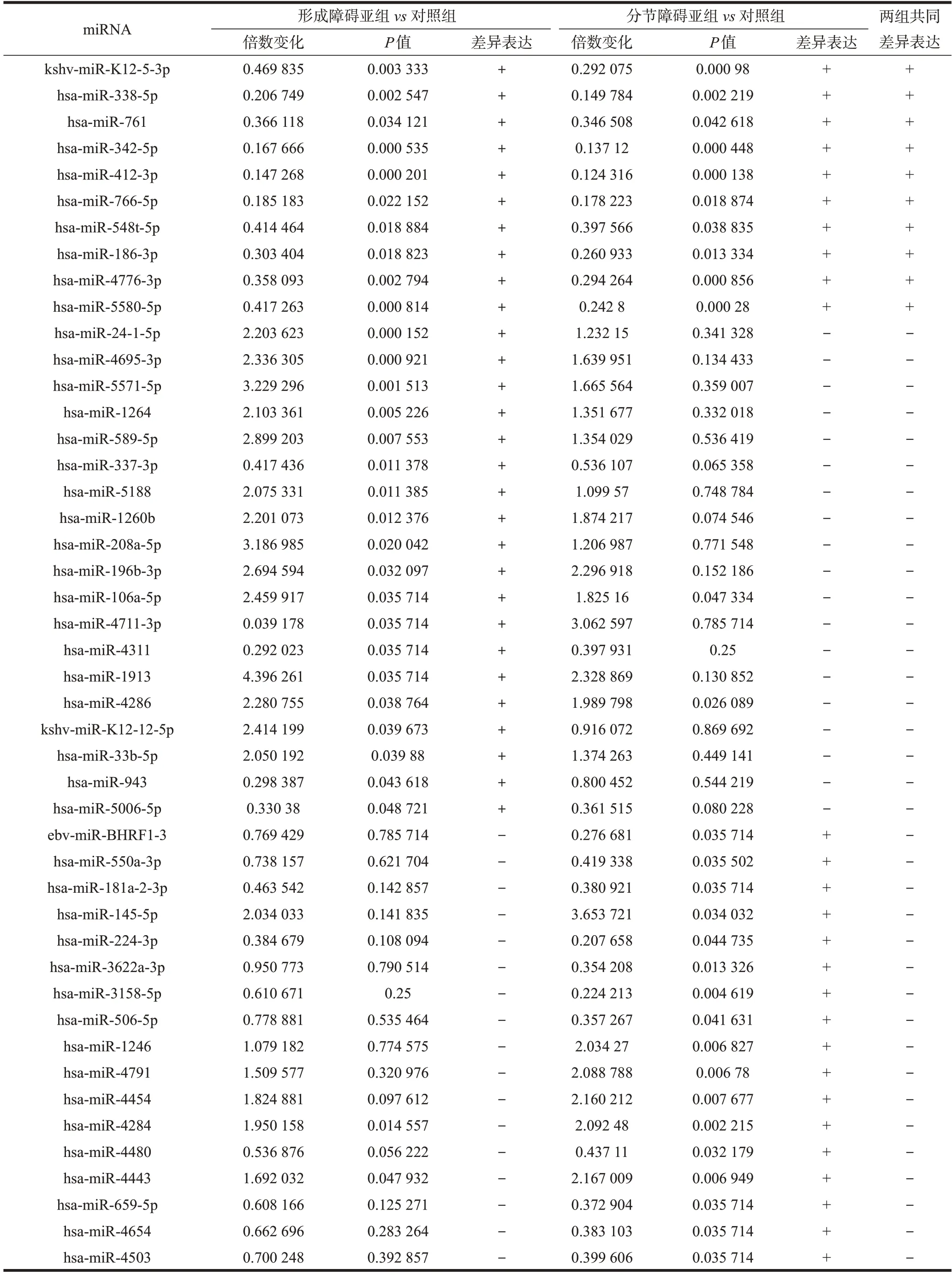
表2 形成障碍亚组、分节障碍亚组与对照组之间差异表达的miRNAs

图1 各组间总miRNAs和差异表达miRNAs的火山图
2.4 共同差异表达miRNAs的GO富集分析
为了从功能上注释差异表达的miRNAs,本研究使用Blast2GO 软件对10 个共同差异表达的miRNAs 进行了GO 富集分析。在生物过程富集中,细胞内信号转导(P=3.53E-5)、small GTPase 介导的信号转导(P=8.26E-5)和通过死亡域受体对外源性凋亡信号通路的正调控(P=8.73E-5)是最显著的富集项。在细胞成分中,高尔基体部分(P=1.01E-4)、高尔基膜(P=1.97E-4)和细胞器结合膜(P=4.26E-4)是前3个显著富集的条目。同样,蛋白质丝氨酸/苏氨酸激酶激活剂活性(P=2.70E-4)、酶结合(P=7.16E-4)和GTPase 活性(P=1.06E-3)是最显著富集的分子功能类别(图2)。
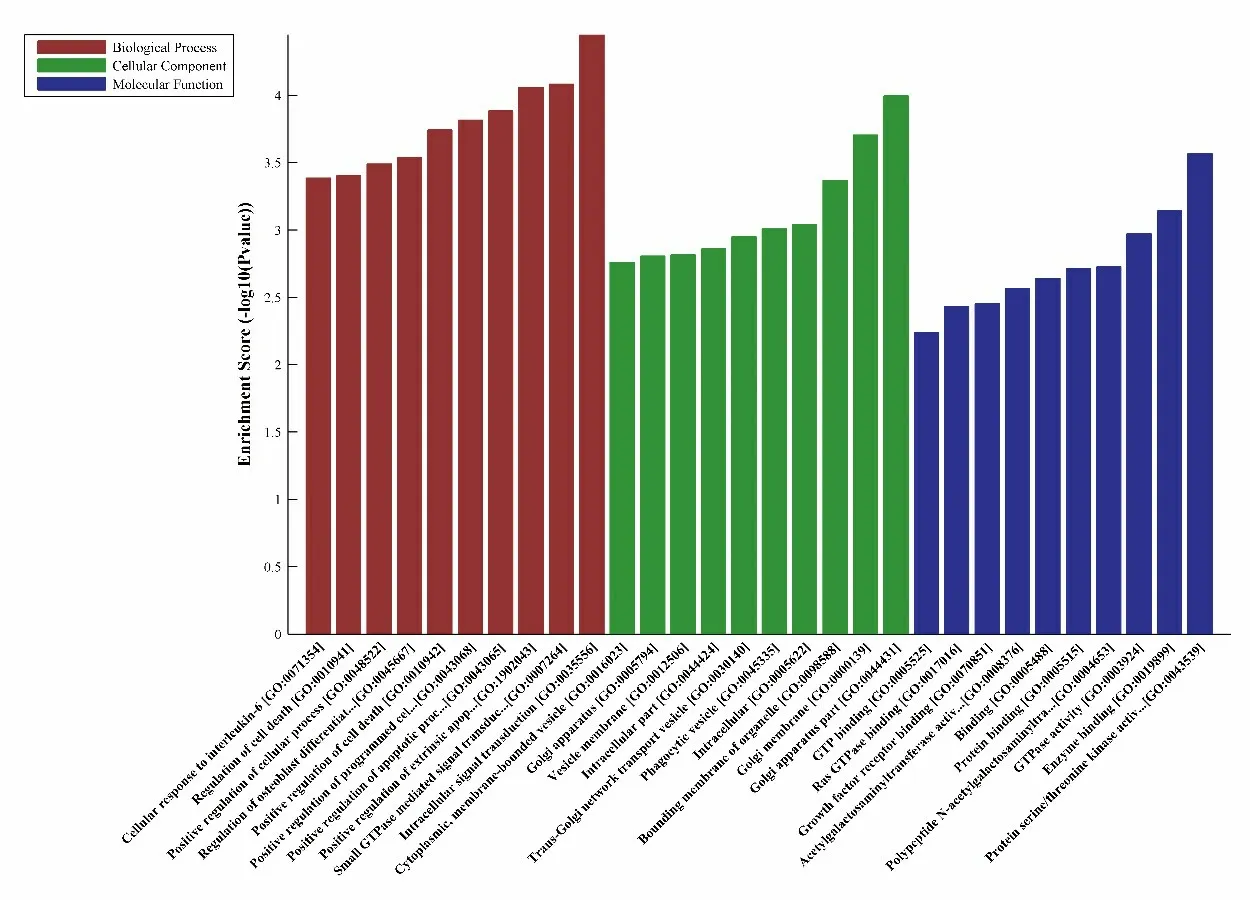
图2 使用Blast2GO进行GO富集分析
2.5 HCA
本研究进一步进行了HCA,以确定各样本间的miRNAs表达谱。结果显示健康对照组与CS两亚组之间存在明显的差异表达miRNAs(图3A、图3B)。将CS两亚组差异表达miRNAs的合集与健康对照组进行HCA,结果显示无异常分类,所有患者的分列状况和疾病状态基本一致(图3C)。此外,对10个共同差异表达的miRNAs 进行分析显示,健康对照组和CS组之间可见明显表达差异(图3D)。

图3 各组间miRNAs表达的HCA
2.6 KEGG信号通路分析
使用KEGG通路数据库寻找与10个共同差异表达miRNAs相关的基因,共涉及12条重要通路(P<0.05)。其中,最重要的信号通路涉及黏蛋白型O-聚糖的生物合成(图4)。其次是Fc-γR 介导的吞噬作用、青少年的成熟型糖尿病、癌症相关信号通路、Wnt 信号通路、凋亡、小泡运输中的SNARE相互作用、甲状腺激素信号途径、突触小泡周期、Hippo信号途径、HTLV-I感染和NF-κB信号通路。

图4 共同差异表达的10个miRNAs的靶向基因中最显著的KEGG途径
2.7 qRT-PCR验证
为了验证miRNAs微阵列芯片的分析结果,结合文献中报道的miRNAs 的相关功能,本研究选择了7个miRNAs进行qRT-PCR分析。与健康对照组相比,CS 组2 个miRNAs(miR-412-3p 和miR-766-5p)的表达显著下调(P<0.05),3个miRNAs的表达趋势与微阵列芯片分析结果一致,但差异无统计学意义(P>0.05)。另外2 个miRNAs 的表达与微阵列芯片分析的表达趋势不一致(图5)。
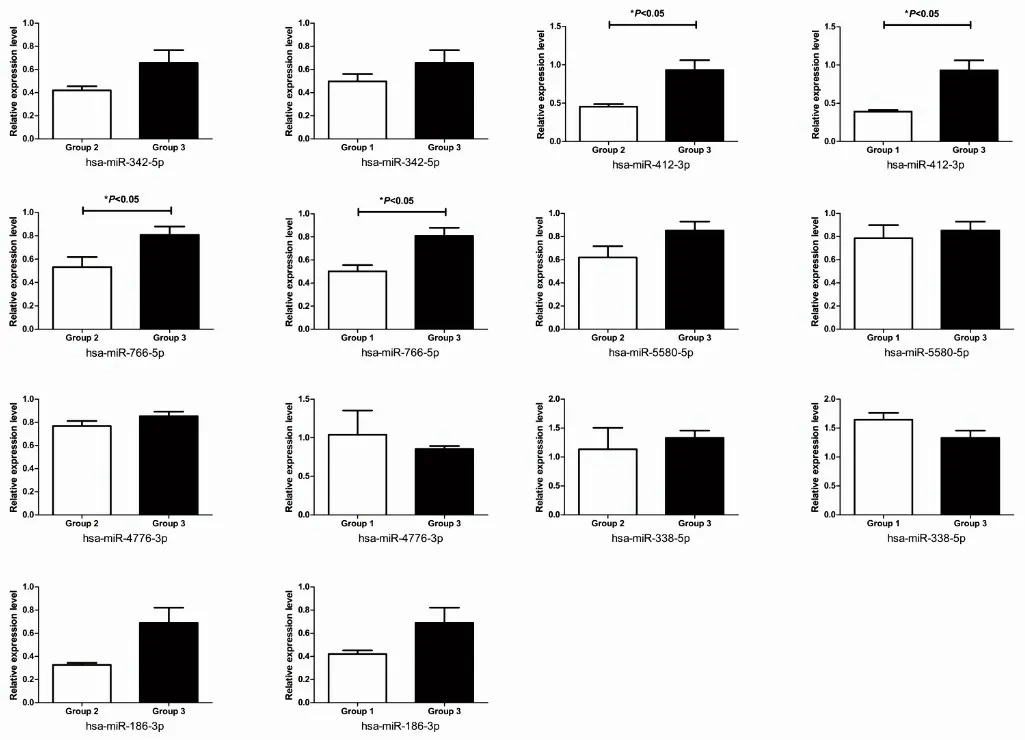
图5 CS组与健康对照组之间差异表达miRNAs的qRT-PCR验证
3 讨论
在本实验中,为了深入探索CS 的发病机制并寻找潜在的候选生物标志物,本课题组在CS患者和健康人的间充质干细胞中进行了miRNAs 表达的相关分析。CS 可分为形成障碍型、分节障碍型、混合型,其中混合型患者同时存在椎体的形成障碍和分节障碍。本研究纳入了2 个亚型的CS 患者:形成障碍型亚组及分节障碍型亚组。虽然二者都属于CS,但其临床表现仍有不同,因此本课题组认为这两亚组CS患者之间miRNAs 的表达也应该存在一定的差异。因此,在分别与健康对照组进行对比得到两亚组CS患者差异表达miRNAs(29 个miRNAsvs27 个miRNAs)后,对这两亚组CS 患者差异表达的miRNAs 取交集,得到在两亚组CS 患者中都存在差异表达的10 个miRNAs。这10 个共同差异表达的miRNAs 可代表CS 患者与健康人之间的差异,这对于分析CS的发病机制可能更有价值。
本研究的GO分析结果与CS既往报道发病机制的某些方面相一致。例如,生物过程富集的结果表明某些信号转导对CS的发病有潜在影响。有文献报道提示Notch、FGF 和Wnt 等信号通路的异常会导致胚胎期的体细胞发育障碍,从而导致脊柱畸形[17-20]。因此,信号转导可能是CS 发病中的重要生物过程。此外,在Notch 信号通路中,在高尔基体中表达的delta 样配体(DLL)3[21]与Notch 共表达时,被证明是配体诱导的Notch信号的有效拮抗剂[22]。DLL3还可促进胚胎的初级神经发生,并可在体外增强神经祖细胞的神经元分化[22]。从这个意义上讲,DLL3 在发育过程中具有重要作用,高尔基体也可能是一个新的干预靶点。在GO的其他两个分析中,蛋白质丝氨酸/苏氨酸激酶激活剂活性的分子功能也与之前的报道一致[23]。Ⅰ型丝氨酸/苏氨酸激酶受体ActRIA 的纯合突变会严重破坏小鼠胚胎中胚层的形成[23],这表明丝氨酸/苏氨酸激酶可能在CS中发挥作用。因此,丝氨酸/苏氨酸激酶激活剂活性相关的miRNA 在胚胎水平的表达值得进一步研究。
层次聚类是一种简单的算法,通过一个迭代过程来检测物体的基本距离,该迭代过程将一个对象合并(聚合方法)或分割(分裂方法),直到所有对象处理完毕[24]。本研究采用欧几里德方法进行聚类分析,该方法可以克服由极值产生的偏差[25]。结果显示CS组和健康对照组形成两个不同的集群,这表明CS患者彼此之间的数学距离较小,因此在较低的点合并,表明CS 患者具有独特的miRNAs 表达谱。通过层次聚类得到的结果可有助于构建诊断甚至预测疾病的生物标志物。
KEGG 数据库旨在通过计算已知的生物过程和标准化基因注释,将高通量基因信息与高级功能进行富集分析[26]。本研究通过对标准数据库的整理,发现黏蛋白型O-聚糖的生物合成是最显著的信号通路。黏蛋白型糖蛋白是一类由碳水化合物侧链修饰的聚糖,称为O-聚糖,可修饰蛋白质的丝氨酸(Ser)或苏氨酸(Thr)残基[27]。合成O-聚糖的第一步是添加UDP-N-乙酰半乳糖胺(GalNAc),蛋白质主链的Ser/Thr残基转化为Tn抗原(GalNAc-α-1-O-Ser/Thr)[28]。这一过程由一个名为UDP-GalNAc的多基因酶家族催化:多肽α-N-乙酰氨基半乳糖转移酶(ppGalNAcTs)。随后,根据添加的糖的不同,Tn结构的延伸可导致8种不同的O-聚糖核心结构:核心1~8[29]。大量研究表明,黏蛋白型O-聚糖在动物发育中非常重要。在果蝇中,ppGalNAcTs 酶亚型pgant35A突变是隐性致死 的[30],其潜在异常可导致呼吸系统中气管形成异常,特征是顶端和管腔O-聚糖和顶端蛋白Crbs减少[31]。与果蝇不同,迄今为止,在哺乳动物发育过程中尚未发现致命的黏蛋白型O-糖基化先天性疾病,这可能是因为O-聚糖不是哺乳动物发育所必需的,或者存在许多功能的代偿机制[32]。既往文献报道了黏蛋白型O-聚糖合成缺陷导致的几种非致命性先天性疾病。Tn综合征的临床特征为溶血或血小板减少,是由T-合酶伴侣Cosmc 对糖基转移酶酶活性的异常作用引起的[33]。IgA肾病与C1GalT1基因变异导致的O-聚糖的半乳糖苷化有关[34]。高磷血症家族性肿瘤性钙质沉着症可由编码ppGalNAc-T3的基因Galnt3[35]突变引起。此外,卵巢癌和急性冠状动脉综合征分别与Galnt1[36]和Galnt4[37,38]有关。结肠癌和结肠炎等肠道疾病与黏蛋白型O-聚糖合成失调有关[39,40]。目前尚未有相关文献报道黏蛋白型O-聚糖与CS直接相关。在骨骼研究领域,有一篇文献报道了黏蛋白型O-聚糖与骨骼疾病的关联:软骨细胞中Galnt3的过度表达可通过黏蛋白型O-聚糖的增加导致侏儒症[41]。侏儒症的部分表型与某些CS患者的表型重叠,由此推测黏蛋白型O-聚糖的合成可能部分参与CS的发病,但其确切机制仍需进一步研究。
4 结论
本研究成功构建了CS 患者与健康人骨髓间充质干细胞中的差异miRNAs 表达谱。这些miRNAs可能对CS的病因具有重要意义,并有助于探索相关诊断标志物,但后续仍需深入研究来阐明其潜在的机制。
【利益冲突】所有作者均声明不存在利益冲突
