膀胱癌新辅助免疫治疗引起免疫相关性膀胱炎二例
2022-04-05张顺丁秋播庄君龙
张顺 丁秋播 庄君龙
目前,膀胱癌的治疗多采用外科手术,结合化疗的综合治疗模式,根据疾病阶段、肿瘤位置及病人的状况来选择治疗方式。早期膀胱癌的手术治疗缓解率较高,但早期症状较为隐匿,绝大多数病人就诊并确诊时多进入中晚期,手术治疗疗效差,主要采用化疗控制病情[1-2]。尽管化疗能一定程度控制病情,但病人从现有的化疗药物受益有限。近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)通过阻断抑制性调控信号,恢复T细胞活性,增强免疫应答来杀伤肿瘤细胞[3],其中程序性死亡蛋白1(programmed death 1,PD1)是研究较为热门的ICIs,PD1是免疫系统中的免疫抑制性受体,主要分布在T细胞、B细胞表面,其配体分别为程序性死亡蛋白配体(programmed death ligand 1,PDL1)及PDL2,前者主要表达在肿瘤细胞与免疫细胞。PD1的ICIs通过阻断PD1/PDL1受体结合达到解除免疫抑制的目的。近年来,越来越多的研究显示,与单独免疫治疗相比,免疫联合化疗,即新辅助免疫治疗,具有更显著的优势,化疗可诱导抗原释放,两者联合可起到协调杀伤肿瘤细胞的作用[4-6]。新辅助免疫治疗在应用范围上较前有了一个较大的进展,从晚期膀胱癌的治疗到早期膀胱癌的术前新辅助治疗[7]。尽管ICIs已经被证明比化疗更有效且毒性更低,但临床医生仍报告了免疫相关不良事件(immune-related adverse events,IRAEs)的发生。IRAEs可发生在包括皮肤、胃肠道、肾脏、肝脏、外周和中枢神经系统、眼睛、胰腺和内分泌系统等[5-6],有轻度和重度的多种形式。因泌尿系统IRAEs较为罕见且具有一定的隐匿性,其诊断具有挑战性。在本研究中,2例接受特瑞普利单抗和吉西他滨、顺铂(GC方案)联合的新辅助免疫治疗的膀胱癌病人被诊断为免疫相关性膀胱炎。现将诊治结果报告如下。

A:PET-MRI示膀胱后壁团块影、膀胱右前下壁小结节和右侧髂外血管区肿大淋巴结,FDG代谢均增高;B:CTU示膀胱后壁3.4 cm×3.0 cm占位;C:膀胱镜检查示膀胱后壁可见陈旧性手术瘢痕,底部瘢痕旁可见一较大新生物,突出,血管丰富,表面钙化坏死,界线尚清,大小约3.3 cm×2.5 cm;D:病理活检示膀胱高级别浸润性尿路上皮癌,癌组织浸润黏膜固有层,未见平滑肌组织送检(HE,×40)
临床资料
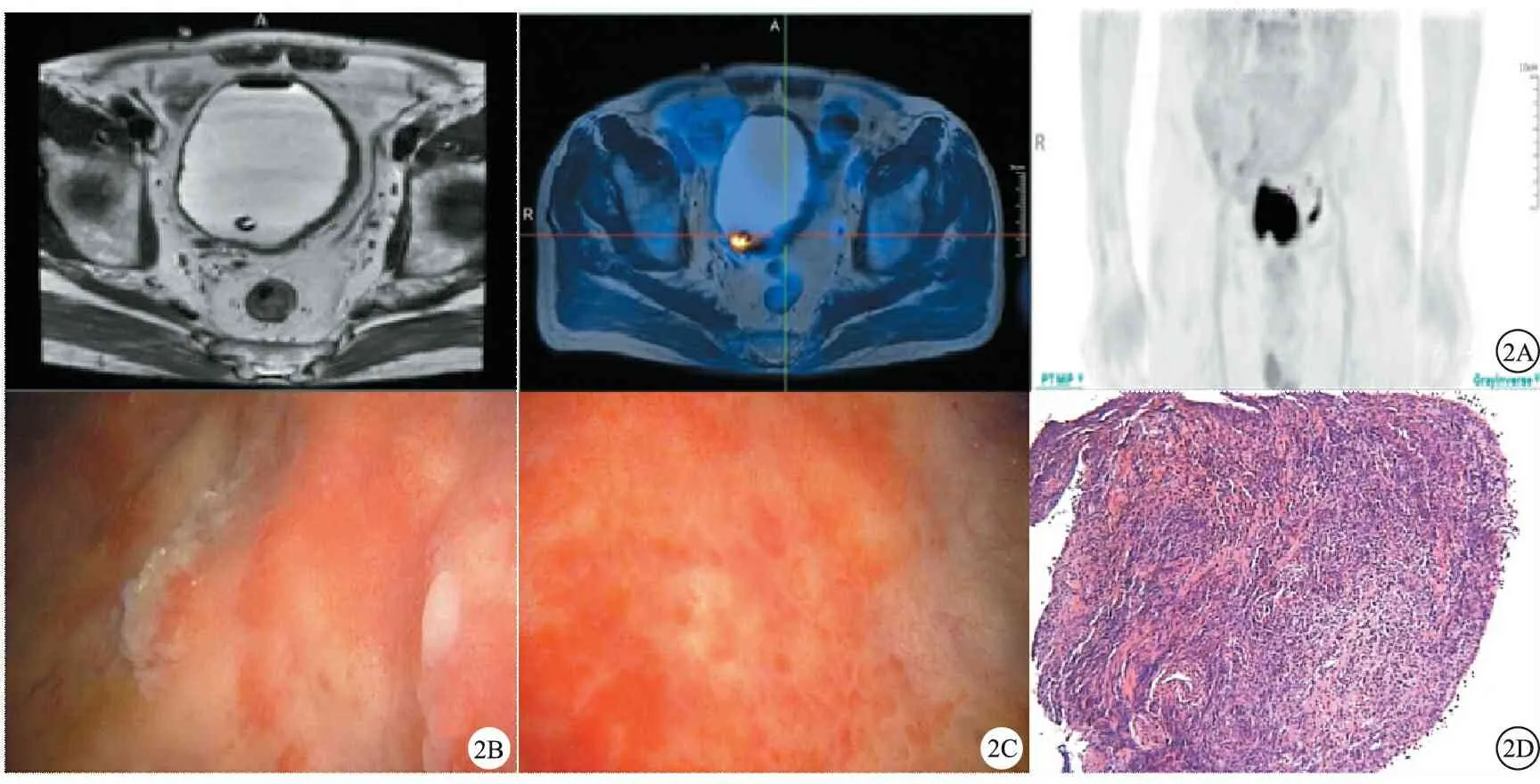
病人1,男,60岁。20年吸烟史,2020年7月因肉眼血尿2个月余转诊收入院。CT尿路成像(CTU)检查提示膀胱后壁3.4 cm×3.0 cm占位;正电子发射计算机断层显像-核磁共振成像(PET-MRI)显示:膀胱后壁团块影、膀胱右前下壁小结节和右侧髂外血管区肿大淋巴结,18F-脱氧葡萄糖(FDG)代谢均增高,考虑膀胱癌浸润肌层且有淋巴结转移;膀胱镜取肿瘤病理活检确诊膀胱高级别浸润性尿路上皮癌。临床分期为T2N1M0。见图1。
2020年7月行特瑞普利单抗和GC方案联合的新辅助治疗,21天为1个周期。2个周期后评估疗效,膀胱平扫+增强(MRI)检查显示:膀胱壁不均匀轻度增厚,考虑炎性改变可能。与图1A比较,膀胱后壁病灶明显缩小,FDG轻度代谢,原膀胱右前下壁小结节FDG代谢增高消失,右侧髂外血管区淋巴结较前明显缩小,FDG代谢未见增高,考虑治疗后改变。根据实体肿瘤指南中的评估标准[8],该病人行新辅助治疗的疗效为部分缓解(partial response,PR)。见图2。
用药3个周期,病人出现不明原因尿路刺激症状伴肉眼血尿,有持续尿道疼痛,排尿时明显,有排尿困难。尿常规检查:尿潜血(+++)、白细胞酯酶(+++)、红细胞621个/L、白细胞2 236个/L、细菌53个/L。再次重复2次尿常规检测,细菌阴性。膀胱镜检查:膀胱炎症。活检病理检查:急、慢性炎症细胞浸润。依据不良事件通用术语标准5.0版(Common Terminology Criteria for Adverse Events version 5.0,CTCAE,v5.0)[9],病人为2级非感染性膀胱炎。停用新辅助治疗,静注类固醇激素,起始剂量80 mg,5天后症状明显好转,5周内逐步减量类固醇激素。复查尿常规各指标逐渐转阴。因免疫相关性膀胱炎,病人拒绝继续新辅助治疗。2020年10月,行机器人辅助腹腔镜下根治性膀胱切除术+回肠代膀胱术,术后病理分期pT1N0M0。随访至2021年11月,病人存活,无肿瘤转移。见图2。
A:PET-MRI示膀胱右后壁及膀胱颈区不均匀增厚,FDG代谢增高,浆膜外侵犯不能除外;B:输尿管开口清晰,膀胱两侧壁、顶前壁可见弥漫性红肿,增厚,部分黏膜糜烂;C:呈新辅助治疗后改变,膀胱右后壁及膀胱颈区略厚,较前明显改善,FDG代谢较前减低;D: 乳头状高级别尿路上皮癌伴黏膜固有层浸润,肌层未见癌组织累及(HE,×40)
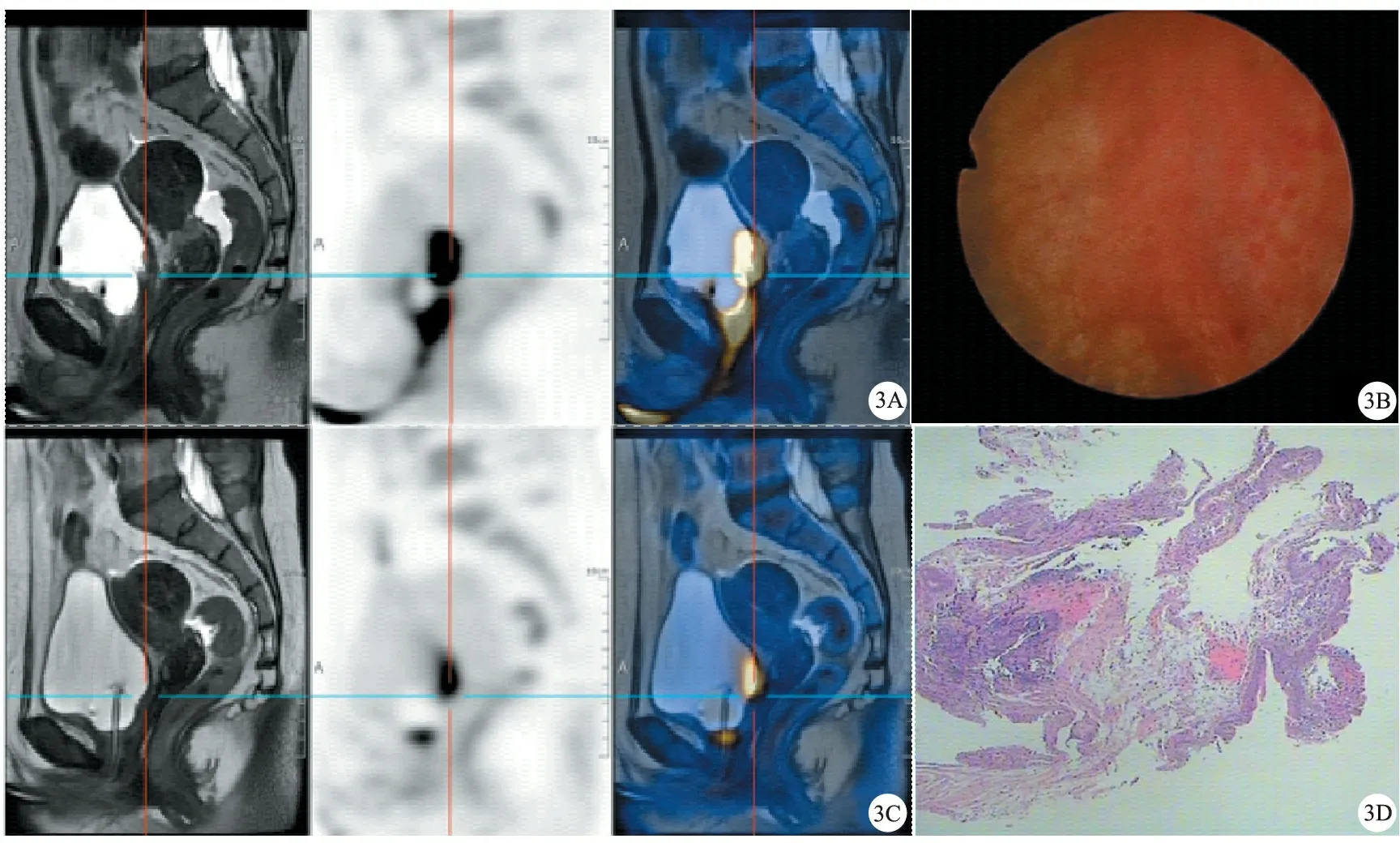
病人2 ,女,71岁。无吸烟史。2020年5月因全程无痛性肉眼血尿3次入院。CTU检查:膀胱右后壁占位。行经尿道膀胱肿瘤电切术,术后病理检查:高级别乳头状尿路上皮癌,侵犯固有层及平滑肌组织。见图3。
2020年6月行特瑞普利单抗联合GC方案新辅助治疗。2个周期,PET-MRI检查:膀胱右后壁及膀胱颈区略厚,较前明显改善,FDG代谢较前减低,治疗评估病人达到PR。见图3。
A:PET-MRI示膀胱后壁病灶较前缩小,FDG轻度代谢;B:膀胱左侧壁黏膜糜烂可见白色凸起;C:膀胱后壁,两侧壁,前壁可见弥漫性黏膜红肿,部分呈斑点状;D:黏膜组织示慢性炎症伴尿路上皮增生,局部区黏膜缺损伴肉芽组织增生及急、慢性炎症细胞浸润(HE,×40)
用药4个周期,病人出现尿路刺激症状,有下腹疼痛,有明显肉眼血尿。尿常规检查:尿潜血(+++)、红细胞321个/L、白细胞1 236个/L。膀胱镜检查:膀胱两侧壁、顶前壁可见弥漫性红肿,增厚,部分黏膜糜烂。病理组织活检:黏膜组织慢性炎症伴急性活动。依据CTCAE5.0确诊为2级非感染性膀胱炎,停用新辅助治疗,静注类固醇激素起始剂量80 mg,7天后病人症状逐渐缓解,5周内逐步减量类固醇激素。2020年9月,行机器人辅助腹腔镜下根治性膀胱切除术,术后病理检查:乳头状高级别尿路上皮癌伴黏膜固有层浸润,肌层未见癌组织累及。病理分期:pT1N0M0,随访至2021年11月,病人存活,无肿瘤转移。见图3。
讨论
目前,对免疫相关性膀胱炎还没有一个明确的诊断标准,对这种疾病的认识普遍缺乏。膀胱炎的诊断存在难度,一方面,接受免疫治疗的膀胱癌病人的早期症状不明显,容易被忽略,即使进行影像学检查,如CT/MR表现不明显,容易漏诊或误诊,另一方面,临床采用膀胱镜检查,病人的接受度较低,而进行膀胱镜检查后又做组织活检少之又少,因而获得膀胱癌发生免疫相关性膀胱炎病人的影像、膀胱镜检、活检病理完整资料较少。本中心膀胱癌新辅助治疗共入组病人30例,有2例出现免疫治相关疗膀胱炎,发生概率约6.6%,该不良反应在临床上的易被误诊为尿路感染,其发生概率可能被低估。本报告中的病人在特瑞普利单抗和GC方案联合的新辅助治疗3~4周期后发生了免疫相关性膀胱炎,主要症状是尿路刺激症状伴肉眼血尿,有持续尿道疼痛,与文献报道一致[10-11]。免疫相关性膀胱炎尿常规检查有尿红细胞和尿白细胞升高[12-13],膀胱镜检查有膀胱壁黏膜红肿或糜烂,病理检查有淋巴细胞浸润[10,13]。Ueki等[13]报道发生免疫相关膀胱炎的病理组织有CD8+T浸润、PDL-1高表达和TIA-1阳性,Zhu等[10]研究发现活检病理组织CD8+T和CD3+T细胞浸润。因此,免疫相关性膀胱炎可通过尿常规及膀胱镜检查进行确诊。
近年来,IRAEs的报道迅速增加,但迄今为止免疫检查点抑制剂引起膀胱炎罕有病例报道。在免疫治疗期间有尿路刺激症状,尿常规提示炎症性改变,排除其他病因,如细菌性膀胱炎、放射性膀胱炎及其他药物所致膀胱炎,应考虑免疫相关膀胱炎的可能。因漏诊或误诊导致膀胱炎不及时治疗可严重影响病人接受新辅助治疗的依从性,进而影响治疗效果。膀胱炎尽管有尿频、尿急、尿痛的临床症状,但常规抗感染治疗疗效不好,应尽早使用类固醇激素。本研究的病人发生了IRAEs,2级非感染性膀胱炎,即中度血尿、尿频、尿急、夜尿中度增多、排尿困难。采用类固醇激素来治疗,类固醇激素的优势除了高效消除炎症反应,而且不影响肿瘤治疗疗效[14-15]。IRAEs对类固醇激素治疗的不良反应多在2个月内出现,如胃肠道毒性、肝毒性和肺毒性[16],本研究中病人未出现类固醇激素治疗相关的不良反应,可能与免疫相关性膀胱炎诊断及时和类固醇激素逐步减量相关。
综上所述,本组2例肌层浸润的膀胱癌病人,接受特瑞普利单抗和GC方案联合的新辅助治疗取得了部分缓解,但出现了免疫相关性膀胱炎,使用类固醇后迅速改善,后期行腹腔镜下根治性膀胱切除术+回肠代膀胱术,随访1年预后较好。由此提示,从治疗角度看,放射学图像、膀胱镜和膀胱活检可提供新辅助治疗泌尿免疫相关毒性管理的相关信息,为及时制定合理的治疗方案及改善病人预后至关重要,从管理角度看,加强膀胱癌新辅助治疗的全程化管理有助于提高病人对治疗的依从性。
