VEGFR2 抑制剂阿帕替尼在肺癌中对CD8+T细胞功能影响的机制研究
2022-04-04江曼朱日飞陈雄苏美萍邱琴陶焓
江曼,朱日飞,陈雄,苏美萍,邱琴,陶焓
1.香港中文大学(深圳)医学院附属第二医院(深圳市龙岗区人民医院)肿瘤科,广东深圳 518172;2.香港中文大学(深圳)医学院附属第二医院(深圳市龙岗区人民医院)呼吸科,广东深圳 518172
肺癌是我国癌症死亡的首位病因,从2015 年至今,免疫卡控点抑制剂(immune checkpoint Inhibitors, ICI)的出现使免疫治疗成为肺癌治疗的新热点[1]。以免疫卡控点抑制剂为代表的免疫治疗,大多以提高T 细胞活力为手段,以达到抗肿瘤的目的。因此改善T 细胞的活力与功能是提高免疫治疗肿瘤的重要策略。
血管内皮生长因子(vascular endothelial growth factor, VEGF)家族及其受体参与肿瘤新生血管的生成,同时还具有很强的免疫抑制功能[2-3]。VEGF 在促进肿瘤生长的同时,又通过抑制性免疫微环境使肿瘤免疫逃逸,促进肿瘤转移。
已有不少研究尝试利用抗血管生成药物逆转免疫抑制,改善自身免疫系统的抗肿瘤能力。VEGFR2 抑制剂阿帕替尼被发现对T 细胞的活力具有调节作用,但具体分子机制尚不清楚[4-6]。经典的T 细胞活化的信号通路主要由NF-κB,AP-1 及NFAT1 等转录因子介导。其中NFAT1 的作用具有双向性,在T 细胞的活化与耗竭中都起重要作用[7-8]。目前VEGF-VEGFR2-NFAT1 信号通路的研究主要侧重于血管生成[9-10],在T 细胞的中的作用则少见报导。VEGFR2 抑制剂阿帕替尼则下调T 细胞中NFAT1 的表达,使NFAT 维持低量表达,逆转T细胞耗竭,促进T 细胞活化[11]。基于以上这些发现,本研究于2021 年1—10 月开展,探索VEGFR2抑制剂阿帕替尼在肺癌中对CD8+T 细胞功能影响的机制。现报道如下。
1 材料与方法
1.1 研究材料
1 名健康志愿者外周血;平衡盐溶液(hank's balanced salt solution, HBSS);细胞分离液(percoll)(cytiva 公司);RPMI1640 培养基;10%胎牛血清(fetal bovine serum, FBS)(Gbico);白介素-2(interleukin-2, IL-2)(北京义翘神州);CD3(上海近岸生物,OKT3);CD8+T 细胞磁选试剂盒(德国Miltenyi Biotec);流式细胞仪(BD FACS Canto);CD27 FITC,CD28-CY3,CD69-pre 流式抗体(北京义翘神州生物);高糖DMEM 培养基(Gbico);CCK8(上海碧云天);酶标仪(Tecan F50);IL-2,IFN-γ,PD-1,LAG-3,TIM-3(北京义翘神州生物),NFAT1、CLTA-4(武汉云克隆生物)。
1.2 方法
①人外周血PBMC 细胞分离和CD8+细胞与细胞鉴定:肝素钠抗凝管采集1 名健康志愿者外周血40 mL,使用HBSS 稀释1 倍,使用cytiva 公司percoll人PBMC 分离(1:1),1 500 r/min 离心15 min,取中间层细胞即为PBMC 细胞,RPMI1640 培养基加10%FBS,5%CO2细胞培养箱培养。
②T 细胞活化:6 孔板铺种PBMC 细胞,细胞浓度106/mL,每孔2 mL,采用IL-2(20 ng/mL,北京义翘神州)和CD3(100 ng/mL,上海近岸生物,OKT3)诱导,第7 天CD8+T 细胞磁选试剂盒(德国Miltenyi Biotec)分离活化T 细胞。
③流式细胞仪(BD FACS Canto)检测CD27 FITC,CD28-CY3,CD69-pre 表达(流式抗体均来自北京义翘神州生物),flowj 软件分析数据。
④CCK8 检测阿帕替尼对A549 细胞增殖的影响:A549 细胞培养采用高糖DMEM 培养基(Gbico),10%FBS(Gbico),5%CO2P/S 双抗。使用CCK8(上海碧云天)检测阿帕替尼对A549 增殖影响(100 μM,50 μM,25 μM,12.5 μM,6.25 μM,DMSO,BLANK)。具体方法:96 孔板每孔100 μl/5 000 个细胞;分别在24 h,48 h,72 h 检测细胞扩增。每孔加入10 μl CCK8,37℃孵育4 h。酶标仪(Tecan F50)450 nm 波长检测吸光值。
⑤72 h 收集上 清,ELISA 检测CD8+T 细胞 中IL-2,IFN-γ,PD-1,LAG-3,TIM-3(北京义翘神州生物),NFAT1、CLTA-4(武汉云克隆生物)表达。分为3 组,分别为对照组(A),CD8T;激活组(B),CD8T+IL-2(20 ng/mL)+OKT3(100 ng/mL);阿帕替尼组(C):CD8T+IL-2(20 ng/mL)+OKT3 (100 ng/mL)+Apatinib(3 μM)。
1.3 统计方法
采用SPSS 25.0 统计学软件对数据进行分析,计量资料经检验符合正态分布,以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 CD8+细胞与细胞鉴定
人外周血细胞中,CD8 阳性率为25%,通过磁珠分选纯化后纯度提高到90%。见图1。
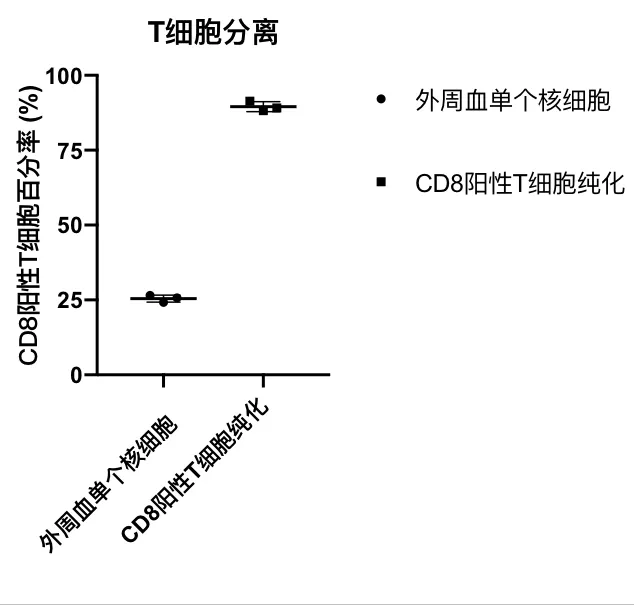
图1 纯化前后CD8 阳性率
2.2 流式细胞仪检测细胞因子表达
IL-2 和OKT3显著促进CD28的表达(72.3±6.95)%,(86.2±2.40)%,差异有统计学意义(t=-3.30,P=0.030),对CD27表达的提高(80.4±3.99)%,(86.6±1.90)%,差异无统计学意义(t=-2.43,P=0.072)。IL-2,OKT3 和阿帕替尼协同显著促进CD28(72.3±6.95)%,(96.2±1.92)%,差异有统计学意义(t=-5.75,P=0.005),CD27 的表达[(80.4±3.99)% vs (95.5±0.74)%,差异有 统计学 意义(t=-6.47,P=0.003)。3 组处理后CD69 的表达对比,[(73.2±3.40)% vs (73.0±1.90)% vs (72.5±2.63)%],差异无统计学意义(P>0.05)。见图2。
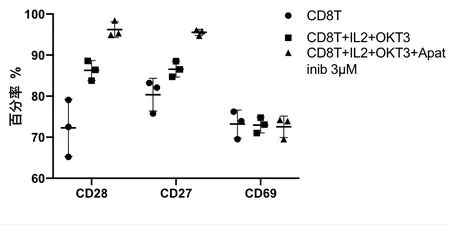
图2 流式细胞仪检测细胞因子表达
2.3 阿帕替尼对A549 细胞增殖的作用
获得24、48、72 h 这3 个时间点阿帕替尼对细胞增殖作用的数据,计算72 h 时的IC50,为后续用药提供依据,最终选择1/8 IC50 3 μM 为用药浓度观察细胞。见表1、图3。
表1 不同时间点不同浓度阿帕替尼对细胞增殖的作用(±s)
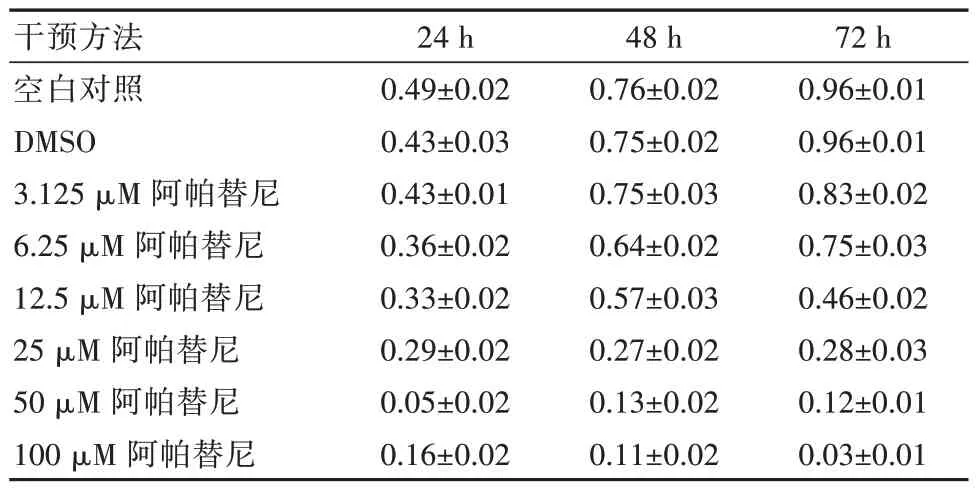
表1 不同时间点不同浓度阿帕替尼对细胞增殖的作用(±s)
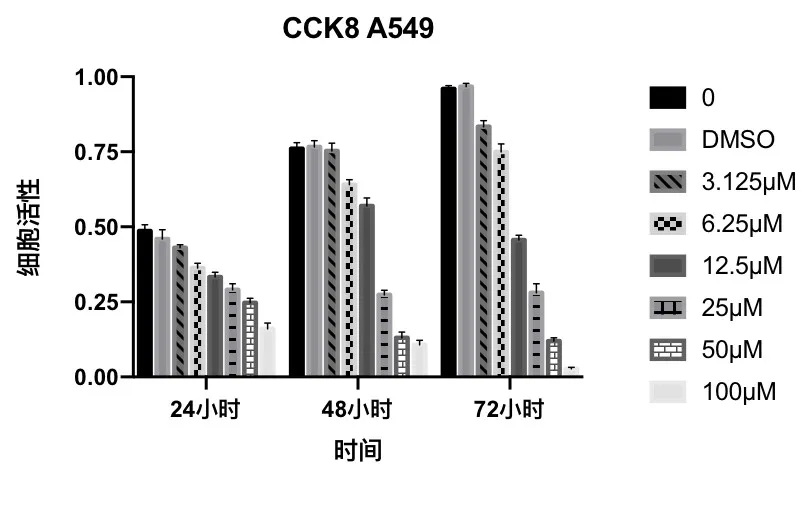
图3 阿帕替尼对A549 细胞增殖的作用
检测不同情况下CD8T 细胞对A549 的杀伤作用,IL-2 和OKT3 有助于淋巴细胞杀伤肿瘤细胞(27.6±2.23)%,(36.3±0.98)%,差异有统计学意义(t=-0.17,P=0.003)。IL-2,OKT3 和阿帕替尼协同可以显著提高杀伤肿瘤细胞的水平[(27.6±2.23)% vs (44.8±1.53)%],差异有统计学意义(t=-10.98,P<0.001)。见图4。
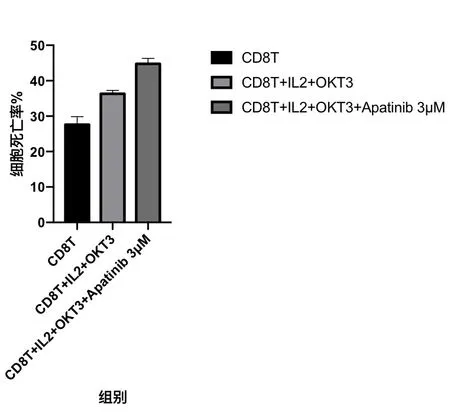
图4 CD8+T 细胞对A549 的杀伤作用
2.4 ELISA 检测蛋白表达
IL-2和OKT3促进IL-2[(6.57±2.17)pg/mL vs (18 393.76±835.670)pg/mL],INF-γ[(15.99±2.34)pg/mL vs (592.09±62.87)pg/mL]表达,差异有统计学意义(P<0.001)。IL-2,OKT3 和阿帕替尼协同促进IL-2[(6.57±2.17)pg/mL vs (22 367±1 368.69)pg/mL],INF-γ[(15.99±2.34)pg/mL vs (689.60±32.05)pg/mL]的表达,差异有统计学意义P<0.001。IL-2 和OKT3 抑 制PD-1[(41.99±6.24)pg/mL vs (24.92±1.30)pg/mL],LAG-3[(58.34±5.56)pg/mL vs (43.35±2.32)pg/mL],TIM-3[(16.62±1.7)pg/mL vs (10.64±0.59)pg/mL]表达,IL-2,OKT3 和阿帕替尼协同显著抑制PD-1[(41.99±6.24)pg/mL vs (13.03±1.71)pg/mL],LAG-3[(58.34±5.56)pg/mL vs (31.87±4.06)pg/mL],TIM-3[(16.62±1.72)pg/mL] vs (4.92±1.36)pg/mL]的表达,差异有统计学意义(P<0.05)。IL-2 和OKT3 抑制淋巴细胞表达NFAT1[(24.87±3.49)ng/mL vs (15.26±1.02) ng/m],IL-2,OKT3和阿帕替尼协同抑制NFAT1[(24.87±3.49) ng/mL,(3.53±0.87)ng/mL],差异有统计学意义(P<0.05)。见图5。
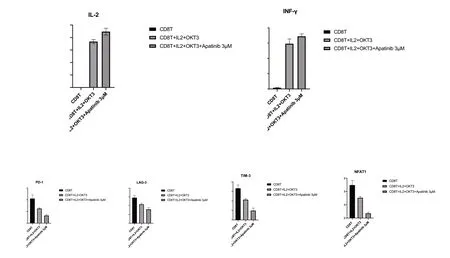
图5 ELISA 检测蛋白表达
3 讨论
ICI 的出现使免疫治疗成为肺癌治疗的新热点,尽管目前存在免疫治疗疗效预测标记不十分明确、最佳组合方式及治疗时机有待进一步探索等问题,但其在部分患者中所展现的疗效较值,证明肺癌免疫治疗的探索是进一步改善患者预后的关键所在。
恶性肿瘤免疫逃逸是复发转移的主要原因之一,具体的机制包括:肿瘤抗原表达的下降或缺失、抑制性的免疫微环境及T 细胞的老化、失能与耗竭等。T 细胞的失能以其扩增能力下降及IL-2 表达减少为主要特征;T 细胞耗竭以抑制性受体PD-1、LAG-3、TIM-3、CTLA-4、BTLA 及TIGIT 的表达上调为主要特征,同时伴随IL-2,IFN-γ,TNF-α,及granzyme B 的表达下调[12]。本研究以抗血管生成药物阿帕替尼协同IL-2 及OKT3,可以明显促进IL-2及INF-γ 的表达,抑制PD-1、LAG-3、以及TIM-3 的表达,证明这一策略可以改善T 细胞的活力与功能,是避免恶性肿瘤免疫逃逸的有效方法。
VEGF/VEGFR2 通路是促进血管生成的主要调节者。我国自主知识产权的新型抗血管生成药物VEGFR2 抑制剂阿帕替尼,能特异性结合VEGFR2,继而抑制VEGF 诱导的血管内皮细胞的迁移和增殖,降低肿瘤微血管的形成。既往研究还证实VEGF 同时还具有很强的免疫抑制功能。VEGF/VEGFR 通路可抑制效应T 细胞的分化与功能;抑制DC 的分化及活化;促进包括Treg、MDSC、TAM 等抑制性免疫细胞的募集。已有不少研究尝试利用抗血管生成药物逆转免疫抑制,改善自身免疫系统的抗肿瘤能力。对于免疫系统中主要起肿瘤杀伤作用的CD3+、CD8+T 细胞而言,抗血管生成药物主要从以下3 个方面来提高T 细胞的抗肿瘤功能:①促进血管正常化,增加T 细胞的肿瘤浸润[13-14]。②减少抑制性免疫细胞比如Treg 及MDSC 细胞的数量与局部募集[15-16]。③直接作用于T 细胞,逆转T 细胞功能耗竭。现有的研究主要侧重于抗血管生成药物的血管正常化及对抑制性免疫细胞作用,而第3 种对T 细胞的直接作用则较少报导。本研究较好地验证了阿帕替尼通过上调CD3+、CD8+T 细胞的IL-2 及IFN-γ 的表达;下调免疫卡控点抑制性分子比如PD-1、LAG-3、TIM-3 的表达,并提高T 细胞的体内外胃癌肿瘤细胞杀伤功能,逆转T 细胞的失能与耗竭,促进T 细胞的活化的作用。
经典的T 细胞活化的信号通路主要由NFκB,AP-1 及NFAT1介导。其中NFAT1的作用具有双向性,在T细胞的活化与耗竭中都起着重要作用,同时NFAT1 又是VEGFR2 通路的下游的转录因子之一。目前VEGF-VEGFR2-NFAT1 信号通路的研究主要侧重于血管生成,在T细胞的中的作用则罕见报道,本研究的结果有力地证明这一信号通路在。还有研究发现VEGF 在也可诱导T细胞内NFAT1 的大量表达,促进T 细胞的失能与耗竭,VEGFR2 抑制剂阿帕替尼则下调T 细胞中NFAT1 的表达,使NFAT维持低量表达,逆转T细胞耗竭,促进T 细胞活化。既往研究证实NFAT1的表达完全缺失可导致T 细胞的完全失能,再刺激后基本不再表达IL-2 或IFN-γ,且NFAT:AP-1复合体结合至靶基因的能力要优于NFAT 单体[17-18]。本研究同样验证了这一理论,即VEGFR2抑制剂阿帕替尼逆转T 细胞失能与耗竭的关键在于诱导NFAT1 的低量表达;NFAT1 低量表达时,主要发挥激活靶基因IL-2 表达、减少免疫耗竭失能相关的靶基因表达的作用,减少T 细胞失能与耗竭,促进T 细胞的活化。
本研究结果的意义在于:①探寻抗血管生成治疗疗效相关的关键分子,评估其临床预测作用;②探索抗血管生成药物对T 细胞功能影响的关键分子;③进一步明确T 细胞活力的影响因素,为寻找干预T 细胞活力的新靶点奠定基础,寻求提高过继性免疫细胞治疗疗效新策略;④为抗血管生成治疗与免疫治疗比如PD-1 抗体的联合应用提供理论基础。
