冻干人用狂犬病疫苗(MRC-5细胞)非临床安全性研究
2022-04-04谭小东杨世龙王丽许娜娜徐文龙周沛张艳飞周锋
谭小东,杨世龙,王丽,许娜娜,徐文龙,周沛,张艳飞,周锋
狂犬病是一种由狂犬病病毒引起的人兽共患传染病,一旦发病,病死率几乎100%[1]。接种疫苗是预防狂犬病唯一有效的方式,其中人二倍体细胞基质(如MRC-5 细胞)生产的狂犬病疫苗有着免疫效果好、副反应低、免疫持久性强的优点[2-7]。本研究根据相关指导原则要求,分别从全身主动过敏试验(研究专题代号12006-14001)、肌肉刺激性(研究专题代号12006-13004,12006-16001)、单次给药毒性(研究专题代号12006-13001)和溶血性(研究专题代号12006-13002)四个方面,评价冻干人用狂犬病疫苗(MRC-5 细胞)的非临床安全性。现将研究结果报告如下。
1 材料与方法
1.1 疫苗冻干人用狂犬病疫苗(MRC-5细胞)按照企业标准制备,检定合格后用于动物安全性评价研究,批号分别为20140101和20141104。系采用MRC-5细胞培养PM株狂犬病病毒,经灭活、纯化和冻干后制得。疫苗成品中含有人血白蛋白等赋形保护剂。
对照疫苗系市售冻干人用狂犬病疫苗(Vero 细胞,广州诺诚生物制品股份有限公司,批准文号S20083040,批号201308073-2),含有人血白蛋白等赋形保护剂。
1.2 实验动物安全性研究用清洁级新西兰白兔购自山东青岛康大生物科技有限公司[实验动物质量合格证编号分别为0021455和0025613,青岛康大生物科技有限公司签发;实验动物生产许可证号分别为SCXK(鲁)20110001 和SCXK(鲁)20160002,由山东省科学技术厅签发],SPF级Hartley豚鼠购自北京维通利华实验动物技术有限公司[实验动物质量合格证编号11400700063326,由北京维通利华实验动物技术有限公司签发;实验动物生产许可证编号为SCXK(京)2012-0001,由北京市科学技术委员会签发],SPF级ICR小鼠购自上海西普尔-必凯实验动物有限公司[实验动物质量合格证编号为2008001639387,由上海西普尔-必凯实验动物有限公司签发,实验动物生产许可证编号为SCXK(沪)2013-0016]。
本研究起止时间为2014年3月至2016年10月,试验结束时,所有存活的动物均实施安乐死。
1.3 安全性研究该研究根据国家食品药品监督管理总局(NMPA)《药物非临床研究质量管理规范》[8]、《预防用生物制品临床前安全性评价技术审评一般原则》[9]、《化学药物急性毒性试验技术指导原则》[10]和《化学药物刺激性、过敏性和溶血性研究技术指导原则》[11]要求,制定相关研究方案并执行。
1.3.1 全身主动过敏试验 取SPF 级Hartley 豚鼠共84只,称重后按其性别和体质量通过简单随机化分配步骤分为六组,每组12只动物,雌雄各半。
试验分为两个阶段,第一阶段为致敏阶段,隔日注射1 次,共给药3 次。低剂量和高剂量给药组给予冻干人用狂犬疫苗(MRC-5 细胞),每只剂量分别为不低于1.25 IU 和不低于2.5 IU,上市对照组每只不低于2.5 IU 给予冻干人用狂犬病疫苗(vero 细胞)、阳性对照组每只给予卵清蛋白2 mg、两种赋形剂对照组分别为含人血白蛋白和不含人血白蛋白。通过腹腔注射,低剂量组每只按0.5 mL 给药,其余组均按每只1.0 mL给药。
第二阶段为激发阶段。各组在末次致敏注射后第14天或第21天激发一次。通过足静脉推注给药,低剂量组按日1.0 mL给药、其余组均按日2.0 mL给药。
实验期间每天进行一次详细的动物临床观察,并根据观察结果评价动物全身致敏性情况。全身致敏性评价标准参见文献[12],分别标记为阴性“-”、弱阳性“+”、阳性“++”、强阳性“+++”和极强阳性“++++”。
1.3.2 单次给药肌肉刺激试验 取清洁级新西兰白兔,称重后按其性别和体质量通过简单随机化分配步骤分为两组,每组雌雄各2只,分别作为赋形剂对照组和给药组。
赋形剂对照组给予疫苗赋形剂(含人血白蛋白),给药组给予疫苗。赋形剂对照组和给药组每只按1.0 mL 给药体积,通过左侧股四头肌给药1 次(d0)。动物分2 次解剖检查,每组首次各剖检2 只,雌雄各半;第二次剖检余下动物。两次解剖时间分别为给药后96 h(d4)和恢复末期(d17),肉眼观察肌肉刺激反应并参照文献[13]分级,同时进行局部组织病理学检查。
1.3.3 多次给药肌肉刺激试验 分组、给药体积和注射部位按照1.3.2项方法,分别在d0、d3、d7、d14和d28给药1次,共5次。动物分2次解剖检查,每组首次各剖检2只,雌雄各半;第二次剖检余下动物。两次解剖时间分别为末次给药后96 h(d4)和恢复末期(末次给药后d17),肉眼观察肌肉刺激反应并参照文献[13]分级,同时进行局部组织病理学检查。
1.3.4 单次给药毒性 取SPF 级ICR 小鼠共60 只,称重后按其性别和体质量通过简单随机化分配步骤分为3组,每组20只动物,雌雄各半。
参考小鼠经肌内注射的最大给药容量(10 mL/kg)及供试品最大给药浓度设定本试验的高剂量,将高剂量的1/2 作为本试验的低剂量,即25 IU/kg 和50 IU/kg两个剂量水平的给药组,同时设置1个赋形剂对照组。对照组和50 IU/kg剂量组按10 mL/kg 的给药体积,25 IU/kg 剂量组按照5 mL/kg 的给药体积。左右后肢肌肉各选取1 个位点注射,两个位点注射体积相同。单次给药,观察其临床反应,监测体质量、耗食量、大体解剖、脏器重量等指标,并计算脏器重量与体质量比值、脏器重量与脑重比值。
1.3.5 溶血性试验 制备兔血红细胞用氯化钠注射液配成2%体积分数的混悬液,备用。
参照文献方法[14],设置供试品组为1-5 号管,阴性对照组为6 号管,阳性对照组为7 号管;另外增加8号管为赋形剂对照组。依次加入2%红细胞悬液、氯化钠注射液或去离子水、不同体积供试品,混匀后,立即置(37±1.0)℃的恒温培养箱中温育3 h。期间观察并记录结果。
1.4 统计学方法采用Office Excel 2016 软件统计分析,豚鼠全身主动过敏试验结果数据比较采用χ2检验,P<0.05 表示差异有统计学意义;单次给药毒性试验结果数据比较采用One way ANOVA 检验,P<0.05表示差异有统计学意义。
2 结果
2.1 全身主动过敏试验结果所有动物均存活到激发前,分组当日、首次致敏、末次致敏以及两次激发当日称重结果表明,各组雌雄豚鼠体质量均呈增长趋势。第14 天和第21 天激发结果见表1,2。从过敏反应程度和发生率来看,除不含人血白蛋白的赋形剂组未见过敏反应外,其余各组均发生不同程度的过敏症状,过敏发生率为100%。从豚鼠过敏病死率来看,第14 天或第21 天激发后,不含人血白蛋白的赋形剂对照组病死率均为0,含有人血白蛋白的赋形剂对照组病死率分别为0 和33.33%,低剂量组病死率分别为0 和50%,高剂量组病死率分别为16.67%和33.33%,上市对照组病死率分别为66.67%和83.33%,阳性对照组病死率均为100%。低剂量组、高剂量组和赋形剂对照组(含人血白蛋白)之间病死率比较,第14 天激发后组间差异无统计学意义(χ2=2.12,P=0.347),第21天激发后组间差异无统计学意义(χ2=0.47,P=0.792)。
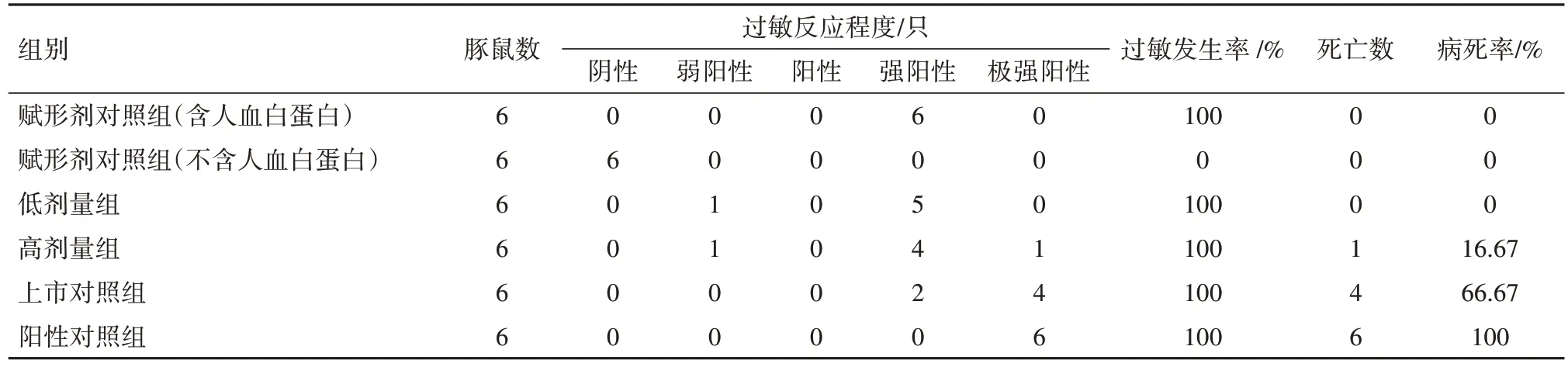
表1 豚鼠全身主动过敏试验结果(第14天激发)
2.2 单次给药肌肉刺激试验结果赋形剂对照组和给药组动物注射部位在实验期间均未见异常,刺激反应评分为0分(无明显变化)。局部组织病理学检查结果如表3 所示,给药后96 h(d4),给药组可见1 只家兔给药部位(左侧股四头肌)小灶轻微单核细胞浸润;恢复末期(给药后d17),动物左右侧股四头肌均正常。
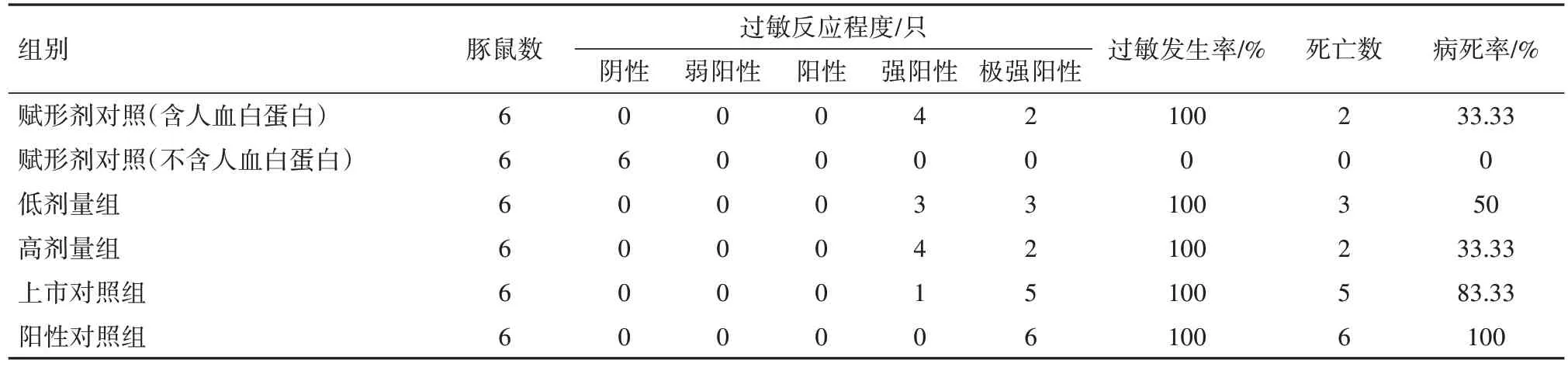
表2 豚鼠全身主动过敏试验结果(第21天激发)
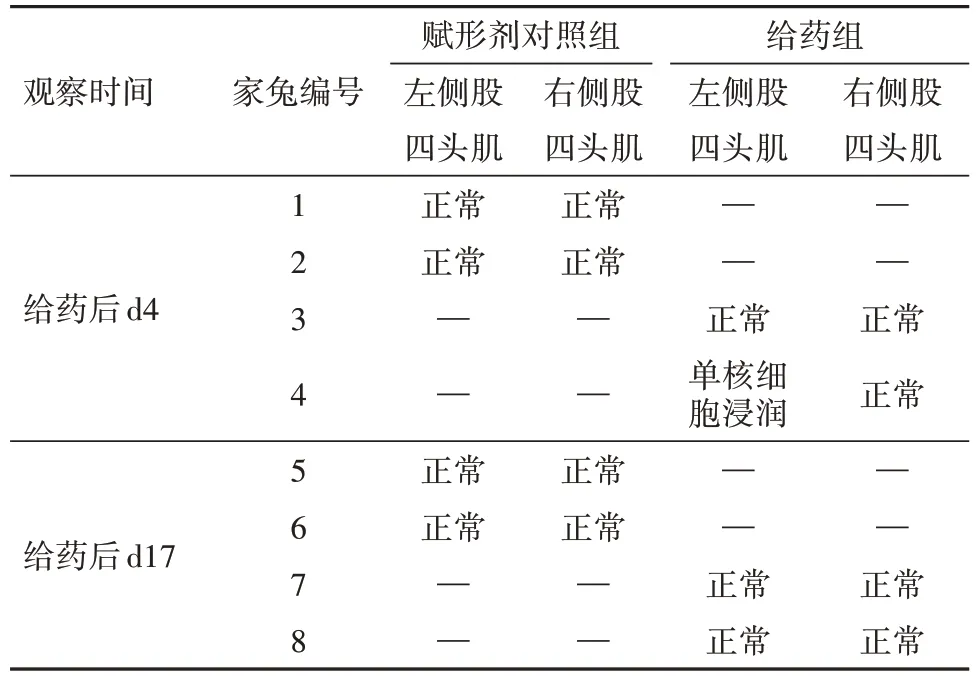
表3 单次给药兔肌肉刺激试验局部组织病理学检查结果
2.3 多次给药肌肉刺激实验结果赋形剂对照组和给药组注射部位肉眼观察未见异常,刺激反应评分为0分(无明显变化)。局部组织病理学检查结果如表4 所示,末次给药后96 h(d4),赋形剂对照组和给药组各有2只家兔给药部位出现轻度至中度单个核细胞浸润;恢复末期(末次给药后d17),给药组可见1只家兔给药部位轻度单核细胞浸润。所有动物右侧股四头肌(未给药)正常。

表4 多次给药兔肌肉刺激实验局部组织病理学检查结果
2.4 单次给药毒性实验结果实验中未见动物死亡或濒死,适应期及观察期均未见异常。给药前、给药当日、给药后1周和2周小鼠体质量结果见表5,给药前后小鼠体质量增加;且高剂量组、低剂量组和赋形剂对照组之间,无论雌性或雄性小鼠的体质量差异均无统计学意义(P>0.05),显示疫苗未对体质量增长产生影响;耗食量、大体解剖、脏器重量、脏器重量与体质量比以及脏器重量与脑重比,均未见与给予疫苗相关的异常变化。由此可见,两个剂量水平的冻干人用狂犬病疫苗(MRC-5细胞)均没有明显的毒性反应,疫苗最大耐受量(MTD)>50 IU/kg。
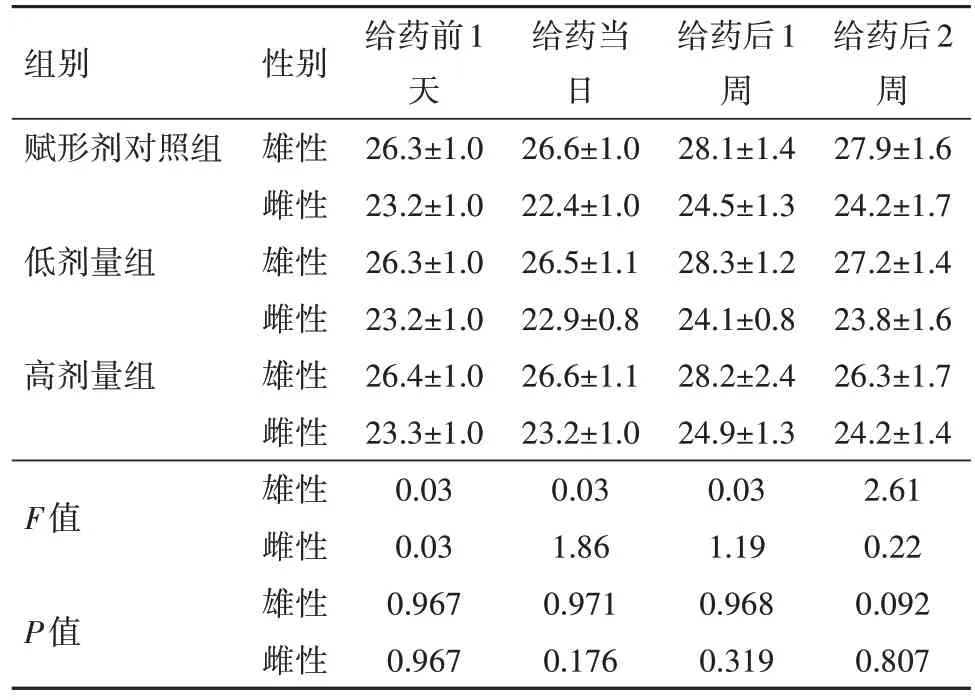
表5 单次给药毒性实验小鼠体质量变化(n=10)/(g,xˉ±s)
2.5 溶血性实验结果孵育前,除阳性对照组颜色较红有溶血现象外,其余各组试管内红细胞分布均匀;孵育期间,供试品、赋形剂对照和阴性对照组肉眼观察可见红细胞缓慢下沉,上清液体无色澄明;阳性对照组溶液颜色较红,呈澄明红色。孵育3 h 后,手动颠倒摇匀各组试管,未见棕红色或红棕色絮状沉淀,无凝聚现象发生。
3 讨论
临床使用时,疫苗中由于含外源蛋白、明胶和抗生素等,或可导致严重过敏反应[14-15]。狂犬病疫苗因为残留有经过灭活处理的人血白蛋白,以及宿主细胞蛋白质和DNA 以及残留的牛血清白蛋白等常常引起严重的过敏反应和局部刺激反应[14-17]。
疫苗保护剂中添加的人血白蛋白,因为种属关系常会引起豚鼠过敏反应,豚鼠主动过敏实验常常无法完全排除狂犬病疫苗抗原和保护剂成分潜在的过敏风险[18]。通过设立不含抗原成分的对照组,比较过敏反应程度和发生率,可以研究抗原成分是否会引起或加重过敏[19]。为此,本研究分别设置了两种赋形剂对照组。研究结果显示,疫苗组和上市对照组因在冻干保护剂中添加了人血白蛋白,从而引起豚鼠出现过敏反应。不含人血白蛋白的赋形剂组过敏反应呈现阴性,确认该疫苗过敏反应与赋形剂其他组分无关。含有人血白蛋白的赋形剂组、低剂量组、高剂量组疫苗三者相较,过敏反应程度相似、过敏发生率均为100%;三组动物病死率差异无统计学意义,因此可以判断过敏反应与疫苗抗原成分无关。人血白蛋白不会引起人体过敏反应,且疫苗中添加的人血白蛋白为市售的批签发制品,效期满足疫苗有效期,能够保证人体内使用时安全性。
考虑到现有“五针法”免疫程序可能在同一部位给药5 针[20],本研究同时设计了单次和多次给药肌肉刺激实验。多次给药肌肉刺激后,赋形剂组和给药组均出现给药侧股四头肌轻度至中度单核细胞浸润,该现象为常见的注射针穿刺造成的损伤以及机体对损伤的修复或反应性变化。对照组和给药组注射部位观察以及局部组织病理学检查均未见与疫苗相关的异常。
在本研究条件下,冻干人用狂犬病疫苗(MRC-5细胞)在豚鼠中引起的过敏症状,与疫苗抗原成分无关;单次和多次肌内注射均不会引起家兔肌肉刺激性反应;给药最高剂量50 IU/kg 时,未见明显的毒性反应;疫苗自身也不会引起红细胞溶血和凝聚。
综上所述,动物体内实验表明,采用MRC-5 细胞制备的冻干人用狂犬病疫苗具有良好的安全性。
