消水散对人胃癌小鼠腹膜移植模型B7/CD28/CTLA-4协同刺激通路及腹水微环境的影响
2022-04-04彭银花赵晔彭巍程晓燕袁晓清唐建清龚辉
彭银花,赵晔,彭巍,程晓燕,袁晓清,唐建清,龚辉
在中国,癌症发病率正呈逐年上升及年轻化趋势,腹水也是最常见的并发症,严重影响病人的生存质量,因此探究对腹水相关事件的治疗意义重大[1-2]。中医理论认为,恶性腹水治疗以温阳利水、散寒通滞为本,因肺主宣发肃降,脾主制水,肾主水,治以宣肺,实脾,温肾利水,而同调肺脾肾[3-4]。消水散以十枣汤为基础,具有泻下、逐水、消腹胀喘满、二便不利等功效,临床常用于渗出性脑膜炎、肝硬化、结核性胸膜炎等所致胸腔积液、腹水或全身水肿等疾病。本课题组前期亦对消水散治疗胃癌及腹水展开了多年研究,发现其具有抗恶性腹水、抑制瘤细胞增殖、增强T 细胞增殖活性等作用[5-6]。研究发现,肿瘤生成、生长及转移与病人先天性免疫缺陷或后天免疫失调及“免疫抑制”等状态密切相关[7-8]。而肿瘤性恶性腹水形成是否亦与腹腔微环境中存在这种免疫抑制状态有关,其与免疫细胞的相关性及相应的分子机制又是什么,尚未可知。因此,拟研究消水散对人胃癌小鼠腹膜移植导致的阳虚型恶性腹水模型的治疗作用及对腹水微环境的影响,以期揭示其作用机制,为后续腹水的治疗提供新的依据。
1 材料与方法
1.1 动物、试剂及主要仪器研究进行时间为2019年4月至2020年5月。60只同系基因型雌性SPF 级BALB/c 小鼠,近交系,6~8 周龄,体质量(20±2)g,购自湖南斯莱克景达动物实验有限公司[生产许可证编号SCXK(湘)2019-0004],饲养于湖南省中医药研究院动物中心实验室[使用许可证编号SYXK(湘)2020-0008]。本研究符合一般动物实验伦理学原则。饲养温度20~25°C,湿度50%~70%。人胃癌细胞株MGC803,由湖南中医药大学实验室提供;FBS 购自美国Gibco 公司;DMEM 培养液购自美国HyClone 公司;B7-1(CD80)、B7-2(CD86)、CD28、细胞毒性T淋巴细胞相关抗原-4(CTLA-4)抗体及二抗同型对照IgG 均购自美国Invitrogen 公司;Prime-Script ™RT reagent Kit(Perfect Real Time)、TB Green® Premix Ex Taq™Ⅱ(Tli RNaseH Plus)均购自TaKaRa 生物公司;淋巴细胞分离液购自上海爱必信生物科技有限公司;小鼠转化生长因子-β1(TGFβ1)、白细胞介素-10(IL-10)ELISA 试剂盒购自英国Abcam公司;引物由生工生物工程(上海)股份有限公司合成;医用X线诊断系统购自德国SIEMENS公司;二氧化碳培养箱购自美国Thermo Fisher公司;荧光显微镜购自日本奥林巴斯公司;FACS-Calibur流式细胞仪购自美国Becton Dikinson公司等。
1.2 消水散配置将消水散生药方打粉,用双蒸水(使用量为1 倍体积)浸泡2 h,收集药液于70 ℃水浴中蒸发浓缩,定容为100 mL,4 000 r/min,离心15 min 以去掉大颗粒杂质,取上清液浓缩至含生药1.0 g/mL 的50 mL,过滤后留药液,高温高压灭菌,0.22 μm 微孔滤器过滤除菌后,用10 mL离心管分装保存备用。
1.3 人胃癌荧光细胞株MGC803 的复苏和传代培养荧光标记的胃癌细胞系MGC803 是从恶性腹水灶中分离的细胞,具有腹腔种植的特性。常规培养于含10% FBS 和G-418(0.75 g/L,用于筛选稳定表达荧光的细胞)的DMEM 培养液中,置于二氧化碳体积分数为5%、37 ℃饱和湿度的培养箱中培养传代。取对数生长期的MGC803 细胞株以0.25%胰酶消化,DMEM 培养液终止消化后,制成细胞悬液,1 000 r/min 离心4 min 后重悬于PBS 中。用锥虫蓝染色测定细胞存活率,发现细胞存活率>98%。
1.4 造模及分组造模前1 周将人胃癌细胞株MGC803 进行复苏和传代培养,造模当天对培养瓶中贴壁生长的细胞用胰酶消化,收集细胞悬液,离心后将沉淀细胞用PBS 液洗2 遍后计数,配制成2×107/mL 的细胞悬液,造模前置于冰上备用。造模开始,首先按200 mg·kg-1·d-1剂量将腺嘌呤制成混悬液0.2 mL,定时、定量、定人给小鼠灌胃,每日1 次,连续21 d。小鼠逐渐出现畏寒喜暖、反应迟钝、蜷缩、拱背、消瘦、多尿、大便稀溏、少食、少动萎靡等现象,类似“阳虚”状态,随机取10只阳虚模型,眼球取血检测肾上腺皮质激素(ACTH)、皮质醇(CORT)、三碘甲状腺原氨酸(T3)、甲状腺素(T4)、促甲状腺激素(TSH)含量明显低于正常小鼠(P<0.05),表示阳虚模型建立成功。阳虚小鼠麻醉后,75%乙醇前胸壁消毒,用手触及心尖搏动最明显处,约于胸骨左旁3 mm 第二肋间,瞄准正中垂直进针,深度约0.5 cm,进针角度与小鼠腹面正中线呈45°,与皮肤呈30°。缓慢回抽,若能看到有鲜红的血液抽出,则表示针已进入左心室,将MGC803细胞悬液0.2 mL(0.4×106个胃癌细胞)慢慢推入后,迅速拔针,用棉球稍压针孔少许,接种完成。建模后在X线片下观察腹水的出现并行体表标记。
实验分组:对照组、模型组、消水散低剂量组、消水散中剂量组、消水散高剂量组,每组10 只。以消水散临床剂量为低剂量,消水散低、中、高剂量组分别于造模后第2 天给药7.8 g·kg-1·d-1、15.6 g·kg-1·d-1、23.4 g·kg-1·d-1,每天分2次给药,连续30 d。
1.5 行为学观察实验过程中观察各组小鼠精神状况,从阳虚造模第二周开始,参照相关文献[9]及阳虚证小鼠症状量化积分表,评价各组小鼠阳虚症状积分,见表1。

表1 阳虚证小鼠症状量化积分表
1.6 ACTH、CORT、T3、T4、TSH 含量测定随机抽取10 只阳虚小鼠,小鼠用5%水合氯醛100 μL 进行腹腔麻醉后固定头部,并轻轻向下压迫颈部两侧造成头部静脉血液回流困难,使眼球充分外突,摘眼球取血,电化学发光法检测促ACTH、CORT、T3、T4、TSH含量,评估阳虚模型质量。
1.7 腹腔X 线摄片观察腹水腹腔内注射后的第15、22、31 天,经10%水合氯醛麻醉,在X 线下摄像观察腹水生长情况。并于第31 天统计腹水量。无菌条件下开腹,无菌吸管收集腹水于离心管中,计算腹水平均体积。
1.8 测定原位瘤体积及称重用游标卡尺量取原位肿瘤长宽径及高度,根据肿瘤体积计算方法V=πabc/6(a 为长径,b 为宽径,c 为高)计算出原位肿瘤体积。给药结束处死小鼠后剥取原位瘤称质量。
1.9 循环血液中B7-1、B7-2、CD28及CTLA-4含量测定各组小鼠摘眼球取血抗凝,添加淋巴细胞分离液分离外周血单个核细胞(PBMC),PBS洗涤后分别添加纯化的单克隆抗体B7-1、B7-2、CD28、细胞毒性T 淋巴细胞相关抗原4(CTLA-4)各10 μL,充分混匀后置于4 ℃冰箱孵育45 min,洗涤细胞后离心弃上清,分别添加各自FITC 标记的荧光二抗20 μL,4 ℃冰箱避光孵育30 min,离心弃上清,添加200 μL稀释液,采用流式细胞仪检测B7-1、B7-2、CD28 及CTLA-4表达水平。
1.10 腹膜组织中B7-1、B7-2、CD28 及CTLA-4 mRNA 水平检测实验结束后,无菌环境下抽取腹水,并剥离小鼠皮肤,分离周围组织,然后将小鼠腹膜游离后去除附着肌肉组织,置于液氮保存备用。提取腹膜组织总RNA 后进行反转录合成cDNA,采用实时荧光定量PCR(RT-qPCR)扩增B7-1、B7-2、CD28及CTLA-4 mRNA目的片段。20 μL反应体系:TB Green Premix Ex Taq Ⅱ(2×)10 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA(50 ng/μL)2 μL,正反向引物(10 μM)各0.8 μL,双蒸水6.0 μL。反应条件为:95 ℃、30 s;95℃、5 s;61℃、31 s,40 个循环。B7-1、B7-2、CD28 及CTLA-4 及内参GAPDH 引物序列见表2。采用2-ΔΔCt法定量分析腹膜组织中B7-1、B7-2、CD28及CTLA-4 mRNA相对表达水平。
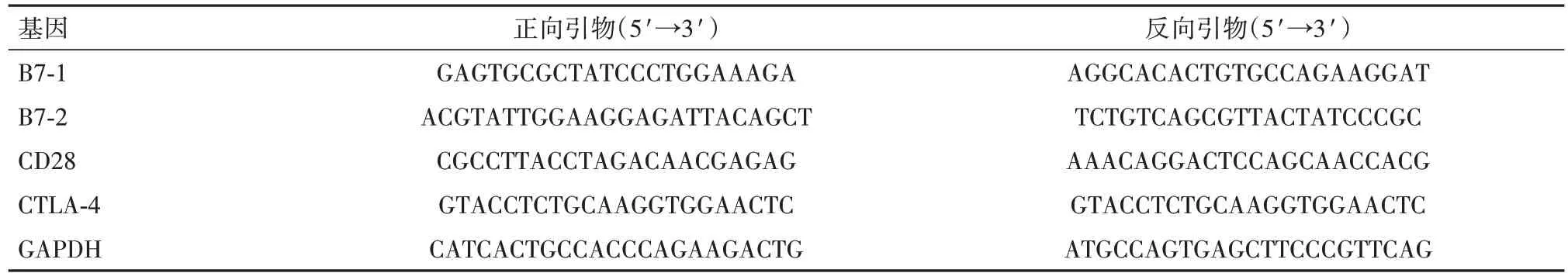
表2 RT-qPCR引物
1.11 腹膜组织中TGF-β1、IL-10 表达水平检测以1∶10 制备腹膜组织匀浆液。采用酶联免疫吸附试验(ELISA)检测腹膜组织中TGF-β1、IL-10表达水平,具体步骤严格按照试剂盒说明书进行。
1.12 统计学方法采用SPSS 25.0 软件进行统计学分析。计量资料采用表示,两组数据比较采用成组t检验,多组数据比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠阳虚症状积分、血清ACTH、CORT、T3、T4、TSH 含量比较体质特性能够通过相关生物学指标呈现,阳虚症小鼠的下丘脑-垂体-肾上腺轴呈抑制状态,主要表现为ACTH、CORT 含量的下降;下丘脑-垂体-甲状腺轴亦呈抑制状态,主要表现为T3、T4、TSH 含量的下降。本研究结果显示与正常小鼠比较,模型小鼠阳虚症状积分显著增加,血清ACTH、CORT、T3、T4、TSH 含量显著降低(P<0.05),见表3。
表3 小鼠阳虚症状积分、血清ACTH、CORT、T3、T4、TSH含量比较/

表3 小鼠阳虚症状积分、血清ACTH、CORT、T3、T4、TSH含量比较/
注:ACTH为肾上腺皮质激素,CORT为皮质醇,T3为三碘甲状腺原氨酸,T4为甲状腺素,TSH为促甲状腺激素。
2.2 各组小鼠腹水量、瘤体积及瘤重比较与模型组比较,消水散低、中、高剂量组小鼠腹水量、瘤体积、瘤重依次减少(P<0.05),见表4。
表4 各组小鼠腹水量、瘤体积及瘤重比较/

表4 各组小鼠腹水量、瘤体积及瘤重比较/
注:①模型组比较,P<0.05。②与消水散低剂量组比较,P<0.05。③与消水散中剂量组比较,P<0.05。
2.3 各组小鼠腹膜组织中TGF-β1、IL-10表达水平比较与模型组比较,消水散低、中、高剂量组小鼠腹膜组织中TGF-β1、IL-10 表达水平依次降低(P<0.05),见表5。
表5 各组小鼠腹膜组织中TGF-β1、IL-10表达水平比较/(pg/g,)
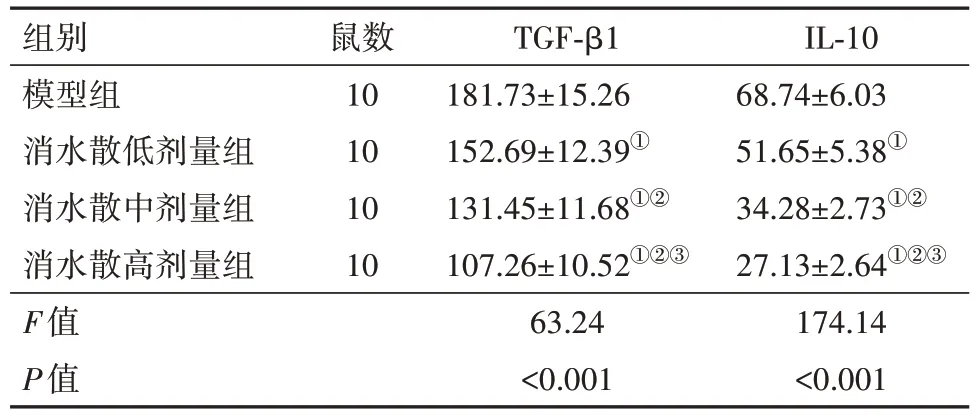
表5 各组小鼠腹膜组织中TGF-β1、IL-10表达水平比较/(pg/g,)
注:TGF-β1为转化生长因子β1,IL-10为白细胞介素10。①与模型组比较,P<0.05。②与消水散低剂量组比较,P<0.05。③与消水散中剂量组比较,P<0.05。
2.4 各组小鼠循环血液中B7-1、B7-2、CD28及CTLA-4 含量比较治疗癌性腹水需增强T 细胞免疫活性,B7-1 和B7-2 表达于活化的抗原递呈细胞表面,该细胞参与T 细胞的激活。CTLA-4 可以与CD28 竞争结合B7-1 和B7-2,阻断CD28 的T 细胞激活通路。本研究结果显示,与模型组比较,消水散低、中、高剂量组小鼠循环血液中B7-1、B7-2、CD28含量依次增加,CTLA-4 含量依次降低(P<0.05),见表6。
表6 各组小鼠循环血液中B7-1、B7-2、CD28及CTLA-4含量比较/

表6 各组小鼠循环血液中B7-1、B7-2、CD28及CTLA-4含量比较/
注:CTLA-4为细胞毒性T淋巴细胞相关抗原4。①与模型组比较,P<0.05。②与消水散低剂量组比较,P<0.05。③与消水散中剂量组比较,P<0.05。
2.5 各组小鼠腹膜组织中B7-1、B7-2、CD28及CTLA-4 mRNA 水平比较与模型组比较,消水散低、中、高剂量组小鼠腹膜组织中B7-1、B7-2、CD28 mRNA 依次增加,CTLA-4 mRNA 依次降低(P<0.05),见表7。
表7 各组小鼠腹膜组织中B7-1、B7-2、CD28及CTLA-4 mRNA比较/
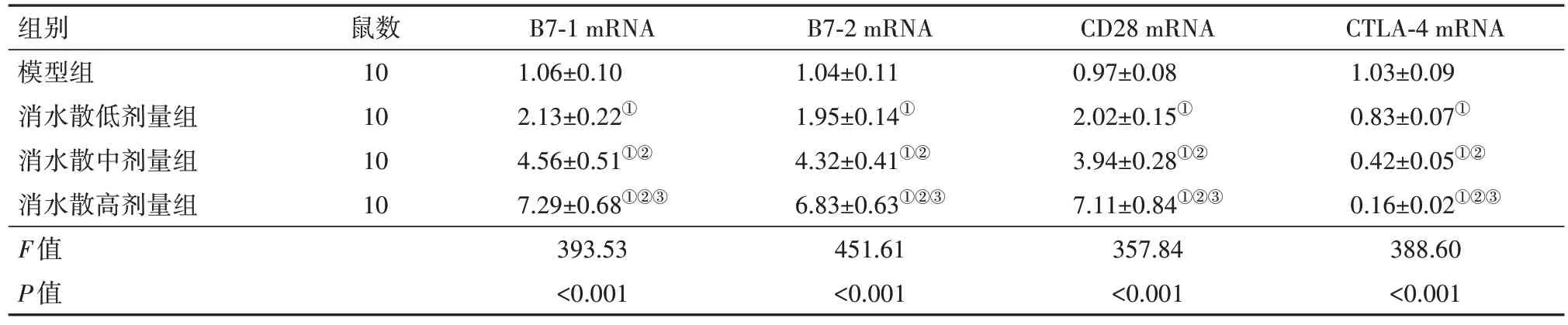
表7 各组小鼠腹膜组织中B7-1、B7-2、CD28及CTLA-4 mRNA比较/
注:CTLA-4为细胞毒性T淋巴细胞相关抗原4。①与模型组比较,P<0.05。②与消水散低剂量组比较,P<0.05。③与消水散中剂量组比较,P<0.05。
3 讨论
腹水属中医“臌胀”范畴,病位在气血,病机根本为肝脾肾失调,气滞血结,水停腹中。“阳气失于敷布,阴寒得以凝聚”是肿瘤的基本病因病机[10-11]。因此本研究首先通过给小鼠灌胃腺嘌呤制备阳虚模型,结果显示,阳虚症状积分显著增加,血清ACTH、CORT、T3、T4、TSH 含量显著降低,提示阳虚小鼠制备成功[12]。进一步对阳虚小鼠进行人胃癌细胞株MGC803腹腔注射制备阳虚胃癌性恶性腹水模型,造模31 d 后发现,模型组小鼠腹围增大,腹水量显著增加,提示胃癌性腹水模型制备成功,可用于后续试验。临床治疗癌性腹水主要以扶正为本,即通过“扶正(温阳)”可达到“驱邪(散寒)”之功,通过改善腹腔免疫失常微环境,以提高肿瘤浸润淋巴细胞(TILs)、调节病人免疫平衡的功能,达到抗恶性肿瘤细胞消水的作用。消水散全方:芫花(熬)、甘遂、大戟各等分取1 g,大枣10 g、蝼蛄10 g、蟋蟀10 g、腹水草9 g、蜣螂10 g。本方以十枣汤为基础,主治悬饮,咳唾胸胁引痛,心下痞硬,干呕短气,头痛目眩,胸背掣痛不得息,舌苔白滑,脉沉弦;还具有攻逐水饮、消肿、利便之功效。另加入蝼蛄10 g、蟋蟀10 g、腹水草9 g、蜣螂10 g 加强消水之效果,疗效显著。有文献报道,温阳消水方外敷后可缓解癌性腹水方面,与西药利尿剂临床疗效相当,同时可减少因反复利尿造成病人耐药情况及电解质紊乱的风险,提高癌性腹水病人生活质量[13]。本课题组前期研究发现,阳虚寒凝为恶性腹水瘤常见症候之一。本研究结果显示,与模型组比较,消水散可呈剂量依赖性降低小鼠腹水量、移植瘤体积及质量,与文献报道及前期结果一致,提示消水散可有效治疗移植性恶性腹水,抑制移植瘤生长。
中医认为“正气存内,邪不可干”,“正虚(阳虚)”是肿瘤发生发展之根本,癌毒侵袭为“病邪之本”,“阳化气,阴成形”,正邪相互抗争,导致肿瘤发病。邪毒不断壮大,又会加重正气亏虚,为肿瘤的转移提供条件[14-15]。西医Paget 经典的“种子与土壤”学说与中医“正虚”理论不谋而合,即癌毒作为种子的恶性肿瘤细胞侵袭机体是发病外因,造成阳虚形成及腹腔微环境中形成的免疫抑制状态,加重疾病进展[16]。近来中药治疗癌性腹水研究表明,改善病人免疫功能抑制状态、唤醒T 细胞免疫活性对改善肿瘤病人预后及疗效至关重要[17]。B7 是免疫球蛋白超家族成员,以B7-1(CD80)、B7-2(CD86)两种单体形式表达于多种活化的抗原递呈细胞表面,该细胞参与T 细胞增殖、分泌细胞因子及抗体等过程。CTLA-4 与CD28 竞争结合B7 家族分子,阻断CD28 与B7 的信号传导通路,防止CD28 分子促进T细胞激活。近来随着对B7/CD28/CTLA-4 共刺激途径的研究不断深入,大量学者发现,抗CTLA-4 可有效用于肿瘤的靶向治疗[18]。本研究结果发现,消水散可呈剂量依赖性增加B7-1、B7-2 及CD28 表达,降低CTLA-4 表达,提示消水散可能通过抑制CTLA-4表达,缓解免疫抑制状态,改善人胃癌腹膜移植小鼠恶性腹水,抑制移植瘤生长。另有研究显示,免疫逃逸是通过促进Treg 细胞及其分泌细胞因子TGF-β1、IL-10 表达发挥免疫抑制作用,促进恶性肿瘤进展[19-20]。为探究消水散对腹腔免疫微环境的作用,本研究进一步检测腹膜组织中TGF-β1、IL-10 表达,结果发现,消水散可呈剂量依赖性降低恶性腹水小鼠腹膜组织中TGF-β1、IL-10 表达,提示消水散可能通过抑制CTLA-4 表达,抑制其对Treg 细胞的趋化作用,对抗恶性腹水、改善机体免疫微环境,发挥抗肿瘤作用。
