蛋白质组学在肉类真实性鉴别中的应用研究进展
2022-04-01张颖颖康超娣张明悦王娟强赵文涛李莹莹
张颖颖,康超娣,张明悦,王娟强,赵文涛,李莹莹
(北京食品科学研究院,中国肉类食品综合研究中心,北京 100068)
结合现代分析手段的蛋白质组学技术能够分析复杂生物样本中存在的数千种蛋白及多肽[1]。近年来,蛋白质组学主要以寻找多肽标记物为目标[2],借助当前的质谱技术以及生物信息学手段,通过筛选、鉴别、验证等步骤,获得物种、组织和/或蛋白质中的特异性肽段,在食品真实性分析、产地溯源、生物医药等方面开辟了新的研究领域[3-4](图1)。
肉类掺假是全球关注的热点问题[5],不仅影响肉类行业的健康发展,侵犯消费者的权益,而且还会对消费者的健康[6]、饮食[7]、宗教[8]及生活方式等方面产生一系列的影响;因此,建立快速、高效、准确的肉类掺假鉴别技术对于保障肉品真实性显得尤为重要。目前,常见的肉类真实性鉴别方法主要是以DNA和蛋白质(或多肽)为分析对象的检测方法。基于DNA的检测方法主要包括聚合酶链式反应(polymerase chain reaction,PCR)、基因测序技术、基因芯片技术等,基于蛋白质的检测技术主要包括酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)和质谱技术等。其中,PCR技术易受DNA降解和复杂基质的影响[9-10];ELISA技术易出现交叉反应、假阳性以及热加工肉制品蛋白易变性等问题[11-12],而基于蛋白质组学的质谱技术能有效地避免上述检测技术的弊端,尤其是在应对复杂基质干扰和假阳性方面表现出较高的灵敏度及准确性。因此,蛋白质组学技术逐渐被应用于肉类食品的真实性鉴别领域[13]。本文综述了蛋白质组学在肉类食品真实性鉴别中的研究进展,以期为肉类食品质量安全控制提供新思路。
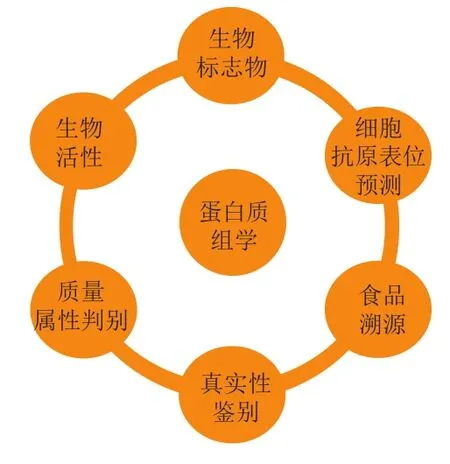
图1 基于质谱技术的蛋白质组学的应用领域Fig. 1 Fields of application of proteomics based on mass spectrometry
1 蛋白质组学在肉类真实性鉴别领域的主要研究方法
1.1 蛋白质组学的研究流程
蛋白质组学的研究流程主要包括样品的前处理、多肽分离、多肽标记物的筛选及鉴别[14]。图2总结了当前在真实性鉴别研究领域中基于蛋白质组学方法的基本分析流程。根据不同的分析技术及酶解方式,可分为3 种分析流程。第一种是蛋白质先经双向凝胶电泳(twodimensional gel electrophoresis,2-DE)分离后,目标蛋白质在胶内酶解成多肽,经质谱分析,得到多肽质量指纹图谱(peptide mass fingerprint,PMF);第二种是蛋白质提取液直接酶解成肽段,经质谱采集数据,结合专业软件分析谱图可获得蛋白及多肽信息;第三种是样品用溶剂提取后无需酶解,采用互补沉淀和色谱技术等多种手段相结合的方法分离多肽,再经质谱技术对肽段进行分析鉴定。其中,第二种方法由于前处理过程相对简便,结果更为准确可靠,从而获得更多青睐。
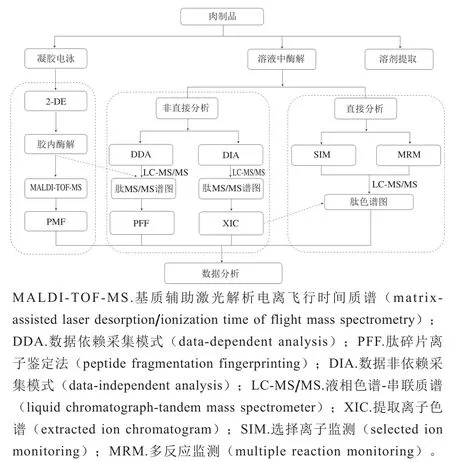
图2 蛋白质组学的研究流程分析图Fig. 2 Analytical workflow for proteomics
1.2 物种特异性多肽的筛选
1.2.1 物种特异性多肽的提取
找寻物种的靶标多肽是蛋白质组学研究的关键步骤,但肉制品加工方式多样,基质十分复杂,目标多肽浓度范围宽泛,因此选择适宜的提取方式至关重要。
目前,常用的提取方式主要包括将样品与含有不同添加物(pH值调节剂、还原剂、烷基化试剂)的提取缓冲液,采用均质混匀、剧烈振荡/涡旋,或是采用超声波技术[15-16]等方式辅助以提取多肽。为了提高多肽的提取率,von Bargen等[17]评估了11 种提取缓冲溶液,并结合了不同的提取方式(剧烈振荡/涡旋/均质机均质),以研究蛋白提取效率,在这项研究中,采用6 mol/L尿素、1 mol/L硫脲和50 mmol/L Tris-HCl的提取缓冲液(pH 6)得到最佳的蛋白提取效果。在提取过程中,为降低样品的复杂性,研究人员提出了分级分离方法[18-20],其中,2-DE是公认的蛋白分离效率较高的分离技术,在肉类真实性鉴别研究中,主要用于分离蛋白,便于后续胶内酶解、质谱分析,该方法易实现不同肉类中单一蛋白的多肽组成分析,从而能够找出该蛋白的多肽序列在不同物种中的差异,利用这些差异性的肽段实现对不同肉类的真实性鉴定[20]。Montowska等[21]采用2-DE技术对猪肉、牛肉、鸡肉、火鸡肉、鸭肉和鹅肉及其肉制品中的肌球蛋白轻链(myosin light chain,MLC)进行了对比分析,结果发现,不同加工工艺处理后的肉及肉制品中均观察到MLC的物种间特异性。但电泳技术仍存在一些局限性,如疏水性、难溶性蛋白质及低丰度蛋白质的分离效果差、动态范围有限、加工引起的蛋白质降解及胶内酶解过程较长等。部分实验采取选择性沉淀[22-23]方法进行蛋白纯化,常用的溶剂包括乙腈、丙酮、甲醇、三氯乙酸等,该方法具有快速、简单、成本低的优势,但高浓度试剂易使酶和具有活性的蛋白变性;因此,在酶解之前还需使用其他手段去除溶剂。Sarah等[23]通过丙酮沉淀法处理热加工猪肉制品以达到净化样品的目的。为了实现快速对样品进行真伪鉴别,一些研究人员提出了一种无需蛋白质分离和纯化的提取方法[24]。Montowska等[25]将洗净的肉类加工样品在100 mmol/L碳酸氢铵溶液中均质,经真空浓缩器干燥后溶于50 mmol/L碳酸氢铵溶液中以进行蛋白质酶解。Prandi等[24]将均质的肉制品冻干后,溶解于50 mmol/L碳酸氢铵溶液中,经还原及烷基化,在含有胰蛋白酶的碳酸氢铵溶液中酶解18 h(37 ℃),最后采用质谱技术进行分析。该处理过程操作相对简便,样品经提取、酶解后,采用液相色谱技术分离后直接进入质谱进行数据采集与分析,缩短了实验操作时间,提高了实验的可重复性,被广泛应用于食品真实性鉴定过程中。
1.2.2 物种特异性多肽数据的采集
样品提取后,利用高分辨质谱技术进行数据采集与分析,应用较多的仪器包括飞行时间质谱(time of flight mass,TOF-MS)、轨道离子阱质谱(Orbitrap)等高分辨率质谱仪,正离子模式扫描,采用全扫描-二级扫描结合的模式,可高精度地测定多肽分子质量,再通过组学软件分析,搜索相应的数据库,从而实现准确鉴别多肽的蛋白及物种来源。TOF-MS通过静电场加速离子后,以离子飞行速度差来分析离子质核比;该类仪器可检测的分子质量范围宽、扫描速度快、仪器结构简单、价格相对便宜;但其存在分辨率较低、受环境影响较大、需要实时校正等不足。轨道离子阱质谱是离子绕纺锤体进行轴向及径向运动,通过傅里叶转换得到频谱图,而离子共振频率与质核比相关,最终得到质谱图;相比TOF-MS而言,轨道离子阱质谱的分辨率高,质量轴相对稳定;但其扫描时间较长,分子质量范围较窄,价格较贵。相对于高分辨质谱而言,三重串联四极杆质谱、离子阱质谱属于低分辨质谱仪,但其MRM模式通过同时验证待测物的母离子及子离子信息,可大大降低基质干扰效应,提高定性及定量的准确性,应用性更广。因此,越来越多的研究倾向于先利用高分辨质谱采集数据并经数据库搜索得到物种差异性多肽序列;然后将筛选的多肽信息进行转换并导入至低分辨率质谱中进行样品分析测定。质谱采集数据前,常使用液相色谱技术进行组分分离,从而得到较高质量的质谱数据,如纳升液相色谱(nano liquid chromatography,nLC)、超高效液相色谱(ultra performance liquid chromatography,UPLC)。相比UPLC,nLC具有更高的耐压性,可以选择更长的色谱柱或是粒径更小的色谱柱,通过较小的流速,从而实现高效的分离度及重复性;但其分析时间较长,通常需要20多小时甚至更长的时间,而UPLC通常在1 h之内完成整个分析过程。对于食品分析而言,食品基质较为丰富,且筛选差异多肽的蛋白来源基本上都是高峰度蛋白,采用UPLC技术能够满足一般的蛋白组学需求;而对于需要尽可能多的得到蛋白及多肽信息,并且需要达到实验的高重复性,可以采用nLC技术。表1列举了质谱技术在肉及肉制品中物种源性鉴别方面的研究。
此外,还可以采用基质辅助激光解吸电离(matrix assisted laser desorption ionization,MALDI)与TOF-MS结合的方式,基于特定波长的激光照射的软电离技术,使得多肽带单一电荷,不会产生明显的碎片离子,从而得到相对简单的质谱图,该方法灵敏度高,并且对样品的前处理过程要求不严,从而简化了样品处理过程。如Flaudrops等[39]采用MALDI-TOF-MS技术分析明胶样品,实现了猪肉、牛肉明胶物种来源的区分。该技术也存在一系列缺点,尤其是当一个点中存在多个蛋白时,MALDI-TOF-MS的重复性不高,结果可靠性低;此外,MALDI-TOF-MS也不能进行翻译后修饰蛋白质的分析。随着质谱技术的发展,LESA-MS由于检测时间短受到关注。LESA-MS是基于芯片的纳米电喷雾离子化质谱分析技术,通过样品表面的萃取溶液形成液体或表面微接点以提取分析物[40],是一种快速、高通量的质谱分析方法,并已应用于牛肉、猪肉、马和家禽等各种加工肉制品中的真实性鉴定中[25-26]。Montowska等[26]提出利用LESA-MS技术鉴别不同类型加工肉制品(牛肉、猪肉、马、鸡肉和火鸡肉),筛选出25 条热稳定性多肽。但LESA-MS对于低峰度蛋白的鉴定以及定量分析等仍处于探索阶段。
质谱在对多肽进行解析的过程中主要采用两种模式,分别是数据依赖采集模式(data-dependent analysis,DDA)和数据非依赖采集模式(data-independent analysis,DIA)。DDA是质谱采集过程中,在每一个循环中分别在一级谱图中挑选响应值比较高的离子进行二级扫描,并将得到的结果与数据库中的理论蛋白谱图进行匹配。DDA模式简单有效,分析流程比较成熟,能够减少干扰离子的影响,从而提供较高水平的谱图信息,是目前质谱分析的主流方式[41]。Montowska等[26]采用DDA模式获取MS/MS数据,在牛肉、猪肉和马肉中鉴定出了肌球蛋白重链(myosin heavy chain,MHC)异构体的标记多肽。但DDA模式也存在一些不足,即选择离子具有一定的随机性,偏向于检测丰度较高的肽段,而抑制了低丰度肽段的检测[42];并且在分析复杂样品时,样品重复性较差。相较于DDA,DIA是近年来发展起来的一种技术,是将采集过程中的所有肽段按照质核比分成若干段,再对每个窗口内的所有一级离子进行碎片化扫描,通过提取子离子信息进行蛋白定量分析,该方法能够避免DDA模式下一级离子选择的随机性,重复性好、定量准确,但该模式下不能直观地指出子离子的来源,需通过相对专业的软件进行分析[43]。Gillet等[41]开发了
碎片离子连续窗口采集技术,使用Q-TOF在32 个连续的25 amu窗口检测所有碎片离子谱图,结果发现,即使在扫描中无法检测到目标肽的一级质谱信息,但通过提取特定的碎片离子信息可以在超过4 个数量级的动态范围内确定目标肽。近年来,基于DIA模式的方法多集中于临床医学方向的应用。Lin Lin等[44]基于DIA模式的MS方法对血清中获得的多肽和蛋白质进行分析,与DDA方法相比,优化的DIA法检测到的多肽和蛋白数量增加了一倍,重现性更好,单次运行DIA分析可在50 min的梯度时间内对300多种蛋白质进行定量分析,且无需蛋白预分离,能够准确地检测与疾病相关的靶标蛋白。
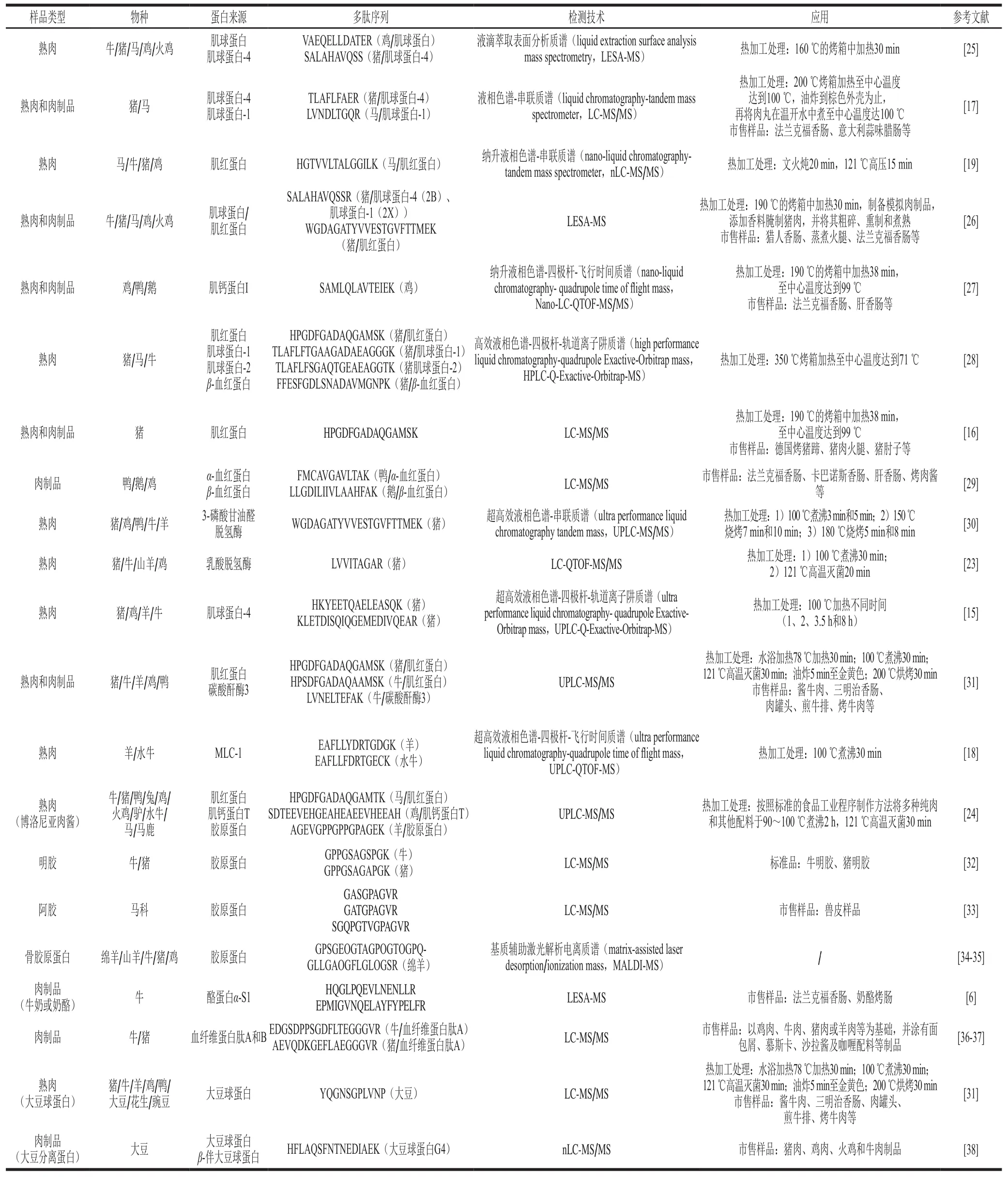
表1 基于质谱技术的蛋白质组学在肉类食品真伪鉴别中的应用Table 1 Application of proteomics based on mass spectrometry for meat product authentication
1.2.3 物种特异性多肽的鉴定和确认
利用高分辨质谱获得多肽数据后,还需使用专业的软件分析质谱谱图,目前收费软件包括Proteome Discoverer(美国Thermo公司)、Peaks Studio(美国BSI公司)、ProteinPilot(美国AB SCIEX公司)、Mascot(英国Matrix Science公司)等,免费软件主要有Maxquant。不同软件之间通过整合不同的搜库算法,在提取质谱信息的同时,对蛋白数据库进行匹配,从而获得多肽及蛋白的匹配信息,常用的数据库包括UniProt(http://www.uniprot.org)、NCBI(https://www.ncbi.nlm.nih.gov/protein)等。UniProt被认为是收录最广泛和注释信息最全面的蛋白质数据库,也是搜索蛋白相关信息的首推数据库,其数据主要来自于基因组测序项目后获得的蛋白质序列,也包含了大量来自文献的蛋白质生物功能信息。然而,经蛋白组学软件在默认参数下搜库得出的多肽及蛋白信息数量庞大,会影响后续多肽物种唯一性的筛选工作,因此需对关键参数进行优化[45],如序列覆盖率、置信度、肽段长度和峰强度等参数,利用所选肽段的丰度,通过主成分分析(principal component analysis,PCA)、正交偏最小二乘判别(orthogonal partial least squares discrimination analysis,OPLS-DA)等多元统计分析方法对数据进行分析并筛选差异多肽,然后通过BLAST(http://www.ncbi.nlm.nih.gov/Blast/)或FASTA(http://www.ebi.ac.uk/fasta)算法验证多肽的种属特异性。Li Yingying等[31]利用Maxquant软件提取质谱谱图并进行UniProt数据库搜索,通过对序列长度、序列覆盖率等关键参数的设置,大大提高了特异性多肽的筛选速度和效率。Zhang Yingying等[45]通过Full MS/dd-MS2扫描模式得到样品的多肽质谱信息,利用Proteome Discoverer软件对UniProt数据库进行搜索,结合SPSS软件分析肽段的丰度并绘制PCA模型,同时优化多肽筛选的关键参数(序列覆盖率、置信度、肽长度和峰强度等),大大缩短了特异性多肽的筛选过程,随后采用BLAST进一步验证所选肽段的种属唯一性,实现了对猪、牛、羊、鸡、鸭等动物血豆腐的掺假鉴定。
1.2.4 物种特异性多肽的热稳定性考察
据报道,通过比较同物种加工前后特有多肽的响应变化,发现部分多肽在高温加工过程中的响应值明显下降[30,46],这主要是因为样品经热加工处理后,蛋白的结构发生了变性,进而影响了蛋白的提取及酶解。因此,结合当前食品加工的主要处理方式,进一步考察多肽的热稳定性。Sarah等[23]从热加工肉制品中筛选了猪肉的特异性肽段,设定了不同热加工处理条件,100 ℃煮沸30 min、121 ℃高温灭菌20 min,对多肽的稳定性进行验证,在熟肉样品中依然可以检测到猪肉的特异性多肽标志物。Wang Guiji等[30]也通过设置不同热加工处理条件,对样品(猪/鸡/鸭/牛/羊)分别进行100 ℃煮沸3 min和5 min、150 ℃烧烤7 min和10 min、180 ℃烧烤5 min和8 min,采用MRM模式对生肉和熟肉的多肽进行确认,鉴定了34 个多肽标记物和20 个热稳定多肽。此外,Pan Xiaodong等[15]同样通过设置不同热加工处理条件对样品(鸡/绵羊/牛/猪肉)分别100 ℃加热1、2、3.5、8 h,发现来源于肌球蛋白-4的肽段(KLETDISQIQGEMEDIVQEAR)是猪肉中较好的热稳定性多肽,采用LC-MS/MS分析方法能够检测出肉混合物中含有0.5%的猪肉成分。Montowska等[26]采用LESAMS方法用于鉴别不同类型的加工肉制品(蒸煮火腿,法兰克福香肠和热狗等)中的特异性多肽,检测出来源于肌原纤维和肌浆蛋白的25 条热稳定性多肽。
1.3 物种特异性多肽的选择原则
特异性多肽是肉及肉制品真实性鉴定的关键参数,通过文献总结,发现多肽筛选遵循以下通用原则[15,23,31]:热稳定性强;独有多肽与其他物种无同源性;质谱易于检测(丰度高且在低浓度时信噪比较好);氨基酸长度为6~25 个;通常肽段中间不存在胰蛋白酶特异性的裂解位点;重现性好。
不同研究中所筛选的特异性多肽不完全一致,通过表1可以看出,大多数多肽来源于肌红蛋白、肌球蛋白、血红蛋白、MLC-1、3-磷酸甘油醛脱氢酶等,而肌球蛋白是特异性多肽的主要蛋白来源,这主要是由于肌肉蛋白分为肌原纤维蛋白质(myofibrillarproteins)、肌浆蛋白质(sarcoplasmicproteins)和基质蛋白质(stromaproteins)三大类,其中肌原纤维蛋白占蛋白质总量的40%~50%,其中肌球蛋白占肌原纤维蛋白的50%~55%。
2 蛋白质组学在肉类食品真实性鉴别中的应用
2.1 肉类食品的源性鉴别
近年来,越来越多的文章倾向于采用蛋白质组学对肉类食品进行物种真伪鉴别[47]。通过对牛、猪、马、鸡、火鸡、羊等多类物种中不同蛋白来源的肽段进行分析鉴定,筛选物种特异性多肽,从而实现多物种的掺假鉴别。von Bargen等[4]使用基于LC-MS/MS技术的蛋白质组学方法筛选了猪肉和马肉的多肽标记物,能够检测出牛肉中相对含量为0.5%的猪肉或马肉,并将该方法应用于测定深加工肉制品(如肉丸、香肠、香肠和罐装肉)中的猪源或马源成分。Sentandreu等[20]采用LC-MS/MS方法测定混合肉中的鸡源成分,发现来源于MLC-3的肽段(DQGTFEDFVGLR)是鸡肉的特异性多肽标志物,可测定猪肉中相对含量为0.5%的鸡肉。Stachniuk等[13]开发了一种LC-QTOF-MS/MS方法,用于检测热加工肉制品中的兔源成分,通过对纯兔肉及含有5%~85%的兔肉与其他常见的肉类(猪肉、鸡肉和羊肉)混合的肉制品进行分析,从肌原纤维蛋白和肌浆蛋白中鉴定了49 种特异性多肽。Sentandreu等[48]利用蛋白质组学方法区分熟肉中鸡肉和火鸡肉,在MLC-3中获得鸡肉和火鸡肉的特异性多肽。鸡肉和火鸡肉的MLC-3具有高度的同源性,整个蛋白的氨基酸序列仅有3 个氨基酸存在差异,分别是序列的第20、47和85 位,例如火鸡MLC-3蛋白在第47位含有一个蛋氨酸残基,而鸡MLC-3是异亮氨酸。基于这些差异可获得物种的特异性多肽,从而对熟肉中鸡肉和火鸡肉的成分进行区分。
此外,基于蛋白质组学的方法已逐渐应用于肉制品的定量分析检测中。Prandi等[24]开发了一种在复杂的食品基质(如肉酱)中快速检测并定量肉制品中8 种物种(鸭肉、兔肉、鸡肉、火鸡肉、水牛肉、马肉、鹿肉、羊肉)的方法,方法检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ)分别为0.15%~0.68%和0.53%~2.30%。Sentandreu等[20]利用稳定同位素标记的多肽作为内标对生肉和熟肉进行定量分析,采用LC-MS/MS技术检测到鸡肉多肽的含量与不同相对含量的鸡肉之间存在良好的线性关系。Montowska等[49]也提出使用稳定同位素多肽作为内标以监测并定量复杂肉制品中的目标肉类(鸡/鸭/鹅/猪/牛)和致敏蛋白(大豆/牛奶/蛋清),采用同位素标记的多肽作为内标,能够减少仪器及实验操作过程中的不确定性,提高方法定量的准确性。
2.2 肉类食品中非肉蛋白成分的鉴别
蛋白质组学技术不仅可以对肉制品中的动物源性成分进行鉴别,还可以测定肉制品中的非肉蛋白成分[50]。非肉蛋白来源主要包括大豆、豌豆、小麦等植物源或牛奶、血浆、蛋清等动物源,在肉制品加工中添加外源性蛋白可以改善肉的持水力、组织结构等功能性质[51],但非肉蛋白的过量添加会降低肉制品的加工成本,造成经济利益驱使的掺假行为,甚至会引起易感人群的过敏症状[52],通常引发过敏的食物基质包括鸡蛋、鱼、牛奶、坚果、花生、贝类、大豆、小麦。因此,开发出一种能够有效鉴别非肉蛋白成分的方法具有重要意义。
表1中也列举了蛋白质组学技术测定肉制品中非肉蛋白的方法及应用。Li Yingying等[31]采用LC-MS/MS技术对熟肉制品中猪、牛、羊、鸡、鸭、大豆、花生和豌豆8 类不同物种进行分析鉴定,结果表明该方法可以很好地鉴定出肉制品中的大豆、花生和豌豆成分,实现了对熟肉制品中动物源性和植物源性成分的同时鉴别。Hoffmann等[53]利用LC-MS/MS技术建立了一种同时测定肉制品中羽扇豆、豌豆和大豆的定量鉴别方法,其中羽扇豆、豌豆和大豆在肉制品中的LOD分别为2、5 mg/kg和4 mg/kg。Houston等[54]采用蛋白质组学方法检测并比较了20 种成熟大豆品种中的10 种大豆过敏原蛋白的表达。Montowska等[55]采用液相色谱四极杆飞行时间质谱(liquid chromatography-quadrupole time of flight-mass,LC-QTOF-MS)技术对市售肉制品中非肉类蛋白成分进行检测,利用该方法可以检测到加工禽肉制品中大豆、牛奶、蛋清中致敏性蛋白的热稳定性多肽。
明胶是胶原蛋白部分水解而成的一种可溶性天然聚合物,目前,在猪肉、牛肉等动物中提取的明胶被广泛应用于食品中,Ward等[56]建立了测定猪、牛、鸡等明胶源性成分的蛋白质组学方法,分别发现猪明胶、牛明胶和鸡明胶中3、7 种和22 种多肽标记物,该方法可用于商业明胶样品的物种鉴定。阿胶具有抗氧化[57]、增强免疫力和抗衰老[58]等性能,被用作食品配料和保健品,因此,阿胶的鉴定是消费者关注的问题之一,但对阿胶制品中驴、马、骡子等同源物种的来源鉴定仍是一个挑战,迫切需要一种可靠的物种来源检测方法。Guo Shangwei等[33]开发了一种基于蛋白质组学的LC-MS/MS方法以鉴定明胶产品中驴、马及骡子的来源,通过跨种比较筛选出了马科物种的3 种特异性标记肽(SGQPGTVGPAGVR、GASGPAGVR和GATGPAGVR),可用于鉴别阿胶制品的物种来源,当马、骡子的添加量分别为0.05%、0.10%时也能被检测出来。
2.3 食品安全及可追溯性
随着社会发展和人民生活水平的不断提高,消费者对食品质量和安全需求越来越高,而食品真实性和食品溯源技术是保障食品安全的重要手段,通过检测、数据采集、整理和分析,实现正向追踪及逆行溯源,进而建立一套食品从生产、加工、流通等环节的可追溯体系。蛋白质组学所建立的高通量方法可提供食品有关的精确成分的信息,从而实现食品的追溯。Buckley等[34]使用固相萃取(C18ZipTip1)进行多肽纯化,利用质谱分析获得特异性胶原蛋白肽,通过分析来源于32 种不同哺乳动物的胶原蛋白,共鉴定出92 条多肽可用于物种识别,但由于样品在145 ℃、3 bar压力下处理20 min后会丢失一些关键肽,因此无法区分绵羊和山羊。随后使用MALDI-MS/MS对来自绵羊和山羊胶原蛋白的33 种氨基酸进行了多肽测序,结果显示这两个物种之间存在2 条氨基酸序列的差异,该方法可以用于区分喜马拉雅塔尔羊与羱羊等不同品种[35]。因此,质谱技术与蛋白质组学方法结合而构建成溯源体系可能是未来发展的趋势之一。
3 结 语
基于质谱技术的蛋白质组学方法是通过寻找物种间的差异氨基酸序列以鉴别肉类食品中的源性成分,且蛋白的一级氨基酸序列比DNA序列具有更强的稳定性,能很好地耐受外界环境(高温、高压和酸碱度等)的干扰,在深加工制品的检测分析中具有更大的优势。然而,当前的蛋白质组学方法的研究主要还是集中在食品中源性成分的定性分析或是相对含量的定量分析方面,而在绝对定量分析中的研究应用较少,如何准确测定肉制品中的含肉量是当前肉类食品行业的难点之一。采用蛋白质组学方法利用质谱技术可以对物种多肽及其来源蛋白进行准确定量,但是由于肉中蛋白含量的不确定性,由蛋白含量推导出肉含量还存在一定的困难。目前,也有部分研究者开始对肉的绝对含量进行探究,Li Yingying等[59]建立了一种内标法测定加工肉制品中猪肉含量的LC-MS/MS方法,筛选了碳酸酐酶3蛋白中3 条多肽作为猪的特异性定量多肽,并合成了相应的同位素内标多肽,通过取不同体积的纯猪肉溶液绘制标准曲线,从而推算样品中猪肉的准确含量,该方法的回收率为80%~130%,满足日常检验的要求。该研究为当前绝对定量分析提供了一种新的解决思路,但是该方法还存在一些不足,如用纯猪肉的标准曲线去计算样品中的猪肉含量,整个过程会受到肉制品加工工艺、水分含量、脂肪含量、不同猪肉品种等因素的影响,还需对不同影响条件进行正交试验验证,从而得到可靠的数据结果。随着蛋白质组学的深入研究以及多技术的协同发展,物种专属性多肽链将形成数据库,方法形成统一标准,组织-蛋白-多肽之间的相互特征关系将更明确,蛋白组学的应用将会扩展到食品中的更多领域。
