红肉蜜柚果实采后贮藏过程中果皮与汁胞能量代谢的差异
2022-04-01汪永红温佳艺刘顺枝胡位荣
汪永红,温佳艺,刘顺枝,胡位荣
(广州大学生命科学学院,广东 广州 510000)
红肉蜜柚(Citrus grandisvar. Red-fleshed sweet pomelo)是从琯溪蜜柚(C. grandis)优良芽变异单株中选育而成的新品种[1]。柚果的果皮分为3 层,外果皮由子房外壁发育而成,布满油胞,含芳香油、腊质等物质;中果皮由子房的中壁发育而成,即白皮层;内果皮由内心壁发育而成,即瓤囊,是柚类果实的食用部分,内含汁胞和种子[2];柚果皮适度失水后富有弹性,可阻隔果实内外气体的交换,因此柚类果实采后腐烂率相对较低,但是在贮藏过程中常见汁胞枯水变硬,造成其口感下降,出现“败絮其中,金玉其外”的现象,影响其经济价值[3]。近年来研究发现,园艺作物采后衰老与能量合成下降造成的细胞能量亏损有关[4-6],Wang Hui等[7]在研究荔枝的过程中发现,荔枝采后衰老过程中,ATP含量显著下降;Ge Yonghong等[8]发现用磷酸钠浸渍处理苹果能保持苹果的能量相关物质含量和酶活性,延长苹果的贮藏保鲜期。因此,探索红肉蜜柚在衰老过程中外果皮、白皮层和汁胞的相关能量物质含量与相关酶活性变化的趋势,是红肉蜜柚采后贮藏保鲜领域亟待解决的问题。
果实采收后,由于失去植株的水分和养料的供给,呼吸作用成为生命活动的中心活动。呼吸作用通过把组织中复杂的有机物质逐步分解成简单的物质,最后变成二氧化碳和水,释放出能量。呼吸作用产生的能量是采摘后的果实进行其他生命活动的能量来源,而冷藏是果实采后保鲜的常用手段,可利用合适的低温降低果实采后的呼吸速率,延长果实的贮藏保鲜期[9-10]。为了揭示红肉蜜柚果实衰老过程中外果皮、白皮层和汁胞的能量相关物质含量和相关酶活性的变化规律,本实验以8 ℃对红肉蜜柚进行冷藏,并以室温贮藏为对照,测定分析不同贮藏时间的果实汁胞、白皮层和外果皮的能量代谢相关指标,以期从能量代谢的角度阐明红肉蜜柚衰老过程中出现汁胞枯水而外果皮无明显变化的原因,为红肉蜜柚的采后贮藏保鲜提供理论参考。
1 材料与方法
1.1 材料与试剂
本实验所用的红肉蜜柚果实采自广东省梅州市商业性生产柚园。挑选大小一致、无病虫害、无机械损伤的果实,立即运回实验室。
施保功(咪鲜胺锰盐) 美国富美实公司;考马斯亮蓝 广州市齐云生物技术有限公司;甲醇 天津市科密欧化学试剂有限公司;琥珀酸钠、ATP 北京索莱宝科技公司;乙二胺四乙酸、磷酸二氢钾 广州化学试剂厂;磷酸氢二钾 国药集团化学试剂有限公司;氢氧化钠 天津市永大化学试剂有限公司;木质素含量检测试剂盒 上海碧云天生物科技有限公司;2,6-二氯靛酚钠 生工生物工程(上海)股份有限公司;ATP酶测试盒 南京建成生物工程研究所;细胞色素c 上海源叶生物公司。
1.2 仪器与设备
1260-6460型液相色谱三重串联四极杆质谱联用仪美国Agilent公司;5810R冷冻高速离心机 德国Eppendorf公司;UV-1800PC型紫外分光光度计 上海美谱达仪器有限公司;RXZ-430D型智能工气候培养箱宁波东南仪器有限公司;SZ-93型自动双重纯水蒸馏器上海亚荣生化仪器厂;DW-86L388J型医用超低温保存箱青岛海尔特种电器有限公司;WP-RO-208型实验室超纯水机 四川沃特尔水处理设备有限公司;301P-01N型台式pH计 美国Thermo orion公司。
1.3 方法
1.3.1 原料处理
用施保功溶液(施保功与水的体积比为1∶1 500)浸泡整个果实1 min灭菌,取出晾干,先放置室温预贮48 h,再用保鲜袋包装并封口,随机分成2 组,分别置于25 ℃(对照)和8 ℃(冷藏)的人工气候培养箱贮藏,相对湿度为80%~90%[2]。贮藏90 d,每10 d分别取3 个果实,取果实赤道部位,分离外果皮、白皮层和汁胞,分类取样各1 g,立即将样品置于-80 ℃超低温冰箱中速冻贮存备用。除可溶性固形物质量分数和木质素含量测定的对象仅为汁胞外,其他指标测定对象均为外果皮、白皮层和汁胞3 个部分。
1.3.2 可溶性固形物质量分数、木质素含量及水分质量分数测定
可溶性固形物质量分数采用手持式折光仪测定;木质素含量采用木质素含量检测试剂盒测定,结果以鲜质量计。水分质量分数采用烘干后称质量法测定。
1.3.3 丙二醛含量的测定
丙二醛(malondialdehyde,MDA)含量的测定参照Jannatizadeh等[11]的方法,略作修改。取1 g样品,加入聚乙烯吡咯烷酮、0.05 mol/L磷酸缓冲液(pH 7.8)手动匀浆,4 ℃、10 000 r/min离心15 min。取1 mL上清液,加入3 mL 0.5 g/100 mL硫代巴比妥酸,反应30 min后离心15 min,取上清液分别测定532 nm和600 nm波长处的吸光度并计算丙二醛含量,单位为μmol/g,结果以鲜质量计。
1.3.4 能量代谢相关酶活力测定
线粒体的提取参照Liang Wusheng等[12]的方法,略作修改。取10 g冷冻样品,液氮研磨,加入20 mL提取液(50 mmol/L pH 7.5 Tris-HC1、0.25 mol/L蔗糖、0.3 mol/L甘露醇、0.5 g/100 mL聚乙烯吡咯烷酮)冰浴匀浆,4 层纱布过滤至离心管,4 ℃、4 000 r/min离心10 min;取上清液12 000 r/min离心25 min,去上清液,将沉淀用10 mL洗涤液(含10 mmol/L pH 7.2 Tris-HCl、0.25 mol/L蔗糖、1 mmol/L乙二胺四乙酸)洗涤,4 ℃、4 000 r/min离心10 min,取上清液于4 ℃、12 000 r/min下离心25 min,得到的沉淀即为线粒体,用1.5 mL悬浮液(含有10 mmol/L pH 7.2的Tris-HCl、0.25 mol/L蔗糖、1 mmol/L乙二胺四乙酸)悬浮即为粗酶液。粗酶液蛋白质含量测定参照Bradford[13]的方法,以牛血清白蛋白为参照标准。
琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力的测定参照Ackrell等[14]的方法;细胞色素氧化酶(cytochrome oxidase,CCO)活力参照Jin Peng等[15]的方法测定,以每毫克蛋白质每分钟吸光度变化0.01为一个SDH或CCO活力单位(U);H+-ATPase和Ca2+-ATPase活力测定采用相应试剂盒,以每小时每毫克蛋白分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位(U)。以上酶活力单位均为U/mg,结果均以蛋白质量计。
1.3.5 ATP、ADP、AMP含量及能荷的测定
ATP、腺苷二磷酸(adenosine diphosphate,ADP)、腺苷一磷酸(adenosine monophosphate,AMP)含量及能荷的测定参考Li Peiyan等[16]的方法,略作修改。称取2 g样品,液氮研磨,加入6 mL 0.6 mol/L的HClO4,匀浆,4 ℃、12 000 r/min离心30 min,迅速取3 mL上清液用1 mol/L KOH溶液调pH值至6.5~6.8,随后用超纯水定容至4 mL,过0.22 μm水系滤膜后进行高效液相色谱分析。色谱条件:C18反相柱(250 mm×4.6 mm),检测波长254 nm。流动相A为甲醇,流动相B为0.1 mol/L磷酸钾缓冲液(pH 7.0)。线性梯度洗脱,进样量为20 μL。根据标准品的保留时间对样品作定性分析,根据标准品的峰面积进行定量分析,ATP、ADP、AMP含量均以原料鲜质量计。能荷(energy charge,EC)按下式计算。
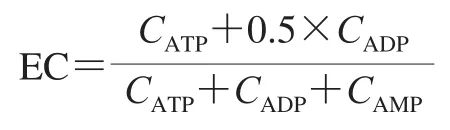
式中:CATP、CADP、CAMP分别表示ATP、ADP和AMP的含量/(μg/g)。
1.4 数据统计与分析
结果均为测定重复3 次的平均值。实验得到的数据采用Excel 2010软件进行图表绘制,利用SPSS Statistics 21软件对结果进行皮尔逊相关性分析。
2 结果与分析
2.1 果实贮藏过程中果皮与汁胞品质指标的变化
2.1.1 红肉蜜柚冷藏过程中汁胞可溶性固形物质量分数和木质素含量的变化
汁胞中可溶性固形物质量分数是评价果实品质的重要指标之一。对照组汁胞的可溶性固形物质量分数在前20 d直线上升,20 d后波动变化,冷藏果实贮藏20 d后汁胞可溶性固形物质量分数低于对照组(图1A),贮藏80 d时,冷藏组和对照组汁胞可溶性固形物质量分数比采摘时分别增加了8.9%和16.54%,这可能与果实贮藏后期含水量下降有关。
果实汁胞木质素含量增加是汁胞枯水的表现[17]。由图1B可知,在整个贮藏过程中,汁胞木质素含量整体呈上升趋势,与佘文琴等[18]的研究结果一致,对照组果实贮藏至40 d时汁胞木质素含量急剧上升至8.2 mg/g,冷藏果实汁胞木质素含量骤增时间较对照组延后10 d,贮藏至50 d上升至7.3 mg/g,且整个贮藏过程中,冷藏果实汁胞木质素含量均低于相同贮藏时间的对照组,表明冷藏能降低果实汁胞的粒化程度。

图1 红肉蜜柚贮藏过程中汁胞可溶性固形物质量分数(A)、木质素含量(B)的变化Fig. 1 Changes in TSS (A) and lignin (B) contents in juice sacs of redfleshed sweet pomelo during storage
2.1.2 红肉蜜柚冷藏过程中水分质量分数的变化
汁胞枯水的发生被认为与水分在果实果皮、囊瓣和汁胞之间的流动有关[19]。柚果在贮藏过程中,外果皮、白皮层和汁胞的水分质量分数都呈波动下降趋势。如图2A所示,贮藏前30 d,对照组汁胞水分质量分数高于冷藏果实汁胞,贮藏60 d时,冷藏果实汁胞水分质量分数更高,比对照组高0.2%,贮藏至70 d时,冷藏组与对照组比采摘时分别减少了1.11%和1.25%。冷藏组和对照组白皮层的水分质量分数在40 d时差异最大,此时冷藏果实白皮层水分质量分数比对照组高3.4%,贮藏至70 d时,冷藏组和对照组水分质量分数比采摘时分别下降了3.53%和5.83%(图2B)。冷藏果实外果皮水分质量分数在贮藏至20 d后高于对照组,贮藏至70 d时差异最大,比对照组高4.18%,比采摘时分别下降了0.88%和5.07%(图2C)。结果表明,在贮藏至70 d时,对照组白皮层的水分质量分数下降最多,冷藏外果皮下降最少。
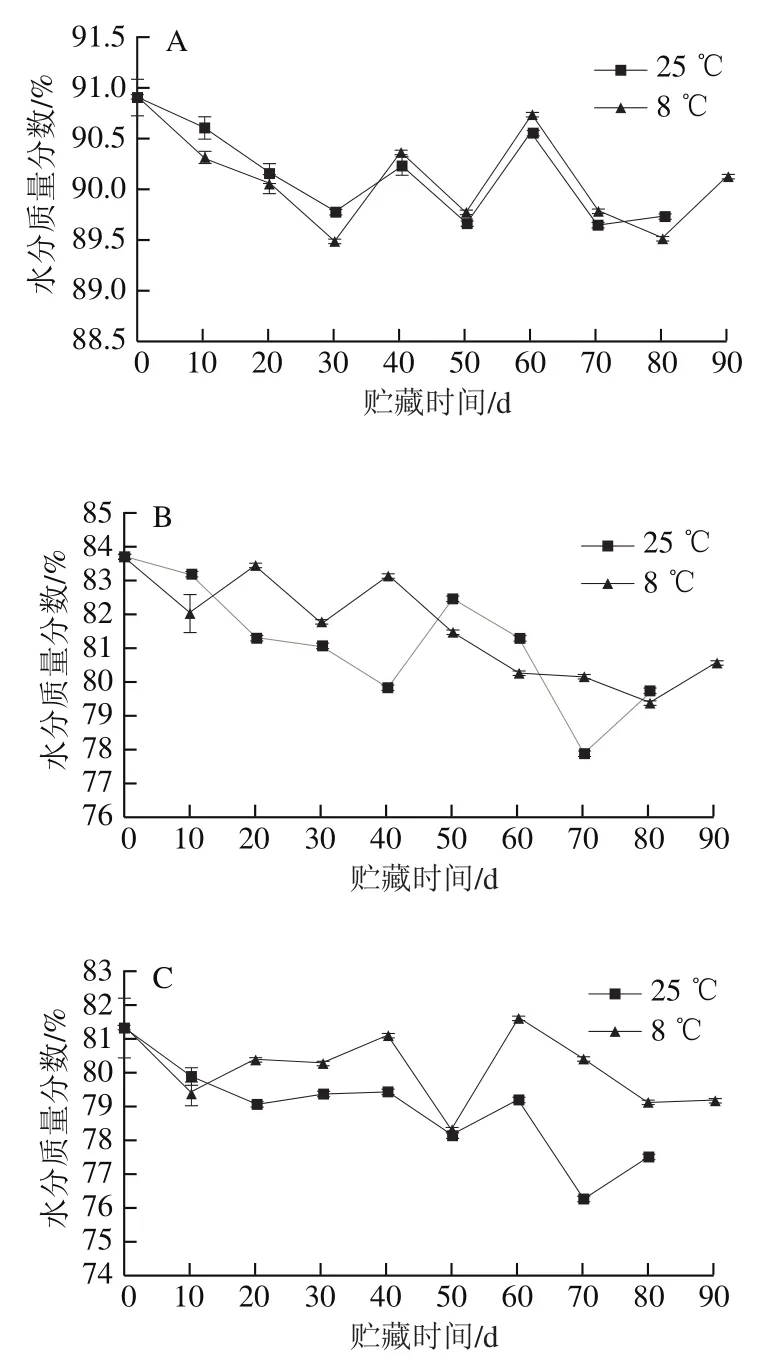
图2 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)和外果皮(C)水分质量分数的变化Fig. 2 Changes in relative water contents in juice sacs (A), white cortex (B)and peel (C) of red-fleshed sweet pomelo during storage
2.1.3 红肉蜜柚冷藏过程中MDA含量的变化
MDA是膜脂过氧化的产物,其含量是评价细胞膜结构损伤程度的指标之一[20]。冷藏果实汁胞MDA含量前50 d均低于对照组(图3A),结合外观观察,对照组果实汁胞在贮藏至50 d时,汁胞枯水明显。果实白皮层的MDA含量在贮藏过程中波动下降,冷藏70 d时MDA含量高于对照组(图3B)。冷藏果实外果皮的MDA含量始终高于对照组,贮藏80 d后,冷藏果实外果皮MDA含量是对照组的2.6 倍(图3C),说明冷藏果实的外果皮细胞膜结构损伤大于对照组。结果表明,与对照组相比,冷藏能减少汁胞贮藏前期MDA的积累,但会促进外果皮的MDA积累,可能是因为贮藏温度的降低,导致外果皮的蛋白质、核苷酸和糖类等多种非脂类生物分子降解以抵抗生理逆境,从而产生MDA[21]。
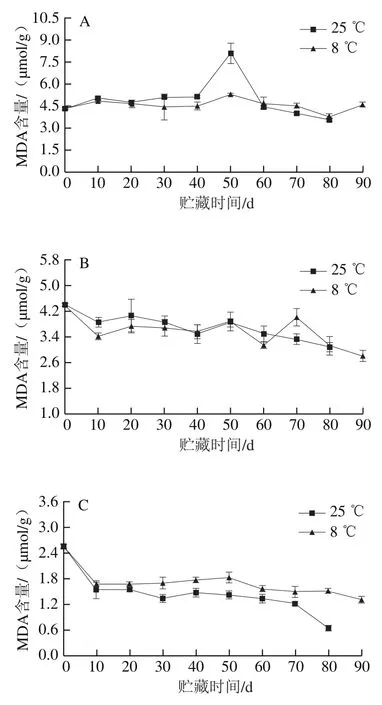
图3 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)和外果皮(C)MDA含量的变化Fig. 3 Changes in MDA contents in juice sacs (A), white cortex (B) and peel (C) of red-fleshed sweet pomelo during storage
2.2 果实贮藏过程中果皮与汁胞能量代谢相关酶活力的变化
2.2.1 红肉蜜柚冷藏过程中SDH活力的变化
SDH在三羧酸循环过程中催化琥珀酸转化成延胡索酸,同时产生H+,最后生成ATP,因此SDH活性会影响ATP的生成[22]。冷藏果实汁胞的SDH活力在50 d时比对照组低6.4 U/mg(图4A),在贮藏至90 d时明显升高,表明冷藏能维持果实汁胞贮藏后期较高的SDH活力。冷藏果实白皮层的SDH活力高峰在60 d时出现,此时冷藏组的SDH活力比对照组高16.6 U/mg,且在贮藏后期高于对照组(图4B)。果实贮藏至80 d时,冷藏果实外果皮的SDH活力出现高峰,是此时对照组的2.2 倍(图4C)。
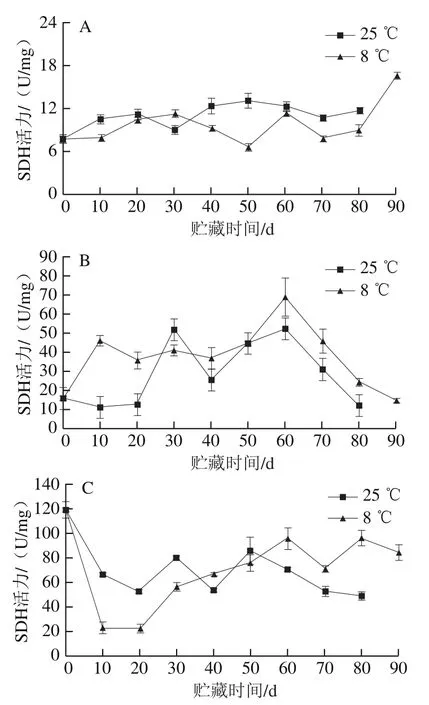
图4 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)和外果皮(C)的SDH活力的变化Fig. 4 Changes in SDH activity in juice sacs (A), white cortex (B) and peel (C) of red-fleshed sweet pomelo during storage
2.2.2 红肉蜜柚冷藏过程中CCO活力的变化
CCO主要通过氧化磷酸化过程为细胞提供能量,是线粒体呼吸链上氧化磷酸化过程中的关键酶,CCO活性的降低会导致氧化磷酸化效率降低,ATP生成受阻[23]。由图5A可知,冷藏果实汁胞的CCO活力在贮藏40 d时比对照组高2.7 U/mg,贮藏至80 d时,冷藏果实、对照组汁胞CCO活力与采摘时相比均降低。
由图5B可知,冷藏果实和对照组白皮层在贮藏至60 d时同时出现CCO活力高峰,冷藏果实白皮层CCO活力比对照组高49%,随后都呈现下降趋势,贮藏至80 d时,冷藏果实、对照组白皮层CCO活力比采摘时分别下降了0.63 U/mg和2.33 U/mg。
由图5C可知,在贮藏的前10 d,果实外果皮的CCO活力急剧下降,且冷藏果实外果皮的CCO活力低于对照组。冷藏果实和对照组在贮藏至40 d时外果皮都出现CCO活力较低值,与采摘时的CCO活力相比,分别降低了24.21 U/mg和38.6 U/mg,贮藏至50 d时出现CCO活力高峰,且冷藏果实外果皮CCO活力比此时对照组高18 U/mg;贮藏至80 d时,与采摘时相比,冷藏组和对照组外果皮CCO活力分别下降了11.55 U/mg和11.85 U/mg。结果表明,与采摘时相比,贮藏至80 d时,果实的3 个部位中外果皮的CCO活力下降最多。

图5 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)和外果皮(C)的CCO活力的变化Fig. 5 Changes in CCO activity in juice sacs (A), white cortex (B) and peel (C) of red-fleshed sweet pomelo during storage
2.2.3 红肉蜜柚冷藏过程中H+-ATPase活力的变化
H+-ATPase的主要作用是使细胞膜两侧产生H+电化学梯度,通过跨膜质子推动力催化合成ATP,维持细胞质相对稳定的pH值[24]。由图6A可知,贮藏10 d时冷藏果实汁胞的H+-ATPase活力低于对照组。贮藏至80 d时,冷藏组和对照组的汁胞H+-ATPase活力与采摘时相比分别下降了0.09 U/mg和0.35 U/mg。由图6B可知,冷藏果实白皮层的H+-ATPase活力在贮藏80 d时比对照组高2.89 U/mg。由图6C可知,冷藏果实外果皮的H+-ATPase活力在贮藏10 d内下降至最低,这可能是因为果实的外果皮直接接触到外界环境,而贮藏温度的下降降低了外果皮H+-ATPase的活力,冷藏果实外果皮的H+-ATPase活力在30~70 d均低于对照组。

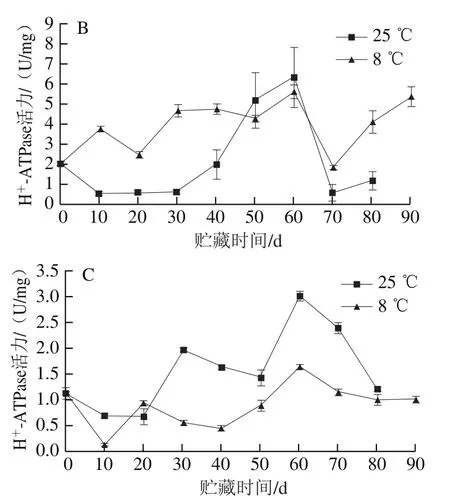
图6 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)和外果皮(C)H+-ATPase活力的变化Fig. 6 Changes in H+-ATPase activity in juice sacs (A), white cortex (B)and peel (C) of red-fleshed sweet pomelo during storage
2.2.4 红肉蜜柚冷藏过程中Ca2+-ATPase活力的变化
Ca2+-ATPase是细胞器膜上的钙离子泵,线粒体通过Ca2+-ATPase将钙离子从细胞质运输到线粒体内参与各种调节,是维持细胞稳态的重要机制之一,当其活性降低时,线粒体内钙离子浓度降低,细胞 升高,可导致线粒体受损[25]。
由图7A可知,冷藏组汁胞Ca2+-ATPase活力在前20 d先上升后下降。冷藏果实汁胞的Ca2+-ATPase活力在贮藏50 d时比对照组高1.96 倍,贮藏至80 d时,冷藏组和对照组汁胞Ca2+-ATPase活力比采摘时分别降低了42.34%和49.47%。
由图7B可知,两组果实的白皮层Ca2+-ATPase活力在整个贮藏过程中变化趋势相差较大,冷藏组白皮层Ca2+-ATPase活力在整个贮藏过程中高于对照组,可能是因为贮藏温度低抑制了外果皮的Ca2+-ATPase活力,其中贮藏至30 d时两组Ca2+-ATPase活力差值最大,达到23.26 U/mg。贮藏至80 d时,冷藏果实和对照组白皮层Ca2+-ATPase活力比采摘时分别上升了7.24 U/mg和下降5.98 U/mg。
由图7C可知,果实贮藏至60 d时外果皮出现Ca2+-ATPase活力高峰,此时冷藏外果皮Ca2+-ATPase活力比对照组低1.03 U/mg,贮藏至80 d时,冷藏果实和对照组外果皮Ca2+-ATPase活力比采摘时分别下降了0.35、0.25 U/mg。
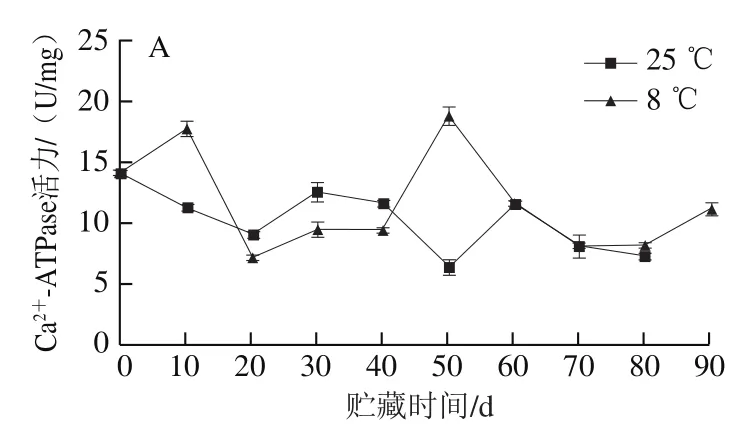
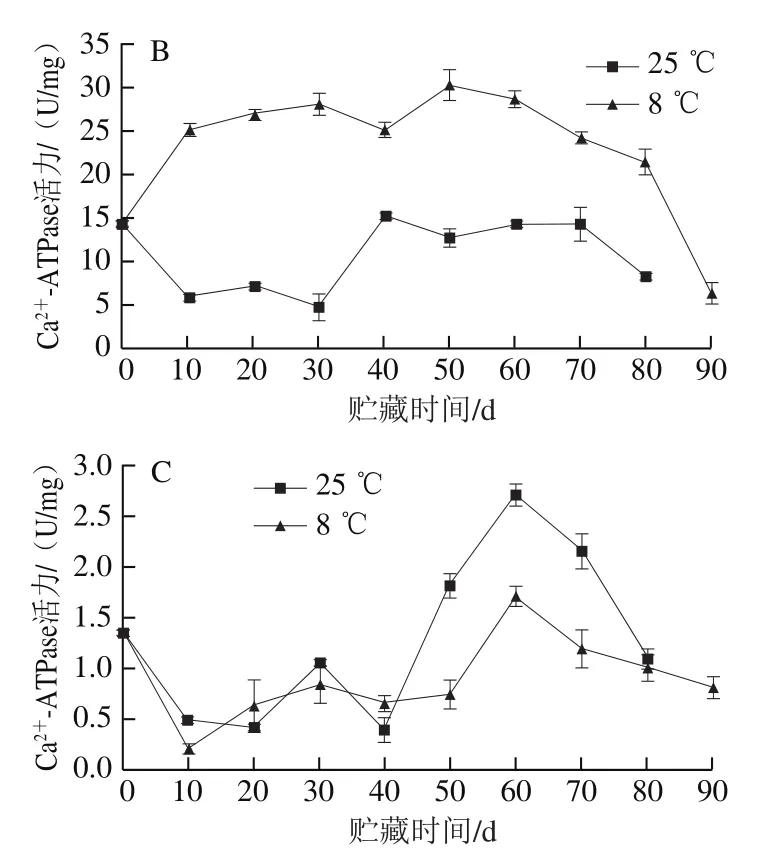
图7 红肉蜜柚贮藏过程中汁胞(A)、白皮层(B)、外果皮(C)Ca2+-ATPase活力的变化Fig. 7 Changes in Ca2+-ATPase activity in juice sacs (A), white cortex(B) and peel (C) of red-fleshed sweet pomelo during storage
2.3 果实贮藏过程中果皮与汁胞能量水平的变化
2.3.1 红肉蜜柚冷藏过程中汁胞能量水平的变化
能量是生物体生命活动的基础,果实衰老过程中会出现线粒体功能絮乱、能量水平下降的现象[26-27]。如图8A所示,红肉蜜柚果实汁胞ATP含量在贮藏过程中呈波动下降趋势,贮藏80 d时冷藏组汁胞的ATP含量是对照组的1.13 倍;贮藏50 d时,冷藏组汁胞的ADP含量是对照组的3.65 倍(图8B);汁胞的AMP含量变化呈现波动上升趋势,果实贮藏50 d后,冷藏果实汁胞的AMP含量低于对照组,贮藏至80 d时,冷藏组汁胞AMP含量比对照组低14.76%(图8C)。由图8D可知,随着果实贮藏时间的延长,汁胞EC呈下降趋势,冷藏至10 d时冷藏组汁胞EC快速下降,但是在贮藏20 d后冷藏组汁胞的EC高于对照组。结果表明,冷藏能通过保持果实汁胞较高的ATP、ADP含量,抑制汁胞中AMP含量的上升,维持果实汁胞较高的EC。
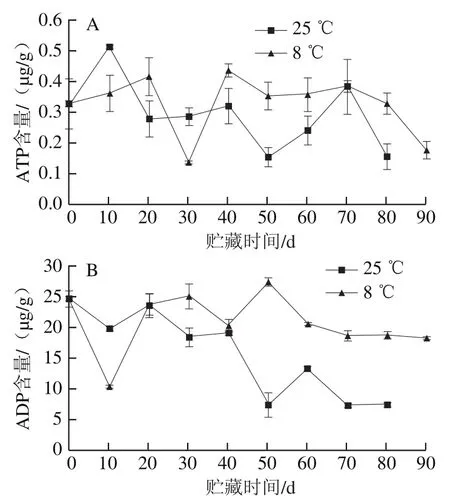
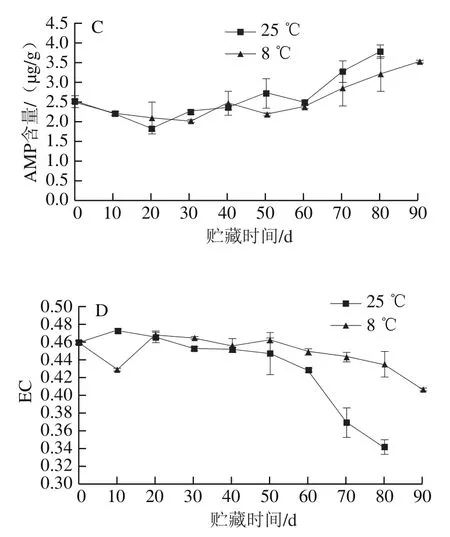
图8 红肉蜜柚贮藏过程中汁胞ATP(A)、ADP(B)、AMP(C)含量和EC(D)的变化Fig. 8 Changes in ATP (A), ADP (B), and AMP (C) contents and EC (D)in juice sacs of red-fleshed sweet pomelo during storage
2.3.2 红肉蜜柚冷藏过程中白皮层能量水平的变化
如图9A所示,冷藏组白皮层的ATP含量在贮藏的前10 d上升,贮藏至70 d时,冷藏组白皮层ATP含量是对照组的1.34 倍。贮藏至80 d后,冷藏组白皮层ADP含量比对照组高1.138 μg/g(图9B)。冷藏组白皮层的AMP含量低于对照组,贮藏10 d时冷藏组白皮层AMP含量比对照组低0.41 μg/g,随着贮藏时间的延长,AMP逐渐积累,贮藏至80 d时,冷藏组白皮层的AMP含量低于对照组(图9C)。由图9D可知,白皮层的EC总体呈下降趋势,整个贮藏过程中,冷藏组白皮层的EC高于对照组。结果表明,冷藏能保持较高的ADP的含量,抑制AMP含量的上升,维持果实白皮层较高的EC,延缓果实白皮层的衰老。
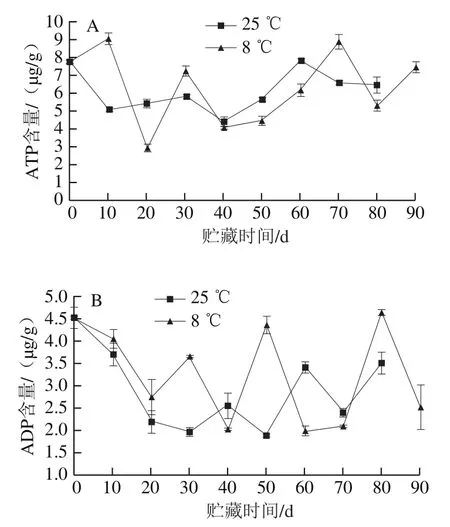

图9 红肉蜜柚贮藏过程中白皮层ATP(A)、ADP(B)、AMP(C)含量和EC(D)的变化Fig. 9 Changes in ATP (A), ADP (B), and AMP (C) contents and EC (D)in white cortex of red-fleshed sweet pomelo during storage
2.3.3 红肉蜜柚冷藏过程中外果皮能量水平的变化
如图10A所示,冷藏组果实外果皮的ATP含量在前10 d含量上升,在第10天时是对照组的1.42 倍,50 d时降至最低,贮藏至80 d时,冷藏组外果皮的ATP含量比对照组多0.2 μg/g。冷藏组外果皮的ADP含量在30 d出现最高值,比此时对照组高5.53 μg/g(图10B)。对照组外果皮的AMP含量在贮藏过程中逐渐增加,冷藏组外果皮的AMP含量在贮藏10 d时高于对照组,贮藏时间超过20 d后,冷藏组外果皮的AMP含量低于对照组,贮藏80 d时比对照组低1.87 μg/g(图10C)。外果皮EC水平呈降低趋势,贮藏至80 d时,冷藏外果皮的EC水平高于对照组(图10D)。结果表明,冷藏组果实外果皮贮藏至10 d时,ATP含量增加,ADP含量下降,AMP含量急剧增加,EC下降至低于对照组,可能是外果皮直接接触环境,贮藏温度下降导致的。因此,低温能通过保持果实外果皮在贮藏后期较高的ATP、ADP含量和EC水平,较低的AMP含量,延缓柚果的外果皮的衰老进程。
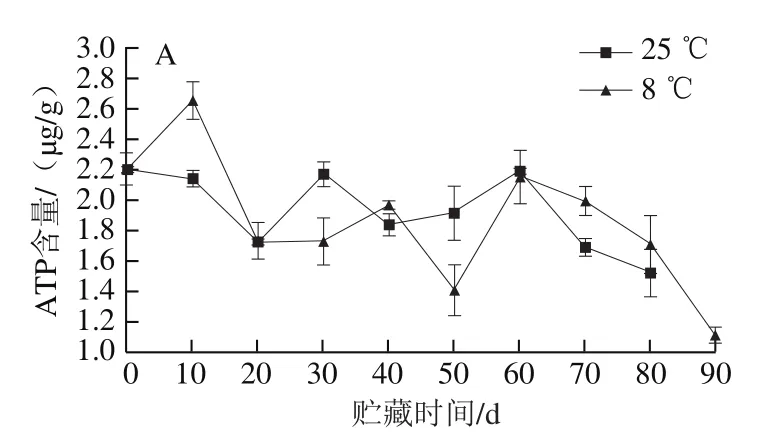
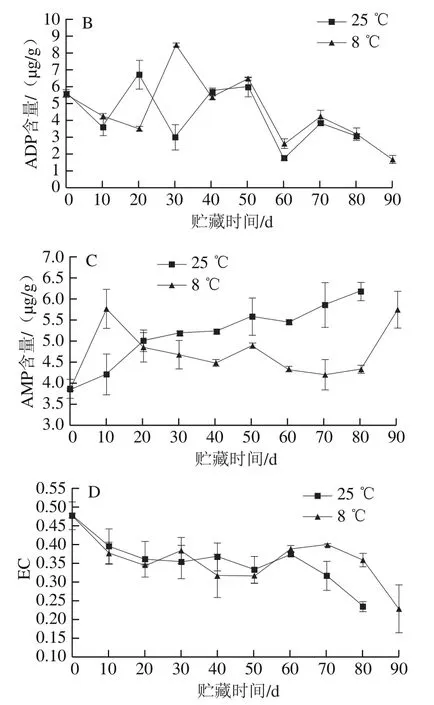
图10 红肉蜜柚贮藏过程中外果皮ATP(A)、ADP(B)、AMP(C)含量和EC(D)的变化Fig. 10 Changes in ATP (A), ADP (B), and AMP (C) contents and EC (D)in peel of red-fleshed sweet pomelo during storage
3 讨 论
红肉蜜柚果实汁胞发生粒化是果实衰老的表现之一,汁胞木质素含量上升是汁胞粒化的显著表现。本实验结果表明,随着贮藏时间的延长,对照组汁胞的木质素含量和可溶性固形物质量分数呈上升趋势,经相关性分析可得,汁胞木质素含量与可溶性固形物质量分数呈显著正相关(r=0.642,P<0.05),与汁胞、白皮层和外果皮的水分质量分数呈负相关,相关系数分别为-0.513、-0.674和-0.752;表明果实汁胞发生枯水可能跟果实的水分含量有关。与对照组相比,冷藏能延缓汁胞木质素的积累和可溶性固形物质量分数的上升,保持汁胞、白皮层和外果皮的水分质量分数。
能量水平与H+-ATPase、Ca2+-ATPase、SDH和CCO的活性密切相关,H+-ATPase通过在细胞膜两侧建立H+电化学梯度,产生跨膜质子推动力催化合成ATP;Ca2+-ATPase是细胞器膜上的钙离子泵,将钙离子从细胞质运输到线粒体内调节各种反应;SDH在三羧酸循环中催化琥珀酸转化成延胡索酸,同时产生H+,最后生成ATP;CCO主要通过氧化磷酸化过程为细胞提供能量,是线粒体呼吸链上氧化磷酸化过程中的关键酶[22-25]。本实验研究发现,汁胞木质素含量与汁胞的能量代谢相关酶ATPase-H+、ATPase-Ca2+、SDH、CCO的活力呈负相关,表明汁胞发生粒化与能量代谢有关。冷藏能通过保持果实贮藏后期汁胞和白皮层的CCO、H+-ATPase、Ca2+-ATPase以及SDH活性,保证三羧酸循环的顺利进行,保持果实较好的品质,延长果实的贮藏保鲜期;外果皮的SDH和CCO活力大于白皮层和汁胞,这可能是由于外果皮是果实直接接触外部环境的部位,需要提供更多的能量保持外果皮细胞的完整性从而抵抗外部不良因素;红肉蜜柚各部位中,H+-ATPase活力由高到低为白皮层>外果皮>汁胞,Ca2+-ATPase活力由高到低为汁胞>白皮层>外果皮,具体原因有待进一步研究。
荔枝采后经过外源ATP处理能维持果皮组织内较高的ATP含量和EC水平,延缓果实衰老进程[28]。用茉莉酸甲酯处理采后枇杷果实,能在贮藏期间维持其较高的EC水平和ATP含量,从而减轻了炭疽病害,延缓枇杷果实的衰老[29],本实验发现,汁胞木质素含量与汁胞、白皮层和外果皮的能量物质ATP、ADP和EC水平呈负相关,与汁胞、白皮层和外果皮的AMP含量呈正相关,相关系数分别为0.657、0.869和0.847,其中与白皮层和外果皮的AMP含量呈显著正相关(P<0.05),表明汁胞粒化的发生与果实内的能量物质和能荷水平有关。
在贮藏过程中,果实不同部位的能量相关物质含量和EC水平变化差异较大,对照组果实贮藏至80 d时,与刚采摘时相比,汁胞、白皮层和外果皮的ATP含量分别下降了52.83%、17.5%和30.85%,ADP含量分别下降了69.6%、22.64%%和44.97%,AMP含量分别增加了49.94%、53.67%和60.40%,EC水平分别下降了25.73%、21.98%和50.88%,可见,果实汁胞的ATP和ADP含量下降程度均大于外果皮和白皮层,外果皮的AMP含量的增加程度和EC水平的下降程度大于汁胞和白皮层,猜测可能在柚果内部的不同部位之间存在能量互通,导致柚果在贮藏过程中出现汁胞发生枯水而外果皮无明显病变的现象。
4 结 论
采摘后的红肉蜜柚果实随着贮藏时间的延长逐渐衰老,汁胞的木质素含量逐渐增加,果实汁胞、白皮层和外果皮的ATP、ADP和EC水平下降,AMP含量增加,表明果实汁胞粒化与能量代谢有关;与对照组相比,冷藏能通过维持果实贮藏后期汁胞、白皮层的SDH、CCO、H+-ATPase、Ca2+-ATPase活力,保持ATP、ADP和EC水平,抑制AMP含量上升,保持汁胞、白皮层的水分,抑制红肉蜜柚果实中汁胞木质素的积累和可溶性固形物质量分数的上升,从而保持较好的果实品质,延长果实的贮藏保鲜期。
