牛乳源促睡眠肽的体外抗氧化活性评价及对秀丽隐杆线虫的体内抗氧化作用
2022-04-01刘星雨曹素芳朱秋轶曾志安李一峰陈运娇
刘星雨,曹素芳,朱秋轶,曾志安,刘 前,李 俊,刘 果,李一峰,陈运娇,曹 庸,*
(1.华南农业大学食品学院,广东 广州 510642;2.澳优乳业(中国)有限公司,湖南 长沙 410200)
人一生中大约有1/3的时间在睡觉[1],熬夜与晚睡已经成为现代人的标签,睡眠问题也成为全球最为关注的热点之一。现阶段,市场上出现了越来越多的促睡眠产品,包括苯二氮卓、巴比妥酸盐和唑吡坦类药物,然而,长期使用这些合成物质会导致一些副作用,包括失忆、共济失调等[2-3]。为了克服这些药物带来的副作用,一类新的具有改善睡眠效果的天然产物受到了人们的广泛关注。
牛乳源生物活性肽是指牛乳中游离的活性肽和经过酶解后乳蛋白释放出来的活性肽,具有多种活性(如免疫调节[4]、抗菌[5]、抗氧化、降血压、促睡眠等[6]),目前已被广泛应用于各种功能性食品的研究中。有研究发现,牛乳源促睡眠肽具有促进睡眠的特性,具有促进戊巴比妥钠诱导的小鼠睡眠效果[7]。同时,对睡眠障碍人群具有减缓相关症状的作用[8],其对正常睡眠人群无副作用,且还具有镇痛、增强免疫等功能,长期服用牛乳源促睡眠肽的受试者其睡眠质量指数得分显著提高,睡眠质量得到提升[9]。
睡眠被认为有两种调控机制:一种为昼夜节律系统;一种为睡眠稳态机制[10-11]。有研究人员通过减少野生型果蝇的氧化应激,发现野生型果蝇的睡眠质量也有所降低,表明氧化应激可能会通过睡眠稳态系统调节睡眠,并且验证了睡眠和氧化应激之间可能存在双向关系,即氧化应激会诱导睡眠,而睡眠对身体和大脑起着抗氧化剂的作用[12]。本课题组前期研究发现牛乳经过胰蛋白酶水解后再进行等电点沉淀的牛乳源促睡眠肽,其活性成分主要为4 条含14~19 个氨基酸的活性肽段,相对含量为13.28%,采用全细胞膜片钳技术检测发现其具有较好的促睡眠效果[13]。但牛乳源促睡眠肽的促睡眠效果是否与氧化应激有关需要进一步研究。
鉴于此,本实验采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基、超氧阴离子自由基和羟自由基清除能力测定4 种体外抗氧化方法评价牛乳源促睡眠肽的抗氧化性,以及运用体内线虫模型测定牛乳源促睡眠肽的抗氧化应激效果。以期为牛乳源促睡眠肽的抗氧化应激功效提供有效的理论数据,也为今后研发具有高效、无毒、天然的功能食品提供参考。
1 材料与方法
1.1 材料与试剂
野生型秀丽隐杆线虫(the Bristol strain N2),雌雄同体,北京市生命科学研究院惠赠。
牛乳源促睡眠肽 广东省绿萃生物科技有限公司;抗坏血酸、ABTS 上海易恩化学技术有限公司公司;DPPH 西安莱恩生物科技有限公司;生化分析试剂盒均购于南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
EnSpire酶标仪 美国PerkinElmer公司;LRH系列生化培养箱 上海一恒科技有限公司;体视显微镜重庆奥特光学仪器有限公司。
1.3 方法
1.3.1 体外抗氧化活性的测定
1.3.1.1 DPPH自由基清除活性
参考陈树俊等[14]的方法并略作改动,用蒸馏水配制DPPH反应溶液(0.5 mmol/L,超声30 min,现配现用),避光保存(0~4 ℃),现配现用。取96 孔板,每孔中加入50 μL 0.1 mg/mL牛乳源促睡眠肽样品和150 μL DPPH反应液,混匀后室温下避光反应30 min,用酶标仪在517 nm波长处测定吸光度(A2),其中蒸馏水与DPPH反应液混匀的吸光度为样品对照(A0);蒸馏水代替DPPH反应液的吸光度为空白(A1)。以0.1 mg/mL抗坏血酸作为阳性对照组。每个样品3 组平行,取平均值。DPPH自由基清除率按公式(1)计算。
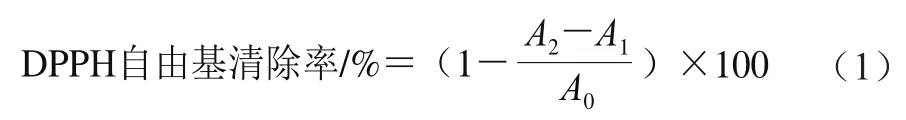
1.3.1.2 ABTS阳离子自由基清除活性
参考马思彤等[15]的方法并略作改动。利用蒸馏水配制7 mmol/L的ABTS溶液和2.45 mmol/L过硫酸钾溶液。将ABTS溶液和过硫酸钾溶液以体积比1∶1混匀,在避光23 ℃条件下放置12~16 h,形成ABTS阳离子自由基储备液后置于4 ℃条件下储存。使用前用蒸馏水对ABTS阳离子自由基溶液进行适当的稀释(约20~25 倍),使稀释后的溶液在734 nm波长处的吸光度为0.70±0.02,得到ABTS阳离子自由基工作液。在96 孔板每孔中加入100 μL 0.1 mg/mL的牛乳源促睡眠肽样品以及100 μL ABTS阳离子自由基工作液混匀,在30 ℃条件下反应10 min,用酶标仪在734 nm波长处测定吸光度(A2),其中蒸馏水与ABTS阳离子自由基工作液混匀的吸光度为样品对照(A0);蒸馏水代替ABTS阳离子自由基工作液与样品混匀的吸光度为空白(A1)。以0.1 mg/mL抗坏血酸作为阳性对照组。每个样品3 组平行组,结果取平均值。ABTS阳离子自由基清除率按公式(2)计算。
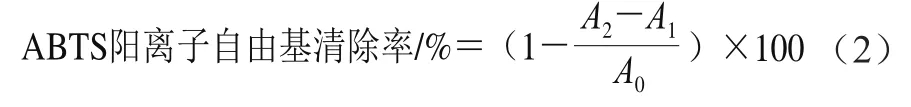
1.3.1.3 超氧阴离子自由基清除活性
参考李军等[16]的方法并略作改动。取96 孔板,每孔中加入120 μL Tris-HCI溶液(50 mmol/L、pH 8.2),25 ℃培养箱中预热25 min后加入40 μL 0.1 mg/mL牛乳源促睡眠肽样品和20 μL邻苯三酚溶液(25 mmol/L),在25 ℃下反应5 min后加入20 μL盐酸溶液(8 mol/L)以终止反应,用酶标仪测定420 nm波长处的吸光度(A2),其中蒸馏水代替样品的吸光度为空白(A0);蒸馏水代替邻苯三酚溶液的吸光度为样品对照(A1)。以0.1 mg/mL抗坏血酸作为阳性对照组。每个样品3 组平行组,结果取平均值。超氧自由基清除率按公式(3)计算。
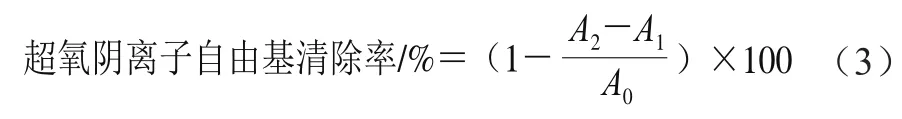
1.3.1.4 羟自由基清除活性
参考丁丽丽等[17]方法并略作改动。取96 孔板,每孔中加入20 μL 0.1 mg/mL牛乳源促睡眠肽样品、60 μL硫酸亚铁溶液(3 mmol/L)、60 μL过氧化氢溶液(9 mmol/L),在37 ℃下恒温预热10 min后加入60 μL水杨酸乙醇溶液(6 mmol/L),继续37 ℃恒温预热30 min,用酶标仪在510 nm波长处测定吸光度(A2),其中蒸馏水代替样品的吸光度为空白(A0);蒸馏水代替过氧化氢溶液与硫酸亚铁溶液混合液的吸光度为样品对照(A1)。以0.1 mg/mL抗坏血酸作为阳性对照组。每个样品3 组平行组,结果取平均值。羟自由基清除率按公式(4)计算。
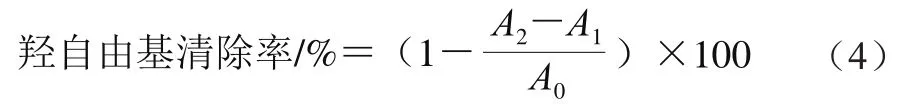
1.3.2 秀丽隐杆线虫体内抗氧化实验
1.3.2.1 秀丽隐杆线虫培养和同期化处理
秀丽隐杆线虫的培养使用线虫生长培养基(nematode growth medium,NGM),在表面涂布有OP50大肠杆菌作为线虫的食物,于20 ℃恒温恒湿培养箱中培养。
本文实验所用线虫均为经过同期化处理生长至L4期的线虫,体内活性实验牛乳源促睡眠肽的应用质量浓度为1 mg/mL。根据Lin Chunxiu等[18]的方法,采用高氯酸钠裂解法对线虫进行同期化处理。
1.3.2.2 秀丽隐杆线虫给药
实验操作参考王晋等[19]的方法并略作改动,配制1 mg/mL牛乳源促睡眠肽溶液,过滤除菌后,与大肠杆菌OP50菌液以质量比1∶9混合均匀,样品组吸取100 μL牛乳源促睡眠肽溶液与大肠杆菌OP50菌液混合溶液于NGM平板上喂养秀丽隐杆线虫,空白组吸取100 μL大肠杆菌OP50菌液于NGM平板上喂养秀丽隐杆线虫。此条件下,药物通过秀丽隐杆线虫摄食而进入到秀丽隐杆线虫体内,并根据不同实验要求喂养至不同时期再进行实验测定。
1.3.2.3 正常寿命测定
寿命的测定是为了判断牛乳源促睡眠肽在抗氧化的同时,是否会对秀丽隐杆线虫寿命产生影响。实验操作参考王晋等[19]的方法并略作改动,将产卵期的秀丽隐杆线虫挑至涂有样品(或者空白组)的培养基上进行产卵同期化,待秀丽隐杆线虫孵化生长至L4期后,将秀丽隐杆线虫转移到新的NGM板中,此后每隔1 d转移一次,以排除它们后代的影响。秀丽隐杆线虫死亡的数量根据它们是否对刺激有反应来确定。在统计分析中,不计算培养基内孵化或逃离培养基的秀丽隐杆线虫。秀丽隐杆线虫平均寿命计算见公式(5)。中位寿命是指存活率等于50%的培养时间;最长寿命是指存活率等于0的培养时间。
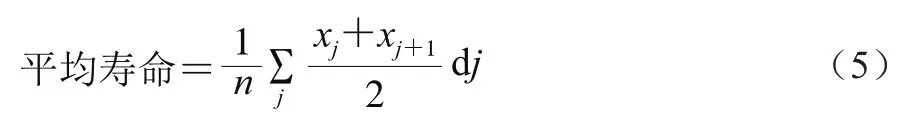
式中:j是秀丽隐杆线虫寿命/d;dj是死于年龄区间(xj,xj+1)秀丽隐杆线虫的数量;n是秀丽隐杆线虫的总数。
1.3.2.4 H2O2诱导的氧化应激寿命测定
H2O2诱导的氧化应激实验操作参考Lin Chunxiu等[20]的方法并略作改动,挑取60 只已给药3 d的秀丽隐杆线虫暴露于稀释了1 000 倍的体积分数30%过氧化氢诱导的氧化应激压力下。每隔30 min观察并记录各组秀丽隐杆线虫的死亡情况,直至所有秀丽隐杆线虫死亡,秀丽隐杆线虫死亡判定标准同1.3.2.3节。
1.3.2.5 热应激下的寿命测定
热应激实验操作参考Li Wei等[21]的方法并略作改动,将L4期的秀丽隐杆线虫从20 ℃的培养箱转移到37 ℃培养箱中培养,每1 h观察并记录各组秀丽隐杆线虫的死亡情况,直至所有秀丽隐杆线虫死亡,秀丽隐杆线虫死亡判定标准同1.3.2.3节。
1.3.2.6 生殖能力测定
实验操作参考王凤等[22]的方法并略作改动,将同期化后L4期的秀丽隐杆线虫每组挑取2 条秀丽隐杆线虫单独饲养,此时记为第1天。然后,每24 h将秀丽隐杆线虫转至新NGM培养基,直至生殖能力丧失(培养基上不产生新的虫卵)。20 ℃下孵育产卵板(带有线虫卵的NGM培养基),48 h后计数子代数目,即产卵量,以此评价秀丽隐杆线虫的生殖能力。
1.3.2.7 头部摆动次数测定
实验操作参考王晋等[19]的方法并略作改动,将L4期的秀丽隐杆线虫转移到样品组和空白对照组秀丽隐杆线虫生长培养基中,在第4、8天和第12天时观察秀丽隐杆线虫在30 s内的头部摆动次数,以此评价秀丽隐杆线虫的运动能力。
1.3.2.8 移动能力测定
实验操作参考王晋等[19]的方法并略作改动,在寿命实验期间进行移动能力测定,在第3、7、11天观察并记录秀丽隐杆线虫的移动能力。记录标准:1)秀丽隐杆线虫自发运动,不需要触碰刺激,记为A;2)秀丽隐杆线虫必须受到触碰刺激才运动,记为B;3)秀丽隐杆线虫受到触碰刺激后只摆动头或尾,记为C。记录各移动能力秀丽隐杆线虫所占的比例。
1.3.2.9 体内抗氧化效果指标测定
根据Lin Chunxiu等[23]的方法,将同期化并升温处理后的秀丽隐杆线虫冲洗并收集至EP管中,用裂解液重悬冰上匀浆,然后。按照试剂盒的说明书对秀丽隐杆线虫匀浆液中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力和丙二醛(malondialdehyde,MDA)含量,结果以蛋白质量计。
1.4 数据处理与分析
所有实验均至少重复3 次,结果以平均值±标准差表示,并通过SPSS 19.0软件对两组间的比较采用t检验进行显著性分析,P<0.05为显著差异,P<0.01为极显著差异。其中,生存曲线使用GraphPad(Windows 5.00版)软件进行log-rank检验分析显著性。
2 结果与分析
2.1 牛乳源促睡眠肽对4 种体外抗氧化活性指标的影响
由表1可知,牛乳源促睡眠肽具有较强的DPPH自由基(44.27%)和ABTS阳离子自由基(24.83%)清除能力,相同质量浓度下,效果均与阳性对照抗坏血酸无显著差异(P>0.05)。牛乳源促睡眠肽也具有一定的羟自由基(18.37%)和超氧阴离子自由基(37.22%)清除能力,相同质量浓度下,效果分别为阳性对照抗坏血酸的70.46%和78.11%。因此,牛乳源促睡眠肽具有较好的体外抗氧化能力,下面进一步探究其是否具有体内抗氧化以及延缓衰老的能力。
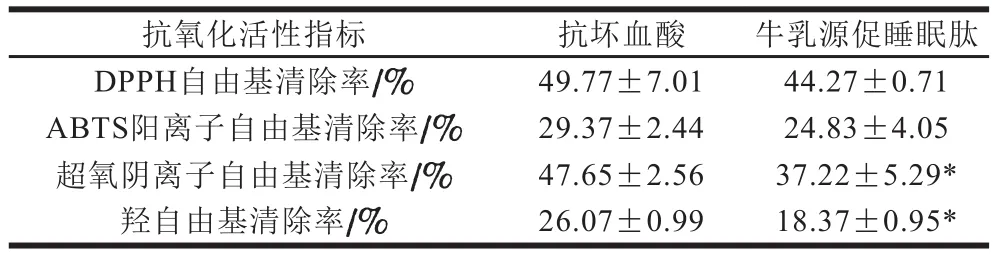
表1 牛乳源促睡眠肽的抗氧化活性Table 1 Antioxidant activity of milk-derived sleep-promoting peptide
2.2 牛乳源促睡眠肽对秀丽隐杆线虫氧化衰老的影响
2.2.1 对体内抗氧化酶活力及MDA含量的影响
抗氧化防御系统为机体发挥抗氧化性重要的组成部分[24]。由图1A~C可知,与空白组相比,样品组的SOD、CAT、GSH-Px活力分别提高了52.3%、32.7%、60.7%(P<0.05、P<0.01)。MDA是生物体内脂质氧化产生的一种天然产物,其含量被广泛应用于反映脂质氧化程度[22]。由图1D可知,样品组具有更低的MDA含量,样品组比空白组极显著降低了46.9%(P<0.01)。以上数据表明,牛乳源促睡眠肽可能在一定程度上提高秀丽隐杆线虫体内抗氧化能力,延缓秀丽隐杆线虫的氧化损伤和衰老,具有激活秀丽隐杆线虫抗氧化防御系统的潜力。
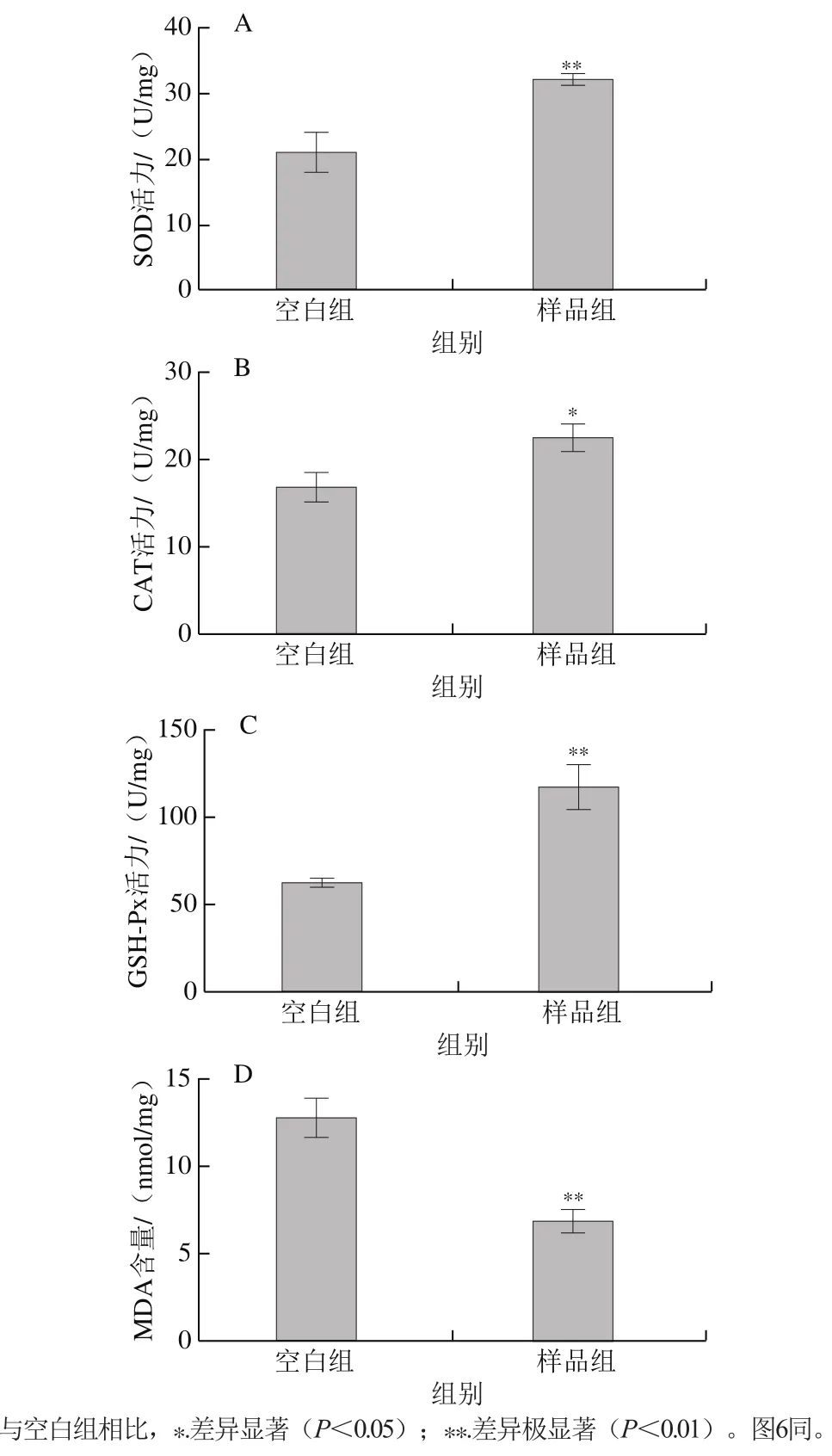
图1 牛乳源促睡眠肽对秀丽隐杆线虫体内SOD(A)、CAT(B)、GSH-Px(C)活力和MDA含量(D)的影响Fig. 1 Effect of milk-derived sleep-promoting peptide on activities of SOD (A), CAT (B), GSH-Px (C) and MDA content (D) in C. elegans
2.2.2 对正常寿命的影响
由图2可知,与空白组相比,样品组秀丽隐杆线虫生存曲线明显右移。由表2可知,与空白组相比,样品组秀丽隐杆线虫的平均寿命、中位寿命和最长寿命都得到极显著延长(P<0.01)。说明牛乳源促睡眠肽能明显延长秀丽隐杆线虫的寿命。
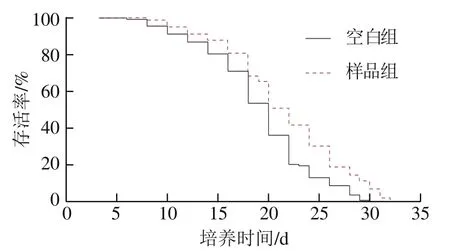
图2 正常条件下秀丽隐杆线虫的生存曲线Fig. 2 Survival curves of C. elegans under normal conditions
表2 秀丽隐杆线虫存活时间统计分析Table 2 Statistical analysis of survival time of C. elegans
2.2.3 对秀丽隐杆线虫抗氧化应激性的影响
如图3所示,在H2O2急性氧化胁迫下,牛乳源促睡眠肽促使线虫生存曲线向右移。由表2可知,与空白组相比,样品组秀丽隐杆线虫的平均寿命得到极显著延长(P<0.01),最长寿命得到显著延长(P<0.05)。说明牛乳源促睡眠肽具有提高线虫的抗氧化应激的潜力。
图3 H2O2诱导的氧化胁迫下秀丽隐杆线虫的生存曲线Fig. 3 Survival curve of C. elegans under H2O2-induced oxidative stress
2.2.4 对秀丽隐杆线虫抗热应激的影响
如图4所示,在37 ℃急性热应激环境下,牛乳源促睡眠肽促使秀丽隐杆线虫生存曲线明显右移。由表2可知,与空白组相比,样品组秀丽隐杆线虫的平均寿命和中位寿命都得到极显著延长(P<0.01),最长寿命延长了5.62%。说明牛乳源促睡眠肽具有提高秀丽隐杆线虫抗热应激的潜力。
图4 热应激胁迫下秀丽隐杆线虫的生存曲线Fig. 4 Survival curve of C. elegans under heat shock stress
2.2.5 对生殖能力的影响
有研究表明,秀丽隐杆线虫的寿命与生殖能力之间存在“利弊权衡(trade off)”,即延长寿命将以降低或丧失生殖能力为代价[25]。如图5所示,与空白组相比,样品组的产卵量虽然在第2天时有所降低,但秀丽隐杆线虫的总产卵量并无显著差异,因此认为牛乳源促睡眠肽不会损害秀丽隐杆线虫的生殖能力。
图5 牛乳源促睡眠肽对秀丽隐杆线虫生殖能力的影响Fig. 5 Effect of milk-derived sleep-promoting peptide on the fertility of C. elegans
2.2.6 对运动能力的影响
如图6所示,随着培养时间延长,秀丽隐杆线虫的头部摆动次数逐渐减少,说明在秀丽隐杆线虫的衰老过程中,其运动行为能力逐渐下降。与空白组相比,样品组秀丽隐杆线虫在第4天和第8天的头部摆动次数没有显著差异(P>0.05),但样品组秀丽隐杆线虫在第12天的头部摆动次数显著提高(P<0.05)。对比空白组,样品组秀丽隐杆线虫的头部摆动次数在培养前8 d没有显著降低,在第12天时显著增加,说明牛乳源促睡眠肽在延长秀丽隐杆线虫寿命和对生殖能力没有显著影响的前提下,没有对秀丽隐杆线虫的运动行为能力造成不利影响,反而在生命后期对运动能力有促进作用。
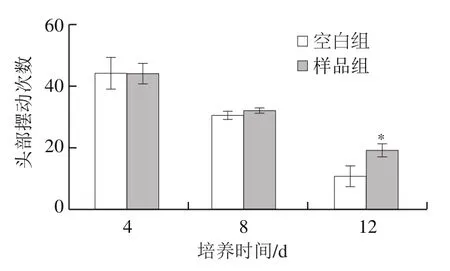
图6 牛乳源促睡眠肽对秀丽隐杆线虫的头部摆动次数的影响Fig. 6 Effect of milk-derived sleep-promoting peptide on head swinging frequency of C. elegans
2.2.7 对移动能力的影响
有研究表明,秀丽隐杆线虫的衰老伴随着移动能力及对外界机械刺激反应的退化[26]。如图7所示,牛乳源促睡眠肽能明显提高秀丽隐杆线虫移动能力,在生命后期(第11天)尤其显著。说明促睡眠肽具有提高秀丽隐杆线虫抗衰老的潜力。
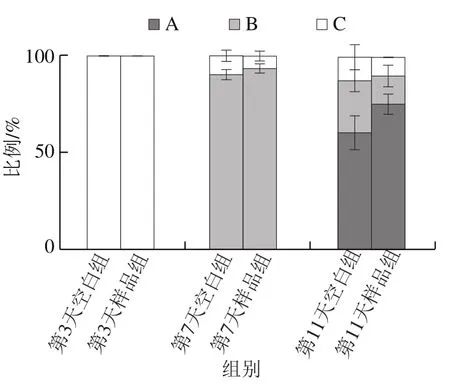
图7 牛乳源促睡眠肽对秀丽隐杆线虫移动能力的影响Fig. 7 Effect of milk-derived sleep-promoting peptide on the locomotivity of C. elegans
3 讨 论
本实验采用了DPPH自由基、羟自由基、超氧阴离子自由基和ABTS阳离子自由基清除能力测定4 种体外自由基清除方法评价牛乳源促睡眠肽的抗氧化活力,结果表明,牛乳源促睡眠肽在体外能有效清除自由基,具有良好的抗氧化活性,其中DPPH自由基和ABTS阳离子自由基清除能力与阳性对照组无显著差异,清除率分别为49.77%和29.37%,说明牛乳源促睡眠肽的体外抗氧化性可能与其DPPH自由基和ABTS阳离子自由基的清除能力密切相关;对羟自由基和超氧阴离子自由基也有较好的清除效果,清除率分别为26.07%和47.65%。
氧化应激被认为是导致秀丽隐杆线虫衰老的关键因素,秀丽隐杆线虫的抗氧化应激能力和寿命有较好的相关性[27],寿命会随着抗氧化应激能力的提高而提高[28]。本次实验中牛乳源促睡眠肽处理后的秀丽隐杆线虫体内SOD、CAT和GSH-Px 3 种抗氧化酶活力显著提高,MDA含量显著降低,并且其在正常、H2O2和热应激氧化应激条件下秀丽隐杆线虫的存活率显著增加,移动能力和头部摆动次数与空白组相比没有显著降低。说明牛乳源促睡眠肽在对秀丽隐杆线虫移动能力没有负面影响的同时能有效延长秀丽隐杆线虫的寿命,增强其对外界压力的抗逆性。
此前有研究发现,氧化应激与睡眠存在着双向关系[12]。近期也有研究报道,长期不睡觉可能会因为肠道中活性氧(reactive oxygen species,ROS)的大量积累导致猝死[29]。过量ROS诱导的氧化应激会导致细胞结构和生物分子功能损伤[30]。中和ROS可以使果蝇在很少或没有睡眠的情况下正常存活,说明促睡眠物质的促睡眠作用可能与抗氧化活性密切相关。本实验综合体内和体外的实验结果发现牛乳源促睡眠肽能有效清除自由基和提高机体抗氧化应激能力。
本研究初步表明牛乳促睡眠肽可作为天然的食品抗氧化剂加以开发利用,为以后牛乳源促睡眠肽在功能食品方面的进一步研究提供理论和实验参考,但是其产生抗氧化作用的具体作用机制还需要后续进一步的研究。
