人类弯曲菌病感染来源研究进展
2022-04-01汪淑颖
李 轩,汪淑颖,向 红
人类弯曲菌病是全球细菌性腹泻病最流行和最普遍的原因之一,其症状包括腹泻、腹部绞痛、呕吐和发烧,通常持续1周左右。然而,有时病症会变得复杂,特别是在婴儿、老年和免疫缺陷患者中,可导致吉兰-巴雷综合征(格林-巴利综合征)和米勒-费希尔综合征等。该病的病原体弯曲菌是人类最常见的胃肠道细菌,每年引起全球约1.66亿腹泻病例[1],在腹泻疾病中约占5.0%至14.0%[2]。迄今为止,弯曲菌属包括32个菌种和9个亚种,这些菌种聚集在5个不同的系统发育群中(胎儿弯曲菌群、空肠弯曲菌群、海鸥弯曲菌群、简明弯曲菌群和解脲弯曲菌群),每群都含有致病菌,表现整个属的临床相关性,其中空肠弯曲菌和结肠弯曲菌是人类感染的主要病原菌,占所有报告中人类弯曲菌病病例的95.0%[3]。弯曲菌在自然界中广泛存在,它自然定殖在温血动物的肠道中,包括家禽、家畜、野鸟和野生动物等。部分流行病学研究表明,这些动物是人类感染的潜在宿主。同时,动物宿主也是食物和环境污染的重要来源,但弯曲菌的传播来源、传播链尚未完全揭示。此外,还有部分弯曲菌自然定殖在人类口腔中,可能会引起肠道疾病。本文针对人类弯曲菌病感染的来源进行概述,为降低人类弯曲菌感染风险提供指导。
1 外源性感染
1.1 家 禽
1.1.1 家禽感染与定殖 家禽是弯曲菌的主要宿主之一,因其体温较高,一旦弯曲菌感染家禽群,即使数量低至40个菌落形成单位(CFU),它也能迅速传播,并在家禽的泄殖腔、盲肠和大肠中大量定殖,粪便中高达109CFU/g[4]。在弯曲菌感染鸡的模型中,用104CFU或仅30个CFU(一次摄入)空肠弯曲菌口服感染的1日龄雏鸡,在3日内盲肠达到最大定殖(1×1010CFU/g盲肠),且在鸡的整个生命周期中保持在较高水平(106~108CFU/g)[5]。有研究显示,弯曲菌出现在孵化后第1周末的一些雏鸡中,随后2~3周龄时在整个鸡群中迅速传播[6]。由于鸡有食粪的特性,从受感染的鸡中摄取排泄粪便是鸡群感染传播的主要机制[7]。
1.1.2 家禽感染的影响因素 许多调查显示,家禽中弯曲菌的感染率各不相同,主要与养殖方式、养殖规模、家禽种类、地理区域、感染弯曲菌种类、季节、抗生素的使用、生物安全相关的农场管理卫生措施等有关。英国有机和自由放养的鸡群中,95.0%~100.0%的鸡群感染弯曲菌,而在标准养殖的鸡群中有55.0%的感染[8]。南非传统生产系统和工业生产系统鸡群中的弯曲菌感染水平明显不同,农村庭院散养、工业标准养殖系统中弯曲菌的感染率分别为68.0%、47.0%[9]。马来西亚开放式和封闭式饲养的鸡群中,弯曲菌感染率分别为46.7%~86.7%和0%~6.7%[10]。这些研究揭示了弯曲菌在家禽自由放养系统中的高感染率,因此,基于自由生产系统的广泛采用和食品安全的重要性,由自由生产系统引起食源性弯曲菌病的传播应引起高度重视。在不同家禽种类中,鸭比鸡更容易受到弯曲菌的感染[11-12]。季节温度变化是影响家禽中弯曲菌感染率的又一因素,Greige等研究显示夏、秋季家禽弯曲菌感染率高于冬、春季[13]。空肠和结肠弯曲菌是家禽携带的主要弯曲菌菌种,尽管空肠弯曲菌在家禽中普遍占优势,但空肠/结肠弯曲菌的比例在各国间差异很大,如保加利亚、匈牙利、意大利、马耳他、葡萄牙、西班牙和希腊等南欧国家家禽以结肠弯曲菌为优势,其中大部分国家环绕地中海,这可能与地理区域相关[14-16]。即使是相同菌株,因其变异对家禽的感染性不一样,如弯曲菌两个直突变体(pgp1或pgp2)的定殖减弱,1周后盲肠的负荷降低2~3个对数级;通过在第2个位点重新表达该基因,pgp1突变体的定殖负荷可以恢复到野生型水平[17]。抗生素用于家禽治疗细菌性病原体,使用抗生素可引起家禽微生物群发生变化,导致弯曲菌在家禽肠道中高度定殖[18]。目前尚不清楚这种结果是否与弯曲菌的粘附和侵袭率的变化直接相关,但细菌生物群的改变、可溶性因子的释放、肠屏障功能的改变或免疫相关机制的改变等为弯曲菌侵袭提供一个合适的环境,从而增加其进入食物链的风险[19]。养殖过程中感染弯曲菌的家禽是传播病原菌、引起人类感染弯曲菌的重要源头,因此在家禽养殖生产系统中采取有效的卫生管理措施是减少家禽弯曲菌感染的关键,其策略包括:1)减少环境暴露,如采用生物安全措施;2)增加家禽宿主抵抗力,以减少弯曲菌在肠道内的携带,如竞争性排斥、疫苗接种和宿主遗传选择;3)通过使用抗菌替代品减少和消除定殖鸡体内的弯曲菌。
1.1.3 食源性暴露 人类感染弯曲菌主要与食用受污染的禽肉有关,涉及禽类食品整个生产链,如在屠宰过程中,没有任何工艺消除该病原生物体,肠道内容物将污染禽肉。欧盟的7个成员国中,屠宰场和销售场所中分别有41%和13%的肉鸡胴体受弯曲菌污染,15%和7%样本的菌落总数超过1 000 CFU/g。基于欧洲国家数据的定量风险评估,屠宰时鸡肠道弯曲菌的数量减少3log10菌落形成单位可使人类感染的风险降低58%[20]。
尽管养殖、屠宰过程中家禽的弯曲菌检出率较高,但由于它不能反映人群暴露最初接触点,故不一定与最终消费者的风险水平相关。而受污染家禽肉产品可为人类食源性弯曲菌感染的直接来源,英国大约61.0%的零售鸡肉受到弯曲菌污染[21],美国零售店的生禽肉弯曲菌污染率为70.7%[22]。在加拿大新斯科舍省出售的原包装鸡肉中,有65.0%受到弯曲菌的污染,且从鸡肉中分离出来的弯曲菌与人类临床病例中分离的菌株存在遗传关联[23]。在瑞士,与其他欧洲国家一样,弯曲菌病为目前报告最常见的食源性疾病,高达70.0%的病例可归因于食用鸡肉[24]。在日本,有吃生/轻烤鸡肉的饮食文化,这种传统的饮食习惯可能与日本弯曲菌引起的食源性疾病发病率较高有关。事实上,2017年日本1 014起食物中毒事件中,有320起(31.6%)由弯曲菌引起[25]。在一些国家,家禽肉被认为是造成20.0%~40.0%的散发性感染病例的罪魁祸首[22]。据估计,若鸡胴体上的弯曲菌数量减少两个对数级可使人类感染弯曲菌的机会降低30倍[21]。在许多国家,鸭肉也是向人类传播弯曲菌的一个重要来源,从零售鸭肉中分离到弯曲菌的频率(62.3%)高于鸡肉(50.4%)[26]。在英国,食用被弯曲菌污染的鸭肉和脏器,导致感染暴发[27-28]。
1.1.4 职业暴露 除了食源性暴露外,与感染弯曲菌的家禽接触也可能是人类感染途径。黎巴嫩、瑞典和美国家禽屠宰场工人弯曲菌的感染率分别为12.0%、25.0%和83.0%,说明从事家禽养殖、屠宰等相关工作可增加职业暴露弯曲菌的风险[13,29-30]。
1.2 家畜 家畜如犬、猫、猪、牛、羊、兔等动物是弯曲菌的另一类主要宿主,可造成人兽共患弯曲菌病传播的危害(表1)。有研究报道犬中弯曲菌的携带率从2.7%到100.0%,如南非41.5%的犬携带弯曲菌,携带一种以上弯曲菌的犬占6.2%;瑞典、加拿大、英国和美国等国家的携带率高达75.5%[31-37]。2016-2018年美国多州暴发耐多种药物的弯曲菌病疫情,追踪到患者与宠物店小狗接触[38]。新西兰某城区宠物猫弯曲菌的携带率为8.5%,猫源的porA和flaA与PubMLST数据库中人类弯曲菌病分离株的等位基因相同,提示猫可能是人类感染弯曲菌的危险因素[39]。猪作为人类重要的肉食来源,豚肠弯曲菌最初从患有增生性肠炎的猪中分离,随后在散发感染的人中分离[40]。在拉脱维亚,猪中弯曲菌的感染率高达83.3%[41]。特别值得注意的是猫、狗等宠物唾液中发现了海鸥弯曲菌,因此与家养宠物接触是感染弯曲菌的风险因素[42]。
牛也是弯曲菌的宿主,其重要性仅次于鸡,且其在弯曲菌病的流行病学中起着重要作用[43]。Thépault等研究发现,牛源与人源弯曲菌的基因型之间存在重叠[44]。菜牛在养殖过程中以超过104个/g粪便的密度将弯曲菌大量排出,且携带多种弯曲菌亚型,包括对人类健康构成风险的临床相关亚型;尽管从消化液、兽皮、屠宰场环境和胴体中分离出弯曲菌,但无法在碎牛肉中检测到弯曲菌的DNA[45]。Donato等随机抽取1 203份鲜牛肉的弯曲菌检出率为0.6%,且污染水平低于10 CFU/g,表明牛肉的污染程度很低,在弯曲菌传播中的作用很小[46]。绵羊为首次分离出结肠弯曲菌的动物,在西班牙北部巴斯克县54.8%的绵羊羊群感染弯曲菌,其中结肠弯曲菌检出率为19.1%,一半菌株属于ST-827型,为人类最常见的基因型之一,可说明绵羊对人类感染结肠弯曲菌的重要影响[47]。
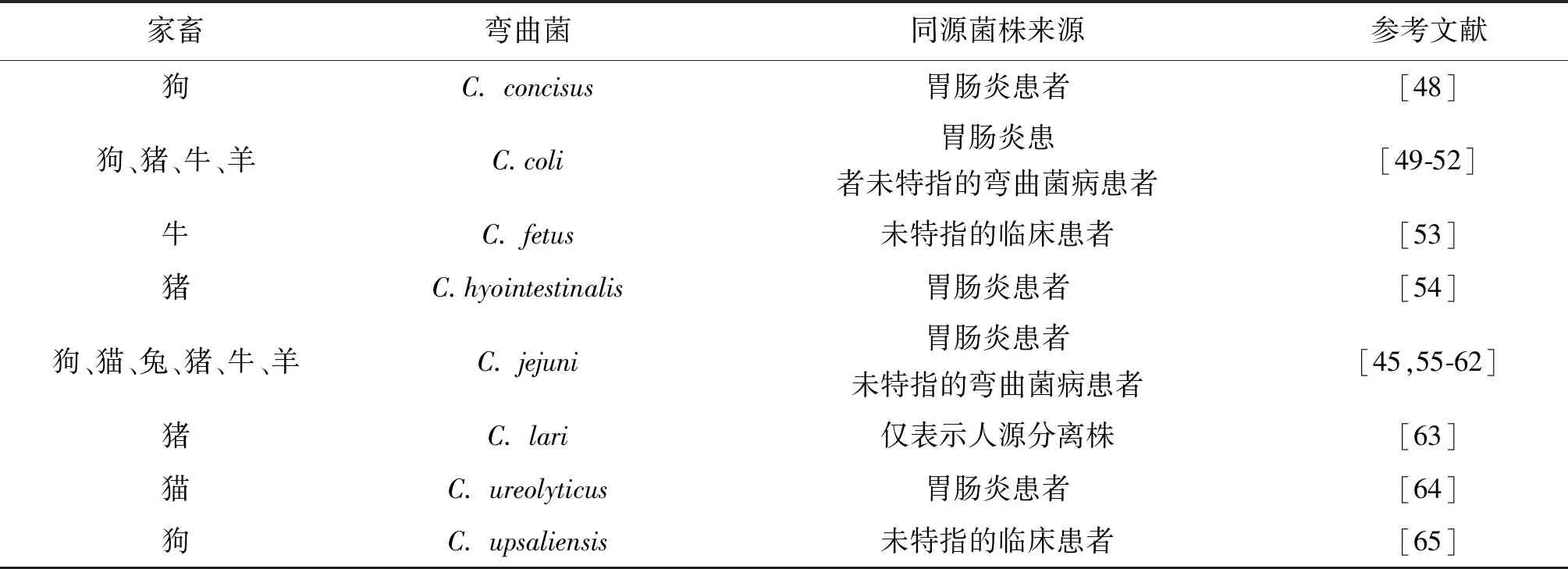
表1 家畜与人类弯曲菌感染株的同源关系Tab.1 Homologous relationship between domestic animal and human Campylobacter strains
1.3 野生鸟类 野生鸟类是人类弯曲菌感染的潜在来源之一[66],鸟类具有广泛的活动性,常在农场、牧场、娱乐区、食品加工厂、水库和居民区周围出现,并可在环境中传播这些病原体,对生物和食品安全构成了潜在危害。野生鸟类所携带的弯曲菌在不同的地理区域、鸟类栖息地、鸟种和生态鸟类群落之间差异很大,无明确的模式。有报道新西兰、伊朗、日本、智利和马来西亚等地野生鸟类中弯曲菌携带率较高(12.5%~24.2%),而英格兰北部、波兰和美国等地鸟类中弯曲菌携带率较低(1.4%~7.2%)[67-72]。一些鸟类物种或生态群体似乎比其他物种或生态群体更容易携带或感染,尤其是鸭科(27.1%~54.5%)、鸻科(33.3%~86.2%)、鹬科(74.0%)、鸥科(44.9%)和鸠鸽科(10.3%~100%)以及雀形目鸦科(48.7%~100%)、椋鸟科(35.1%~41.2%)和鸫科(12.6%~37.9%)有较高感染率[73]。在不同的生态群体中,如城市野生水鸟(鸭、天鹅、鹅)和椋鸟属于高弯曲菌携带群体,这可能与其在特定生态环境如农田中觅食相关[74]。在柯维鸟科鸟类中,如寒鸦等是杂食动物,与人类和家养动物有频繁的接触,它在食品动物间传播人兽共患弯曲菌病病原体,以及在人类间引起难以追踪来源的零星感染病例中产生影响。至今,已有一些文献资料报道野生鸟和人类弯曲菌感染存在可能的联系,见表2,如1990年英国由于喜鹊、寒鸦啄食牛奶瓶盖发生弯曲菌疫情。因此,野生鸟类在人类弯曲菌病的发生中具有重要作用,对公众健康构成风险。
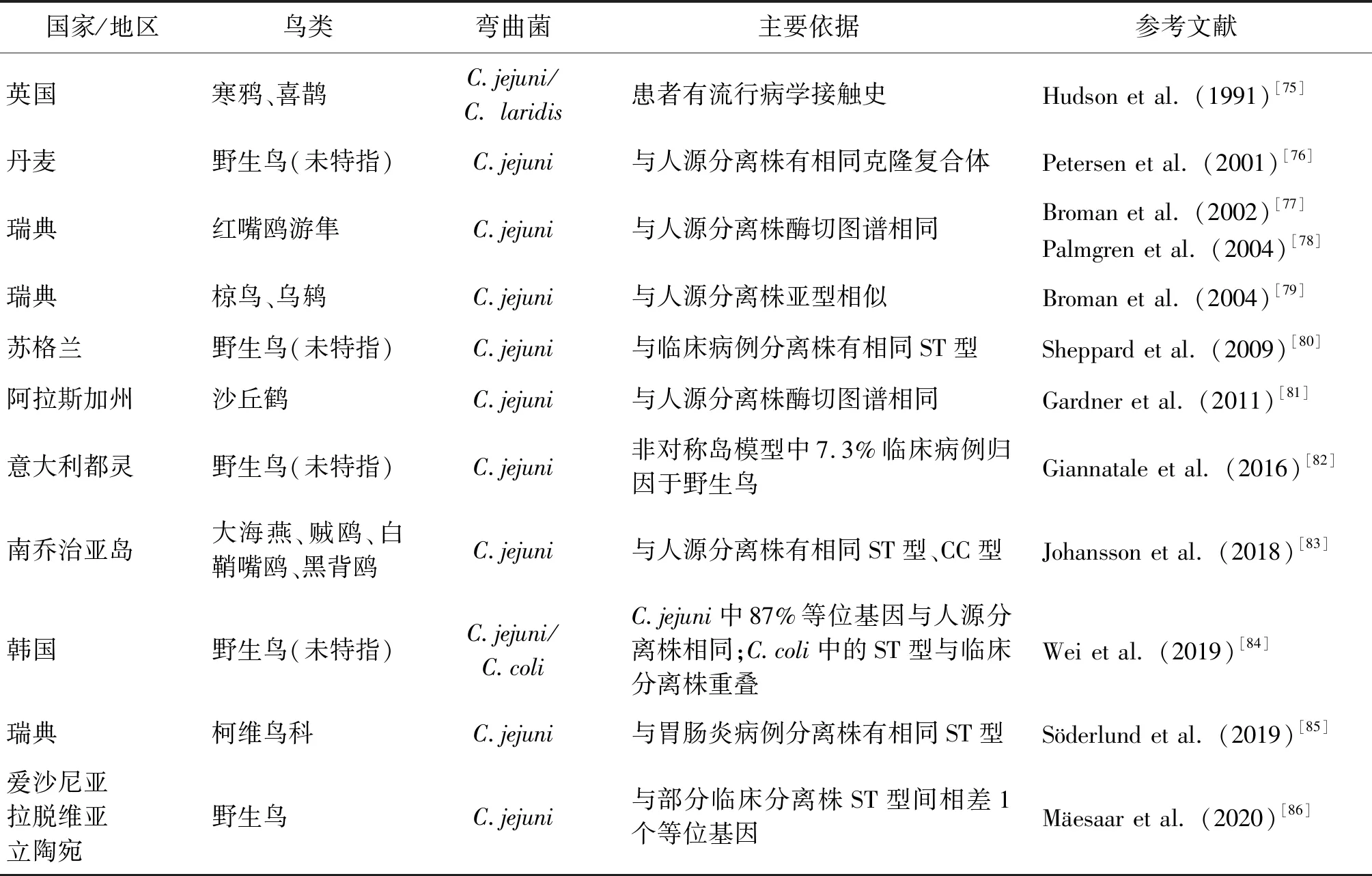
表2 野生鸟类与人类弯曲菌感染相关的文献Tab.2 Literature on Campylobacter infections in wild birds
1.4 野生动物 近年来,野生动物作为生物媒介带菌者的作用引起研究者的高度关注,有研究显示啮齿动物、蝙蝠、甲壳水生动物等野生温血动物的消化道常携带弯曲菌[87-90],尤其是啮齿动物通常生活在与人类活动密切相关的环境中,如农场、农田和建筑物内等。啮齿动物在不同生境中,其弯曲菌携带率不同,如Olkkola等[89]报道了芬兰农场和自然栖息地中啮齿动物的弯曲菌携带率分别为41.0%和19.0%,Williams等[91]发现英国林地和农场中堤岸田鼠的弯曲菌携带率分别为41.0%和18.0%。不同种类的啮齿动物弯曲菌携带率有差异,堤岸田鼠是农场和自然栖息地中很常见种类,其弯曲菌携带率(农场和自然栖息地分别为64%和24%)高于另一种在欧洲广泛分布的黑田鼠(农场和自然栖息地分别为25%和12%);褐家鼠分布于世界大部分地区,常在人类住所周边活动,农场中褐家鼠的弯曲菌携带率为20.0%,而在鼩鼱和家鼠中未发现携带弯曲菌[89]。不同地区的啮齿动物弯曲菌携带率不一致,如瑞典的黄颈姬鼠中,空肠弯曲菌和乌普萨拉弯曲菌携带率分别为28%和11%[92],而在芬兰的黄颈姬鼠中弯曲菌携带率为66.3%[89]。荷兰的研究者发现,有机猪场中大约10%的家鼠和12.5%褐家鼠携带弯曲菌,但其基因型未见与猪粪弯曲菌株的相同[87]。同样,在一项芬兰的研究中,啮齿动物弯曲菌分离株大多数基因型与人类、农场家畜中传播的基因型明显不同[89]。这表明啮齿类动物可能不是人类、家畜中弯曲菌传播的主要来源,但它们可携带主要存在家畜中的弯曲菌或参与农场病原菌的维持,可能与人类疾病有关,需要进一步的研究来证实。
1.5 环境介质 尽管弯曲菌病例中的绝大多数是由于食源性感染所致,但越来越多的证据表明,水是一种弯曲菌感染的潜在介质。有报道,弯曲菌能在井水中持续存活很长时间,在不同水环境中的各种条件下也能存活数天、数周,甚至数月[93]。尽管弯曲菌经常从水环境中被检出,但尚未证明它们在动物宿主外可繁殖;有研究认为弯曲菌通过进入一种存活但不可培养的状态,或通过形成一种单种生物膜定殖在先前存在的生物膜上,或在原生动物内内化而在水环境中持续存在[2,94-98]。许多研究显示,从河水、溪流、湖泊、池塘、地表径流、屋顶水、饮用水中分离出弯曲菌菌株[2,99-100],且不同水体之间弯曲菌种类分布存在差异,这些差异归因于集水区的土壤类型、农场类型、野生鸟类或动物活动等因素[101]。例如新西兰北岛马纳瓦图旺加努伊地区六条休闲娱乐河流中弯曲菌属和空肠弯曲菌检出率分别为33.2%和20.4%,所有河流中发现了与秧鸡相关的ST-2381分离株,一条河流中分离到与人类感染相关的家禽源性ST-474菌株,可造成公共健康风险[2]。至今,已有多起水源性弯曲菌病暴发事件,如2016年,新西兰发生大规模水源性弯曲菌病疫情暴发,感染约5 000多人,主要原因为意外摄入受污染娱乐用水[99]。又如2017年美国内布拉斯加州城市供水系统受到邻近集中动物饲养作业废水径流的污染所致的弯曲菌病暴发事件[102]。除了水,已有许多研究从其他环境介质或媒介生物中分离出弯曲菌,Bull等人报道在被弯曲菌感染鸡群的养殖场所中,约6%的空气样本对含有弯曲菌,并在定殖早期,弯曲菌能传播到肉鸡舍的空气中[103-104]。
2 内源性感染
人类弯曲菌感染除了外源性外,内源性感染为另一途径。一些弯曲菌如简明弯曲杆菌、曲形弯曲杆菌、纤细弯曲菌、直肠弯曲菌、昭和弯曲菌等以人类为天然宿主,它们自然定殖在人类口腔内[42]。其中简明弯曲菌是近年来的研究热点,它由Tanner等[105]于1981年首先从患有牙龈炎的患者中分离并命名,后来发现该菌通常存在于人类口腔中,有报道在97%的3~60岁健康人群的唾液中检测到简明弯曲菌[106],目前认为该菌为口腔微生物群的成员[107]。同时,越来越多的研究表明,简明弯曲菌在炎症性肠病的发展中起着重要作用。简明弯曲菌在腹泻患者中的检出率越来越高,其检出率仅次于最常见的空肠弯曲菌[108-110]。该菌与慢性肠道疾病有关,其在儿童克罗恩病和成人溃疡性结肠炎中的患病率显著高于对照组[111]。Hess等报道了胃肠炎是由简明弯曲菌引起的,并提出此菌种可能引起腹泻[112]。研究发现同一患者口腔和肠道的简明弯曲菌间的遗传差异小,该菌可随吞咽唾液和食物迁移到肠道[113-115]。同时有证据表明口腔中的一些简明弯曲菌株从原噬菌体中获得封闭带毒素(Zot)基因,其编码的封闭带毒素作用于肠上皮屏障,增加肠道通透性,并提出由简明弯曲菌Zot引起的原发性屏障功能缺陷是简明弯曲菌株可能触发和复发IBD发病的机制[116-117]。尽管支持简明弯曲菌在肠炎中作用的证据越来越多,但仍需要进一步研究。
3 人类感染归因分析
弯曲菌作为共生体存在各种哺乳动物和鸟类肠道中,这为人类感染提供了许多可能的来源。不同来源对人类疾病的构成相对风险可从人类与感染来源分离株间所表现型别的量化中推断出来,许多研究认为大多数人类弯曲菌感染病例可追溯到鸡宿主,其他农场动物的贡献各不相同[118]。在瑞士,70.9%、19.3%、8.6%和1.2%的人类病例分别归因于鸡、牛、狗和猪;且零售鸡肉中弯曲菌的高污染率(>50%)能合理解释鸡的较大贡献[119]。在荷兰的一项研究中,63%、25%、11%、0.5%、0.4%的人类弯曲菌感染分别归因于鸡、宠物(狗和猫)、牛、猪、羊[120]。在丹麦,对不同来源的弯曲菌分离株进行全基因组测序,发现30%临床来源菌株与潜在来源的分离株相匹配,且大部分临床分离株与25%国产肉鸡/鸡肉的分离株同源,证实鸡是人类感染的主要来源[121]。在我国,张茂俊研究团队对北部地区(北京、河南、河北)鸡粪便和腹泻患者来源空肠弯曲菌进行PFGE分析,鸡源与腹泻患者来源菌株存在相关性;其后该团队对不同来源结肠弯曲菌进行分子分型(MLST,porA和flaA-SVR),结果表明从腹泻患者中收集的大多数分离株与鸡源分离株具有相同的基因型,鸡群中结肠弯曲菌的流行性也表明鸡可能是中国人类结肠弯曲菌感染的主要来源[122-123]。赵冰等[124]应用多位点序列分型技术研究上海市浦东新区腹泻患者、禽类养殖环境样本以及生禽肉的空肠弯曲菌分离株的亲缘关系和进化特征,结果显示禽源株与人源株存在密切的相关。然而,在美国,采用核心基因组多位点序列分型(cgMLST)方法对食源性动物和零售肉类来源的622株弯曲菌和从NCBI下载的222株人源分离株WGS数据进行分析,40.5%的零售鸡肉、56.5%的猪、77.4%的奶牛和78.9%的肉牛分离株与人类分离株具有相同cgMLST类型[125]。Tyson等[126]将肉牛、奶牛、猪、家禽、零售禽肉等来源的1 300多株弯曲菌和美国疾控中心PulseNet数据库中人类患者分离株的PFGE谱型比较,肉牛和奶牛分离株的PFGE谱型分别有56.6%和65.0%与人分离株的无明显区别,家禽和零售肉类分离株有49.5%与至少一个人类分离株的谱型无法区分,猪分离株只有9.5%与人类分离株有共同的PFGE谱型。这些数据表明,牛可能比以前认识到的为弯曲菌感染更大的风险者,提示需要进一步了解人类弯曲菌病的潜在来源。
传统流行病学资料与分子流行病学证据的结合使用能有效识别暴发、区分散发性感染,追溯病原菌传播的来源和途径。在2008年8-9月美国阿拉斯加中南部居民中暴发的弯曲菌病的调查中,应用脉冲场凝胶电泳(PFGE)和多位点序列分型(MLST)技术对患者、生豌豆和野生鸟类粪便样本的空肠弯曲菌分离株进行分子流行病学分析,证实了此次弯曲菌病暴发归因于吃了被沙丘鹤污染的生豌豆[127]。2019年6月,挪威卑尔根西北部的阿斯克沃伊岛暴发一起弯曲菌感染事件,出现2 000多名居民患病,76人住院,2例死亡病例。流行病学调查发现已塌陷的饮用水储存池被粪便污染,并在供水系统的多个点检出了弯曲菌。利用宿主特异性拟杆菌16S rRNA基因对粪便污染进行微生物溯源显示,马粪是本次饮用水污染的主要来源,导致水源性弯曲菌感染事件的发生[128]。Strachan等采用MLST评估幼儿(年龄<5岁)弯曲菌病与特定动物来源的关系,发现苏格兰东北部农村地区反刍动物和鸟类为幼儿感染的主要传染源,同时现场流行病学调查显示该地区居民自供水密度高、大部分未经处理以及有密集的牛羊养殖,潜在的环境污染暴露其与弯曲菌病的较高发病率有关[129]。综上所述,这些研究阐明了携带弯曲菌的动物-污染食品或环境-感染人类路径的传播规律。
4 小结与展望
弯曲菌是全球范围导致人类肠道感染的主要病原体之一,其广泛存在于各种动物、环境介质以及媒介生物中,人类在生产和生活中极易暴露该病原菌或口腔内定殖的弯曲菌发生移位而对人体健康构成潜在威胁。近年来随着对弯曲菌的研究越来越深入,特别是分子分型溯源技术如脉冲场凝胶电泳、鞭毛蛋白基因限制性片段长度多态性和多位点序列分型等方法的应用,对弯曲菌病感染来源的认识逐步全面。然而,由于弯曲菌储存宿主多样,且在宿主内水平基因转移、重组频繁以及病原菌传播来源、传播链尚未完全阐明;同时弯曲菌的高度多样性,大多数基因型的宿主特异性低,这对于人类弯曲菌感染来源的控制带来了极大挑战。因此,未来进一步扩大和完善各地人类、动物和环境中弯曲菌分离株溯源分析数据库,以便于探查弯曲菌菌株传播的分子来源归因;采用全基因组多位点序列分型方法,精准识别来自同一来源的克隆群。监测与评估从“农场到餐桌”弯曲菌的污染风险,采用干预措施消除食源性弯曲菌的暴露风险。应用“One Health”策略,结合培养组学、宏基因组学技术等,探讨弯曲菌在动物宿主、环境和人类感染之间的相互作用,以全面了解弯曲菌感染的流行病学特征,促进人类弯曲菌病的有效防控。
