结核分枝杆菌抗原融合蛋白Ag85B-ESAT6和Rv2031c-Rv2626c重组腺病毒的构建及鉴定
2022-04-01王丽梅靳芊芊
王丽梅,姜 泓,康 健,靳芊芊
结核病(Tuberculosis,TB)是一种由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)感染的慢性传染病。全球每年TB新发患者约1 000万,目前约1/3的人口已潜伏感染Mtb,其中5%~10%的人终会发展为TB患者。我国是TB高负担国家,TB患者数位居世界第3[1]。卡介苗(BCG)是目前用于预防TB的唯一疫苗,但其仅对儿童TB具有较好的保护效果,对成人TB却无保护[2]。因此,研制新型TB疫苗成为防控TB迫切需要解决的科学问题。
腺病毒是一种无包膜的双链 DNA 病毒,宿主范围广,不整合到人体基因,可以承载较大的外源基因片段,是一种广泛应用的疫苗抗原递送载体。腺病毒载体递送的疫苗靶抗原能高效刺激机体产生针对靶抗原的体液和细胞免疫应答。同时,腺病毒载体还可通过肠道或呼吸道进行黏膜免疫,并能够制成不同的剂型如冻干粉、口服等延长保存期[3]。目前腺病毒载体已被广泛应用到多种病原体疫苗的研究,如埃博拉病毒、人类免疫缺陷病毒、流感病毒、恶性疟原虫和丙型肝炎病毒等的疫苗研究[4]。2020年,基于人血清5 型腺病毒 (Adenovirus 5,Ad5)载体的新型冠状病毒肺炎疫苗(Ad5-nCoV)被成功用于人群预防2019新型冠状病毒感染的免疫接种。临床研究数据表明,该疫苗单剂接种的保护效力可达74.8%,对重症新型冠状病毒肺炎的保护效力达100%,未发生与疫苗相关的严重不良反应事件[5-6]。
本研究利用非复制的人血清5型腺病毒载体,构建双启动子表达结核分枝杆菌增殖期优势抗原融合蛋白和休眠期优势抗原融合蛋白的重组腺病毒,为其用于结核病新型疫苗的研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 质粒、细胞及菌株 pAdTrack-CMV质粒和pAdeasy-1质粒购自上海汉恒生物科技有限公司,pMDTM18-T质粒购自日本TaKaRa公司。人胚胎肾细胞(HEK293细胞)、小鼠巨噬细胞Raw264.7、大肠埃希菌DH5α菌株、含有Mtb Ag85B和ESAT-6抗原的融合蛋白基因质粒pDE22-Ag85B-ESAT6、含有Mtb Rv2031c和Rv2626c抗原的融合蛋白基因质粒pDE22-Rv2031c-Rv2626c,均由本实验室保存。
1.1.2 主要试剂及仪器 限制性内切酶KpnⅠ、PvuⅠ、AluⅠ、XhoⅠ、DNA marker 2000等购自日本TaKaRa公司;HB-infusionTM无缝克隆试剂盒、LipofiterTM转染试剂购自上海汉恒生物科技有限公司;DMEM、胎牛血清和胰酶购自美国Hyclone公司;胶回收试剂盒购自上海捷瑞生物工程有限公司;质粒DNA小量、大量提取试剂盒购自北京康为世纪生物科技有限公司;病毒基因组提取试剂盒购自北京天根生化科技北京有限公司;抗Ag85B 单克隆抗体(mAb)、抗ESAT-6 mAb、抗Rv2031c mAb和抗Rv2626c mAb均购自英国Abcam公司;FITC标记的山羊抗小鼠IgG抗体购自北京中山金桥生物技术有限公司;Adneo-X TM raid Titer Kit 腺病毒滴度测定试剂盒(壳蛋白免疫法)购自日本 TaKaRa 公司;1 mL Qhp预装柱、1 mL Capto Core 700预装柱、AKTA纯化仪(AKTA primeplus)购自美国 GE 公司。其他试剂均为国产分析纯。
1.2 方 法
1.2.1 EF1α启动子DNA合成 根据GenBank公布的人EF1α启动子的DNA序列(MZ648044.1),设计合成EF1α启动子的 DNA片段,并在片段的5′端引入PvuI限制性内切酶位点,3′端引入AluI限制性内切酶位点,具体序列如下:AAGGATCTGCGATCGCTCCGGTGCCCGTCAGTGGGCAGA-GCGCACATCGCCCACAGTCCCCGAGAAGTT-GGGGGGAGGGGTCGGCAATTGAACGGGTG-CCTAGAGAAGGTGGCGCGGGGTAAACTGGG-AAAGTGATGTCGTGTACTGGCTCCGCCTTT-TTCCCGAGGGTGGGGGAGAACCGTATATA-AGTGCAGTAGTCGCCGTGAACGTTCTTTTT-CGCAACGGGTTTGCCGCCAGAACACAGCTG-AAGCTTCGAGGGGCTCGCATCTCTCCTTCA-CGCGCCCGCCGCCCTACCTGAGGCCGCCATC-CACGCCGGTTGAGTCGCGTTCTGCCGCCTCC-CGCCTGTGGTGCCTCCTGAACTGCGTCCGC-CGTCTAGGTAAGTTTAAAGCTCAGGTCGA-GACCGGGCCTTTGTCCGGCGCTCCCTTGGA-GCCTACCTAGACTCAGCCGGCTCTCCACGC-TTTGCCTGACCCTGCTTGCTCAACTCTACG-TCTTTGTTTCGTTTTCTGTTCTGCGCCGTT-ACAGATCCAAGCTGTGACCGGCGCCTAC。EF1α启动子的DNA片段由上海金斯特生物公司合成。
1.2.2 引物设计 根据GenBank公布的人EF1α启动子序列、以及本课题组前期构建的AE[6]、R2[7]融合蛋白基因序列,应用Primer 7.0设计6条PCR扩增引物,见表1。
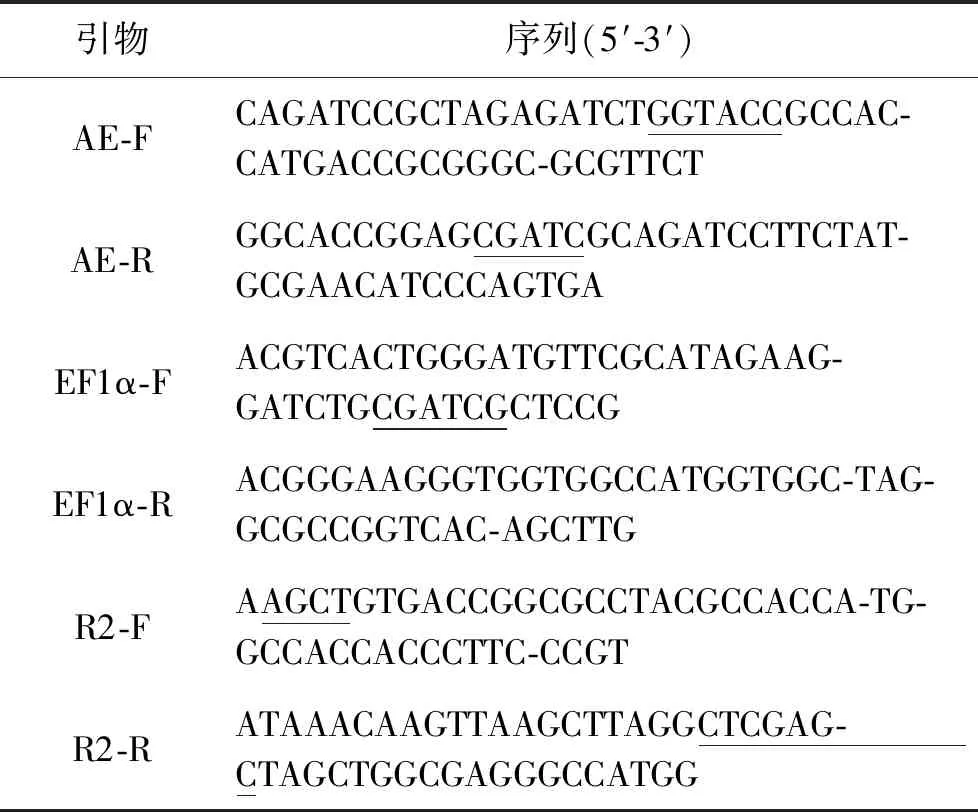
表1 PCR引物Tab.1 PCR primers
1.2.3 AE和R2融合蛋白基因的PCR扩增 以pDE22-Ag85B-ESAT6 质粒和pDE22-Rv2031c-Rv2626c质粒为模板,分别应用引物AE-F/AE-R和R2-F/R2-R PCR 扩增AE、R2基因。反应条件:94 ℃预变性5 min;94 ℃变性 30 s,60 ℃退火30 s,72 ℃ 延伸1 min,30个循环;72 ℃ 再延伸10 min。将扩增片段连接至pMD18-T载体,构建克隆质粒18T-AE和18T-R2,并转化大肠埃希菌DH5α感受态,挑取阳性菌落进行液体培养,阳性菌液送测序公司进行测序鉴定。
1.2.4 重组腺病毒穿梭质粒pAd-AE-R2的构建 将质粒18T-AE、合成的EF1α DNA片段和质粒18T-R2分别用KpnⅠ和PvuⅠ、PvuⅠ和AluⅠ、AluⅠ和XhoⅠ进行双酶切,琼脂糖凝胶电泳后回收目的基因片段。将回收的目的基因片段依次与相应酶切的pAdTrack-CMV载体采用HB-infusionTM进行无缝克隆连接,连接产物转化大肠埃希菌DH5α菌株,挑取阳性菌落进行液体培养,阳性菌液送测序公司进行测序鉴定。
1.2.5 重组腺病毒Ad-AE-R2的包装 将pAd-AE-R2穿梭质粒和骨架质粒pAdeasy-1用PacI单酶切进行线性化处理,酶切产物用无水乙醇沉淀回收,并将线性化质粒2 μg与2 μL LipofiterTM转染试剂共转染HEK293单层细胞中,于37 ℃、5% CO2孵箱中培养,7~10 d后,待细胞出现细胞病变后收集HEK293细胞,并反复冻融3次,之后重新接种HEK293细胞进行扩增,收集获得的Ad-AE-R2重组腺病毒,并进行病毒纯化和滴度的测定。
1.2.6 AE、R2靶基因表达的RT-PCR检测 以MOI=1∶5接种纯化的Ad-AE-R2重组腺病毒于培养的HEK293单层细胞,48 h后提取细胞总RNA,并进行反转录cDNA。以3 μL cDNA为模板,以AE、R2特异性引物进行RT-PCR。PCR扩增的反应体系:12.5 μL 2×Mix buffer,上、下游引物各0.25 μL,双蒸水12 μL。反应条件:95 ℃ 3 min,94 ℃变性 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸10 min。以hGAPDH作为内参对照。
1.2.7 AE、R2目的蛋白的间接免疫荧光(IFA)检测 将Ad-AE-R2重组腺病毒以MOI=1∶5接种于培养在玻片上的小鼠Raw264.7单层细胞中,12 h后终止培养。PBS漂洗细胞3次后,用冷丙酮固定细胞15 min;PBS漂洗后加入1% 牛血清白蛋白BSA,37 ℃封闭1 h;弃去封闭液,加入含1% BSA PBS稀释的一抗,一抗分别为Ag85B mAb,ESAT-6 mAb,Rv2031c mAb和Rv2626c mAb,37 ℃ 2 h;漂洗后加入Alexa Fluor 488标记的羊抗鼠IgG作为二抗,37 ℃ 1 h;漂洗后,加入DAPI进行细胞核染色,室温10 min。漂洗后,用50%的甘油水溶液进行封片,荧光显微镜下观察。
2 结 果
2.1 重组腺病毒pAd-AE-R2穿梭载体的构建 利用限制性酶切和无缝克隆技术,构建CMV和EF1α双启动子分别表达AE和R2融合蛋白的重组腺病毒穿梭载体 pAd-AE-R2,并进行测序鉴定。测序结果表明,pAd-AE-R2重组载体中的AE、R2基因片段大小和核苷酸序列完全正确。
2.2 重组腺病毒Ad-AE-R2的包装和纯化 将重组腺病毒穿梭载体pAd-AE-R2与pAdeasy-1骨架质粒共转染HEK293单层细胞,包装重组腺病毒Ad-AE-R2。结果发现,转染的HEK293单层细胞在培养约7~10 d左右,大部分细胞变圆、聚集,出现细胞病变并从底部脱落,如图1所见,表明转染的HEK293细胞中能够包装出重组腺病毒。将包装的重组腺病毒扩大培养、纯化,并进行病毒滴度测定,结果Ad-AE-R2重组腺病毒经纯化后的滴度可达1.26×1011PFU/mL。
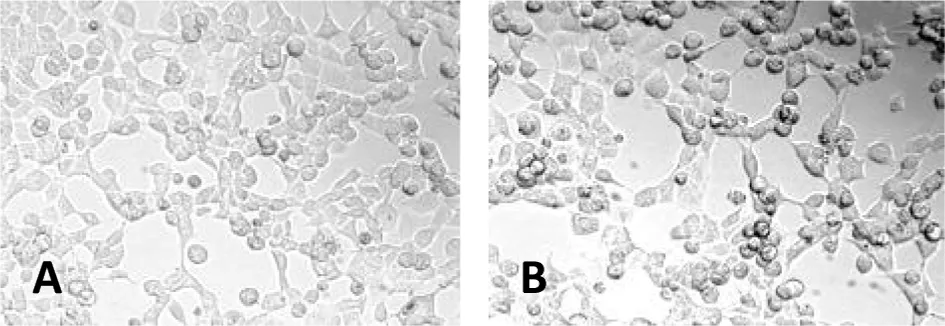
注:A为正常的HEK293细胞;B为pAd-AE-R2穿梭载体与骨架质粒共转染的HEK293细胞。图1 重组腺病毒Ad-AE-R2的包装Fig.1 Packaging of recombinant adenovirus Ad-AE-R2
2.3 AE和R2基因转录水平的RT-PCR鉴定 重组腺病毒Ad-AE-R2感染HEK293细胞,用RT-PCR对感染细胞中AE和R2基因的转录水平进行鉴定。Ad-AE-R2感染HEK293细胞后,AE和R2重组基因均能够在细胞中被转录,且基因的转录水平高于内参基因hGAPDH的,表明Ad-AE-R2能够特异性地转录表达AE和R2基因,见图2。
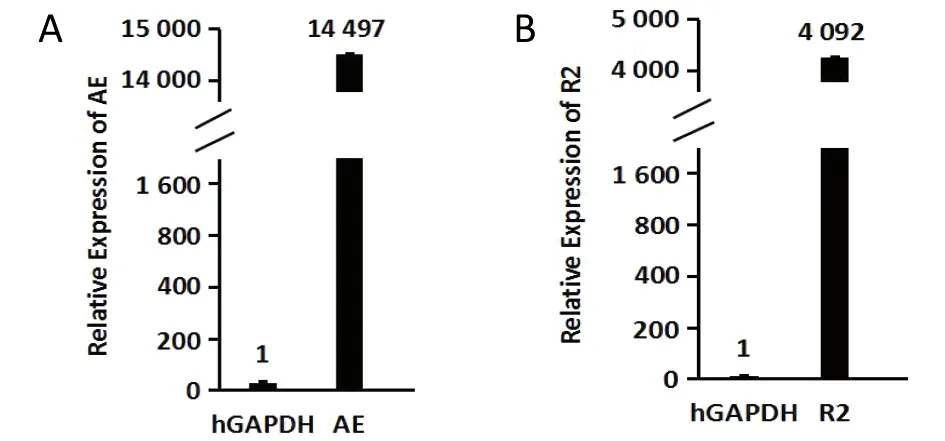
图2 RT-PCR检测Ad-AE-R2感染HEK293细胞中AE和R2基因的转录水平Fig.2 Transcription levels of AE and R2 genes in Ad-AE-R2 infected HEK293 cells,detected by RT-PCR
2.4 AE和R2蛋白表达的间接免疫荧光(IFA)鉴定 用Mtb抗原的mAbs对Ad-AE-R2感染小鼠巨噬细胞中的AE和R2融合蛋白进行IFA检测。结果如图3所示,anti-Ag85B mAb、anti-ESAT-6 mAb、anti-Rv2031c mAb和anti-Rv2626c mAb 4种抗体均能检测到感染细胞中有特异性的绿色荧光表达,表明Ad-AE-R2重组腺病毒感染细胞后能够在细胞内正确地表达AE和R2融合蛋白。
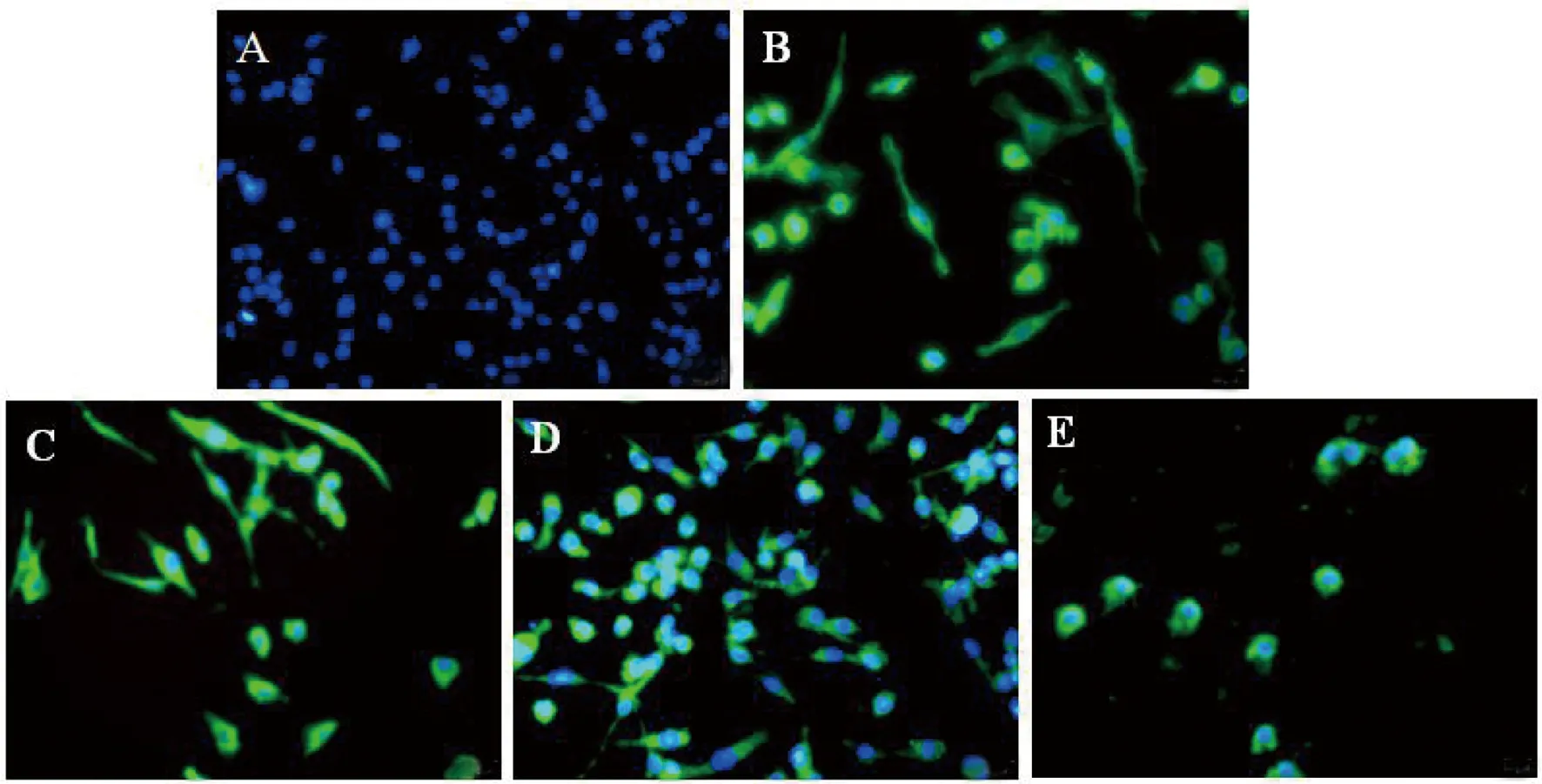
注:A为腺病毒空载体(AdC)感染的巨噬细胞;B-E为Ad-AE-R2感染的巨噬细胞;B为Anti-Ag85B mAb的IFA 检测;C为Anti-ESAT-6 mAb的IFA 检测;D为Anti-Rv2031c mAb的IFA检测;E为Anti-Rv2626c mAb的IFA检测。图3 重组腺病毒Ad-AE-R2感染小鼠巨噬细胞中AE和R2融合蛋白的IFA检测Fig.3 Expression of fusion proteins of AE and R2 in mouse macrophages infected with the recombinant adenovirus Ad-AE-R2,detected by IFA
3 讨 论
腺病毒作为疫苗递送载体目前已被广泛用于各类疾病的疫苗研究。虽然大部分人体内会含有针对腺病毒的特异性抗体,影响以腺病毒为载体的疫苗的免疫保护效果,但由于腺病毒免疫原性强、安全性好,其作为疫苗递送载体仍具有很高的科研和临床应用价值[4]。尤其是基于腺病毒载体的新型冠状病毒肺炎疫苗的成功应用,进一步肯定了腺病毒载体疫苗的研究前景[5-6]。腺病毒有100种以上的血清型,但大多数腺病毒载体以人血清5型腺病毒(Ad5)和人血清2型腺病毒(Ad2)为基础[3]。腺病毒载体分为3代,目前研究的腺病毒载体疫苗大多基于第一代腺病毒载体进行研制。第一代腺病毒载体缺失E1和E3基因,是一类腺病毒复制缺陷的载体,能够引发机体产生较强的炎症反应和免疫反应,但该类载体仅适合于在细胞内外的瞬时转染,如果需要进行重组腺病毒的复制,必须在含有E1区基因表达的细胞内进行复制,如HEK293细胞[9]。
本研究选用的腺病毒载体是一种E1区基因缺失的人血清5型的复制缺陷型腺病毒(Ad5),利用该载体的CMV启动子,表达Mtb增殖期的两个优势抗原Ag85B与ESAT-6的融合蛋白基因AE。Ag85B是Mtb胞壁中含量较为丰富,且具有强烈免疫原性的一个抗原[10],ESAT-6是致病性分枝杆菌与非致病性分枝杆菌的一个差异蛋白,也具有良好的免疫原性[11]。大量研究已表明Ag85B和ESAT-6作为疫苗的靶抗原能够有力抵抗Mtb感染[12]。为了能够使重组腺病毒载体携带表达更多的Mtb抗原,本研究在该腺病毒载体中增加了人延长因子EF1α启动子,并利用该启动子表达Mtb休眠期的两个优势抗原Rv2031c和Rv2626c的融合蛋白基因R2,从而使该重组腺病毒载体携带更全面的Mtb抗原,全面刺激机体产生抗Mtb感染的保护性免疫。Mtb致病机制复杂,其在体内可以休眠菌的状态存在,而休眠期的Mtb可特异性转录表达一组与其休眠相关的抗原,将这些抗原作为疫苗的靶抗原,可以增强疫苗对Mtb休眠菌的免疫识别,从而增强疫苗的免疫保护效果[13]。将Mtb增殖期和休眠期抗原即Mtb多阶段抗原共同作为疫苗的靶抗原,是当前TB新型疫苗研究的趋势。
本研究利用Ad5腺病毒载体作为疫苗抗原递送载体,递送表达Mtb多阶段抗原融合蛋白AE和R2。结果表明,构建的重组腺病毒Ad-AE-R2能够高效转录AE和R2融合蛋白基因,并正确表达AE和R2融合蛋白,为其用于TB新型疫苗的研究奠定了工作基础。
