4种转录组标志物用于活动性结核的诊断研究
2022-04-01姚向阳邓晨希吴智超简丽娟葛胜祥
姚向阳,邓晨希,刘 伟,吴智超,王 涵,简丽娟,葛胜祥
结核病是由结核分枝杆菌引起的慢性传染病,至今仍是全球十大致死因素之一[1]。根据世界卫生组织《2020年全球结核病报告》,2019年全球约有1 000万人罹患结核病、120万结核病死亡病例[1]。早期诊断有助于结核病患者得到及时治疗,以及隔离传染源从而减少疾病传播。然而,据估计,全球每年漏诊36%结核病新发病例[2]。传统的结核病诊断依赖于痰培养、涂片镜检和X光胸片。痰培养是结核病诊断的金标准,但检测周期长;涂片镜检灵敏度低,且无法区分结核分枝杆菌和非结核分枝杆菌;X光胸片检查也难以获得令人满意的临床诊断灵敏度和特异性。新兴的分子生物学检测方法如GeneXpert等,其在涂阳标本中具有极高的灵敏度和特异度,然而在涂阴标本中诊断性能依旧不佳[3]。此外,上述检测方法大都基于痰液标本,对于肺外结核和不易获取合格痰液标本的肺结核患者(如人免疫缺陷病毒共感染患者、老人和小孩等),临床应用具有较大的样本获取限制。当前亟需发展新的结核病临床诊断方法,世界卫生组织(World Health Organization,WHO)在其发布的《结核病诊断高优先级目标产品文件》(High-priority target product profiles for new tuberculosis diagnostics,TPP)中,明确提出了对发展非痰液标本诊断方法的需求[4]。
通过对结核患者全血转录组学研究产生的一系列转录组标志物,为基于血液检测的结核诊断候选靶标筛选提供了依据。2010年,《自然》杂志发表了一篇基于不同人群的外周血全基因组转录谱学研究,获得了一组由393个转录子组成的活动性结核特征基因群,为结核病诊断提供了丰富的潜在靶标[5]。在随后的十余年里,随着结核病患者外周血转录组学研究的深入,越来越多结核病患者与其他组别之间差异表达的宿主基因被发现和后续评价。Emily MacLean等学者对已有的结核转录组学研究进行了系统性综述[6],表明共有4组转录组标志物[7-9]在病例对照研究中达到了WHO TPP对于非痰液样本的结核病筛查产品的最低性能要求,即灵敏度达到90%的同时特异度达到70%。2019年,Warsinske等[10]利用NCBI GEO 和EBI ArrayExpress数据库对16组已报道用于结核诊断研究的转录组标志物进行了系统性评价,其结果表明Sweeney[11]and Sambarey[12]这2组标志物达到了WHO TPP结核筛查产品的最低要求。2020年,Turner等[13]对27组高质量的结核转录组标志物开展了前瞻性临床诊断准确性研究,其中4组标志物达到或接近达到WHO TPP结核筛查产品的最低要求,分别为Sweeney[11]、Kaforou[7]、Roe[14]和BATF[15]。
上述符合WHO TPP结核筛查实验标准的9组转录组学标志物,具备良好的应用前景,有望向临床转化,弥补基于痰液诊断方法的不足。但这些标志物的临床应用仍存在一些限制因素。一方面,这9组转录组学标志物包含基因数目较多,且相互之间重叠基因较少,大部分基因仅出现在某一组标志物中,需对这些基因进行筛选以减少纳入使用的基因数目。另一方面,转录组学标志物依赖于核酸检测技术,由于核酸检测对设备、设施和人员素质的要求较高,不利于在结核负担严重的基层和边远地区的推广应用[16]。
由于基因转录水平越高其蛋白表达水平也高,因此上述结核患者外周血宿主标志物也可能在蛋白水平上具有区分活动性结核和非结核患者的能力,但目前尚无相关研究予以验证。如果确实存在具有结核病区分能力的外周血宿主蛋白,建立相应免疫检测试剂,则更便于在不同应用场景下的临床推广应用。为了验证外周血转录水平存在差异的靶标基因是否在蛋白水平上也同样存在差异,我们选择4个转录组学发现的代表性基因(9组转录组学标志物中高频出现的FCGR1A出现4次、DUSP3出现4次和BATF2出现2次,以及其他研究中被多次报道的SEPT4出现1次,表1)。其中FCGR1A和BATF2基因已知均由干扰素介导表达,FCGR1A编码高亲和力的I型免疫球蛋白Fc受体(FcγR1,也称CD64),在细菌侵袭和促炎性细胞因子作用下,中性粒细胞表面FCGR1A蛋白表达量迅速增加;BATF2编码的碱性亮氨酸拉链转录因子2,属于激活蛋白1(AP-1)转录因子家族,在内毒素作用下在单核巨噬细胞中表达上调;DUSP3基因是ERK和JNK通路的负调节因子;SEPT4基因属于GTP酶基因家族,主要与细胞分裂、囊泡运输、细胞支架以及凋亡等相关。建立上述4个基因的全血蛋白水平免疫检测体系,评估其在活动性结核患者和非结核肺病患者之间的差异,为基于结核外周血转录组学标志物免疫检测试剂的研究提供指导和依据。

表1 基因FCGR1A、DUSP3、SEPT4和BATF2在9组转录组标志物中出现的情况Tab.1 Frequencies of FCGR1A,DUSP3,SEPT4 and BATF2 genes in nine significant transcriptional signatures
1 材料与方法
1.1 实验材料
1.1.1 临床标本 336例临床患者的抗凝全血标本均采集自厦门大学附属第一医院杏林分院肺科的住院患者(2020年3月至2020年8月),均为治疗前使用肝素锂抗凝管采集患者静脉全血,并于-20 ℃保存。其中190例活动性结核患者依据新版《肺结核诊断标准》(WS 288-2017)[17]确诊,其他146例非结核肺病患者为肺炎、肺部感染、肺部肿瘤等其他疾病。随机将其中30例结核患者与30例非结核患者作为前期筛选队列,其余纳入验证队列。本研究经厦门大学公共卫生学院伦理委员会批准,所有患者均知情同意。
1.1.2 主要试剂耗材 FCGR1A、DUSP3、SEPT4和BATF2重组蛋白及相应单克隆鼠抗由本实验室前期制备,96孔微孔板购于厦门怡佳美公司,酶联免疫吸附实验(ELISA)检测使用的稀释液、封闭液、洗涤液和显色底物均由北京万泰生物药业有限公司提供。
1.1.3 主要仪器 小型台式高速离心机购于美国Thermo公司,自动洗板机购于北京拓普分析仪器有限公司,酶标仪购于安图实验仪器(郑州)有限公司。
1.2 实验方法
1.2.1 双抗体夹心法ELISA建立 用20 mmol/L磷酸盐缓冲液(pH 7.4)将包被抗体稀释至400 ng/mL,100 μL/孔加入至微孔板,37 ℃恒温包被2 h;PBST洗液(20 mmol/L磷酸盐缓冲液,pH 7.4,150 mmol/L NaCl,0.05% 吐温-20)洗板1次后,加入封闭液(1% BSA)200 L/孔,37 ℃恒温封闭 2 h。标记抗体则采用过碘酸钠法标记辣根过氧化物酶,工作浓度为1 g/mL。检测流程:在已包被的微孔板中每孔加入100 μL样本(已知浓度的系列稀释抗原或全血裂解后的临床标本),37 ℃恒温孵育1 h,PBST洗板5次;加入100 μL工作浓度的标记抗体37 ℃恒温孵育1 h后,用PBST洗板5次;加入100 L辣根过氧化物酶底物,37 ℃避光显色15 min;每孔加入50 L终止液终止反应后,检测450 nm处(参考波长630 nm)的光密度(OD值)。
1.2.2 ELISA检测体系线性范围测定 将4个重组蛋白分别用20% 小牛血清进行倍比稀释,用1.2.1所建立的方法进行测定。每个浓度的样品均重复测定2次,以2次OD值的平均值进行数据分析。
1.2.3 全血标本检测 全血裂解液按1% NP-40和0.25%过氧胆酸钠配制,按照1份全血加3份裂解液的比例进行样本和裂解液混合,涡旋震荡后使用小型台式高速离心机离心10 min (12 000 r/min),吸取上清按照1.2.1所述方法进行检测。
1.3 统计学分析 利用SPSS 22.0软件对数据进行统计学分析,利用GraphPad Prism 8软件进行图表绘制。对非正态分布数据采用中位数和四分位数间距(IQR)进行描述,组间数据比较采用双侧非参数秩和检验。生物标志物区分活动性结核和非结核肺病以受试者工作曲线(Receiver operating characteristic,ROC)进行分析,计算其曲线下面积(Area under ROC curve,AUC),根据最大约登指数确定最优Cut off值并以此计算灵敏度和特异度。P<0.05表示差异具有统计学意义。
2 结 果
2.1 研究队列的人口学与临床信息资料比较 在筛选队列中,活动性结核组与非活动性结核组的年龄分布差异无统计学意义(t=1.18,P>0.05),而在验证队列中,分布差异有统计学意义(t=-5.37,P<0.05);在筛选队列和验证队列中,活动性结核组(χ2=5.71,P<0.05)与非活动性结核组(χ2=5.96,P<0.05)的性别分布差异有统计学意义。在两个队列中,活动性结核组IGRA阳性、培养阳性、涂片阳性、Xpert阳性比率均高于非结核肺病组,差异具有统计学意义,详见表2。
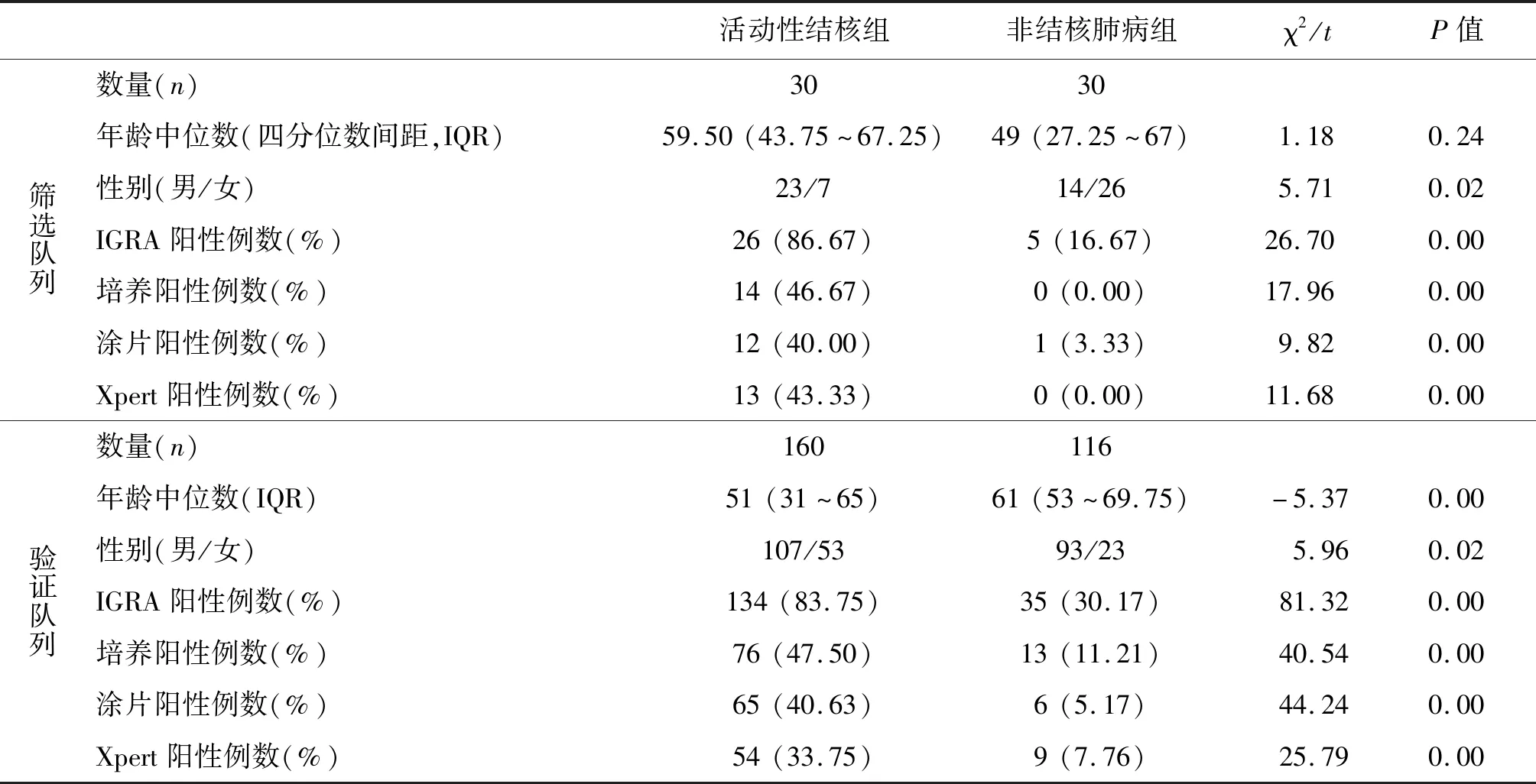
表2 研究队列的人口学与临床信息资料Tab.2 Demographic and clinical characteristics of analyzed participants
2.2 双抗体夹心法ELISA检测的线性范围 将真核细胞表达的FCGR1A、DUSP3、SEPT4和BATF2蛋白采用20% 小牛血清进行倍比稀释后,系列稀释标本分别用相应的双抗体夹心法ELISA试剂进行双孔重复检测。将每种蛋白的蛋白浓度和OD值取以2为底数的对数后,分别绘制散点图,取线性回归相关系数的平方在0.98以上的蛋白浓度范围作为试剂检测的线性范围(图1),其结果显示,4种双抗体夹心法ELISA检测试剂的线性范围分别为0.156~10 ng/mL(FCGR1A)、1.56~50 ng/mL(DUSP3)、0.059~1.875 ng/mL(SEPT4)和0.039~2.5 ng/mL(BATF2)。
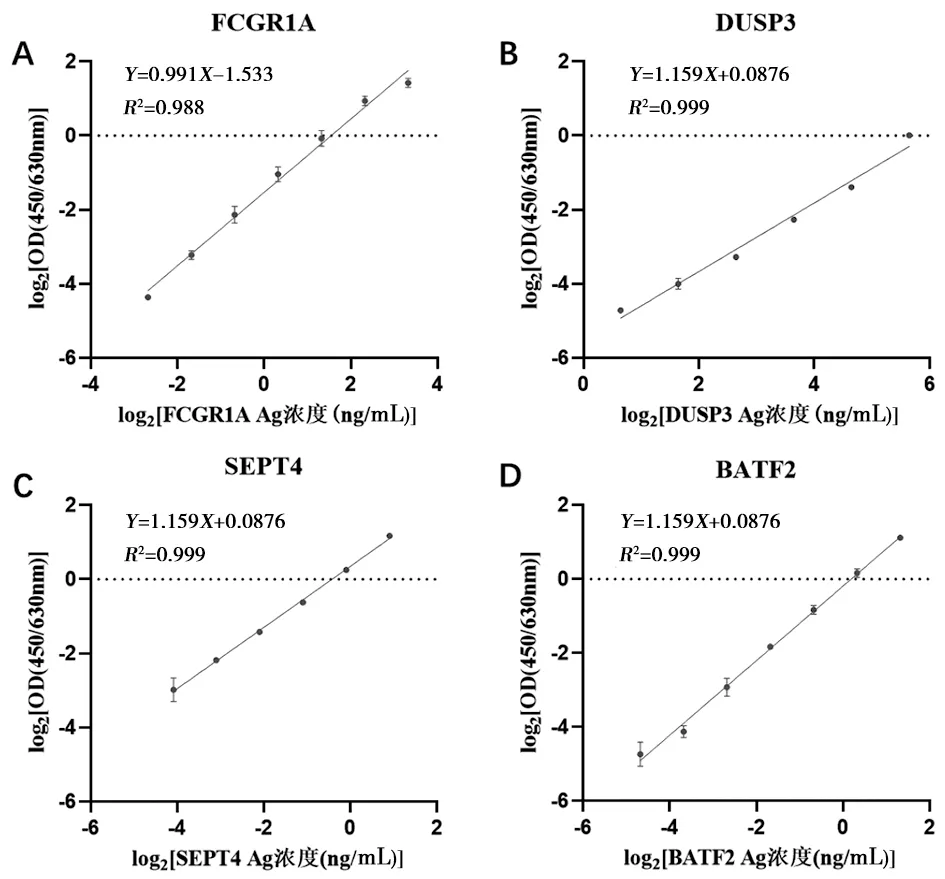
注:A为FCGR1A;B为DUSP3;C为SEPT4;D为BATF2。图1 双抗体夹心法ELISA检测的线性范围Fig.1 Linear range of double-antibody sandwich ELISA
2.3 全血中FCGR1A、DUSP3、SEPT4和BATF2蛋白的水平 为探究FCGR1A、DUSP3、SEPT4和BATF2的全血蛋白水平在活动性结核患者和非结核肺病患者之间是否存在差异,分别用4种ELISA试剂检测30例活动性结核患者和30例非结核肺病患者的外周全血标本。FCGR1A蛋白在活动性结核患者全血中的水平为2.424 (IQR:2.179~2.810)ng/mL,而在非结核肺病患者全血中的水平为2.154 (IQR:2.015~2.335)ng/mL(表3),秩和检验表明两者差异有统计学意义(Z=-2.979,P<0.05)。其他3个标志物在两组患者之间差异无统计学意义(图2)。
2.4 全血FCGR1A蛋白水平区分活动性结核能力的验证 为进一步验证全血FCGR1A蛋白水平区分结核和非结核患者的能力,使用FCGR1A蛋白ELISA试剂检测了另外160份活动性结核和116份非结核肺病患者,结果显示活动性结核患者全血中FCGR1A蛋白的水平为3.377 (IQR:2.181~6.580)ng/mL,而非结核肺病患者为2.003 (IQR:1.390~3.109)ng/mL,秩和检验表明两者差异具有统计学意义(Z=-5.738,P<0.001)(图3)。ROC曲线分析结果显示,FCGR1A检测体系诊断结核病的AUC为0.702(P<0.01)(图4)。根据最大约登指数确定最优Cut off值为3.036 ng/mL,此时灵敏度为73.28% (95%CI:64.57%~80.49%),特异度为60.63% (95%CI:52.89%~67.86%)。
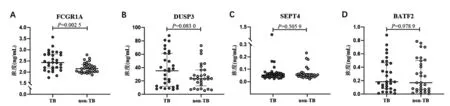
注:A为FCGR1A;B为DUSP3;C为SEPT4;D为BATF2;TB为活动性结核患者;non-TB为肺结核肺病患者。图中加黑短线为中位数,误差线为四分位间距。图2 不同蛋白在活动性结核与非结核肺病患者外周血中的水平Fig.2 Protein levels in the whole blood of patients with active tuberculosis and non-tuberculosis pulmonary disease

表3 患者外周血中FCGR1A、DUSP3、SEPT4和BATF2的蛋白水平 Tab.3 Protein levels of FCGR1A,DUSP3,SEPT4 and BATF2 in patients whole blood
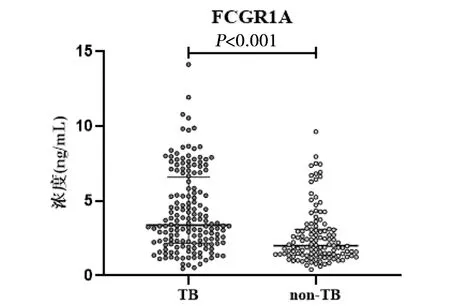
注:TB为活动性结核患者,non-TB为非结核肺病患者。图中加粗的短线为中位数,误差线为四分位间距。图3 FCGR1A蛋白在活动性结核与非结核肺病患者外周血中的水平Fig.3 FCGR1A protein levels in the whole blood of patients with active tuberculosis and non-tuberculosis pulmonary disease
3 讨 论
结核病是世界范围内严峻的公共卫生问题,而诊断困难严重影响结核病的防治工作,且增加了患者的负担。相较于传统痰培养、涂片镜检和核酸检测等基于痰液标本的检测手段,基于非痰液标本(如血液、尿液等)的检测方法可以对无痰肺结核、肺外结核以及HIV共感染等免疫能力低下的患者可以具有更好的诊断效能。外周血转录组学标志物作为基于血液的结核诊断候选靶标,受到越来越多的关注。当前对于结核转录学组标志物的研究大多基于微阵列(Illumina和Affymetrix等)和PCR检测,尽管相关技术已经发展成熟,但在临床推广上仍会受到设备和环境限制,而转化为简便、低成本的免疫检测则更有利于向基层和资源匮乏的地区推广。理论上基因转录水平的差异有可能体现在蛋白水平的差异上,但尚无相关报道。本研究针对经过系统验证过的外周全血转录标志物中的4种常见基因,通过检测其在活动性结核患者和非结核肺病患者外周血中的蛋白水平,发现与其转录水平的表现不一致,仅有FCGR1A的全血蛋白水平在结核和非结核患者间体现出差异。最近,Jiang L等针对人体不同组织脏器的转录组和蛋白质学研究发现,组织中mRNA的丰度与对应蛋白的丰度并不完全一致[18]。因此,在转录水平上可区分结核病和非结核病的标志物,其蛋白水平不一定具有完全相同的临床价值,结核全血转录组学的研究成果尚不能完全指导结核相关宿主蛋白标志物的开发应用。
虽然全血FCGR1A蛋白水平在活动性结核患者和非结核肺病患者之间存在差异,但尚不能达到WHO TPP对于基于非痰液结核筛选试剂的要求。结核病相关的宿主标志物主要是因活动性结核病而引起其转录、翻译水平的变化,单个基因的转录水平或蛋白表达水平在灵敏度和特异性上一般难以具有较好的临床诊断价值,往往需要多个宿主基因转录、表达产物进行联合才能获得较好的诊断效能。如现有已报道的宿主全血转录组学标志物,多有多个基因的转录水平共同组成[6]。因此,如需发展基于宿主外周血蛋白水平的活动性结核免疫诊断技术,则需要发现更多的能区分活动性结核和非结合肺病的宿主全血蛋白标志物,并将其联合应用来提升该方法的临床应用价值。发现更多有潜力的全血蛋白标志物,一是可以将已报道的、在转录水平存在差异的基因在蛋白水平上进行逐一验证;二是可以通过全血质谱的方式在蛋白水平上直接进行筛选。
基于血液免疫检测的新型结核标志物开发具有十分显著的临床意义,不仅可以克服基于痰液检测面临的采样问题,如无痰肺结核、肺外结核等,还可以规避分子检测在中低收入国家和基层医疗机构难以推广应用的问题。但目前已有的基于血液样本的结核免疫学检测方法或多或少都存在一些不足,尚不能完全满足临床对活动性结核诊断的临床性能需求,如结核菌素皮肤试验无法区分是结核感染还是卡介苗接种导致的免疫反应[19],γ-干扰素释放实验IGRA不受卡介苗接种的影响,但无法区分潜伏感染和活动性结核[20],结核抗体检测的灵敏度和特异度均较低。目前基于结核全血转录组学的相关研究已发现并验证了外周全血中部分宿主基因的转录水平能有效区分活动性结核和非结核患者,提示外周血中这些宿主基因的蛋白水平应也有区分二者的能力,但尚无相关研究报道。本研究首次选取在转录水平有差异的代表性基因,探索其在蛋白水平是否也存在类似的活动性结核区分能力,结果表明某些宿主基因的全血蛋白水平确实也同样在活动性结核和非结核肺病间存在差异,但同时也有部分宿主基因的蛋白水平没有表现出与转录水平一致的差异。本研究结果提示全血宿主蛋白标志物的水平活动性结核和非结核患者之间部分存在差异,研发基于蛋白水平的活动性结核免疫检测试剂存在可能性,但同时也发现全血结核转录组学的研究成果对该类试剂研制的指导价值有限。
