结核病DNA疫苗及其作用机制研究进展
2022-04-01李军丽赵爱华
李军丽,赵爱华
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)引起的以呼吸道为主的人兽共患传染性疾病,可累及全身多个脏器,严重危害人类健康[1-2]。随着医药技术的发展,人类在对抗TB方面已取得了一定的成果,包括有效的治疗性药物及预防性疫苗的研发。但由于耐多药(Multidrug resistance,MDR)和广泛耐药(Extensive drug resistant,XDR)结核菌株的出现、人类获得性免疫缺陷病毒(Human immunodeficiency virus,HIV)合并M.tb的双重感染、高危人群流动的日益增多、COVID-19全球大流行以及部分国家对TB的忽视等诸多因素,TB发病率在全世界范围内呈回升趋势[3-4]。据世界卫生组织(World Health Organization,WHO)统计,2020年全球结核潜伏感染(Latent tuberculosis infection,LTBI)人群接近20亿,新发TB患者987万例。我国2020年估算的TB新发患者数为84.2万例,较2019年的83.3万例略有回升,在30个TB高负担国家中我国估算TB发病人数排第2位,仅低于印度的259万例[5]。受COVID-19全球大流行的影响,TB诊断和治疗服务受到中断,致使全球HIV阴性人群的TB死亡人数由2019年的121万例上升至128万例,出现了自2005年以来TB死亡人数首次增加的现象[5]。TB不仅给患者本人的身心带来极大的痛苦和危害,也给患者亲友和社会造成了巨大的负担和影响。
至今,卡介苗(BacilleCalmette-Guérin,BCG)仍是唯一被批准使用以预防TB的疫苗[6],虽然其可大大降低小儿粟粒性结核病和结核性脑膜炎的发病率,但其保护力不稳定,差异较大,对保护成年人免患肺结核(Pulmonary tuberculosis,PTB)的效率并不十分理想,且无法应用于免疫缺陷患者[7-10]。究其原因可能与BCG菌株差异、感染M.tb菌株毒力的差异、M.tb的内源性复燃和外源性再感染、接种人群遗传背景、免疫状态与营养水平以及临床试验方法的差异性等有关。随着疫苗学的迅速发展,新型TB疫苗已得到广泛研究[11],如进入II和III期临床的第1代减毒或重组活疫苗MTBVAC(ClinicalTrials.gov Identifier:NCT03536117)和VPM1002(ClinicalTrials.gov Identifier:NCT03152903),进入IIa和IIb期临床的第2代亚单位疫苗ID93+GLA-SE(ClinicalTrials.gov Identifier:NCT02465216)和M72/AS01E(ClinicalTrials.gov Identifier:NCT04556981)等,第3代腺病毒载体疫苗如Ad5 Ag85A(ClinicalTrials.gov Identifier:NCT02337270)及ChAdOx1 85A-MVA85A(ClinicalTrials.gov Identifier:NCT03681860)等也进入临床试验阶段。同样作为第3代疫苗的核酸疫苗以其多价、经济、稳定等优点成为近年来TB疫苗研究的热点之一,备受疫苗研究工作者的关注。因此,本文就TB DNA疫苗的免疫学机制、研究现状、免疫增强策略、存在的问题及应用前景作一综述,以期为TB DNA疫苗研究提供新的思路和视角。
1 TB DNA疫苗免疫学机制
自1990年Wolff JA等[12]首次报道小鼠经肌肉直接注射纯化的RNA或DNA重组表达载体可使其基因在局部肌细胞内表达数月,甚至持续终生,且未出现外源核酸与宿主染色体整合等现象以来,核酸疫苗成为世界瞩目的传染病防治新工具,被称为疫苗学的“新纪元”。核酸疫苗又称基因疫苗,包括DNA疫苗和RNA疫苗,其中DNA疫苗是指将能诱导机体保护性免疫反应的病原体抗原编码基因和真核表达载体相连接,采用某种方法将重组DNA质粒导入接种者机体,通过宿主细胞的转录、翻译并合成目标抗原蛋白。目标抗原加工形成抗原多肽后与宿主细胞MHC I类和MHC II类分子结合并被呈递给宿主免疫识别系统,诱导机体产生特异性体液免疫和细胞免疫应答,以达到预防或治疗相应疾病的目的[13-15]。针对TB DNA疫苗诱导的各种免疫反应,包括细胞毒性CD8+T细胞介导的Th1型免疫应答,CD4+T细胞介导的Th2型免疫及IFN-γ反应等[16]。目前,提出了TB DNA疫苗刺激宿主免疫系统的两种主要机制:1)内源性抗原诱导机制:即注射部位组织细胞(如肌细胞或上皮细胞等)、专职抗原呈递细胞(Antigen presenting cells,APCs)或其他炎性细胞内化重组质粒DNA并在胞内表达目标抗原。内源性目标抗原经抗原处理相关转运体(Transporter associated with antigen processing,TAP)转运至内质网,通过加工修饰成为具有免疫原性的抗原肽;抗原肽与内质网中合成的MHC I类分子结合,形成抗原肽-MHC I类分子复合物;后者转入高尔基体再通过分泌小泡将其运至组织细胞或APCs表面,供相应CD8+T细胞识别并结合(图1-①和1-②)。2)外源性抗原诱导机制:被分泌至胞外的目标抗原经注射部位APCs吞噬或吞胞饮后形成吞噬体,随后与胞内溶酶体融合形成吞噬溶酶体;外源性目标抗原在吞噬溶酶体内酸性环境中被蛋白水解酶降解为小分子多肽;内质网中合成的MHC Ⅱ类分子进入高尔基体后,由分泌小泡携带,通过与吞噬溶酶体融合,使抗原肽与小泡内MHC Ⅱ类分子结合形成抗原肽-MHC Ⅱ类分子复合物;该复合物表达于APCs表面后被相应CD4+T细胞识别并结合。此外,部分外源性非胸腺依赖性抗原(Thymus-independent antigen,TI-Ag)可直接激活初始B细胞而无需辅助性T细胞的参与,进而诱导机体形成体液免疫应答,产生抗原特异性抗体(图1-③)。
2 TB DNA疫苗研究现状
随着对M.tb致病机制认识的深入,TB DNA疫苗的研制不仅局限于针对未感染人群抗M.tb感染的预防,研发针对LTBI的疫苗,达到抑制、清除宿主体内潜伏感染的细菌,防止TB复发也是其重要的目标之一。基于TB亚单位疫苗研发中积累的大量经验,已有超过60种M.tb抗原被确定为候选优势抗原,并在临床前动物模型中用作抗TB疫苗进行研究。M.tb培养滤液蛋白10(Culture filtrate protein,10 kDa,CFP-10)、早期分泌6 kDa蛋白(Early secretory antigenic target,6 kDa,ESAT-6)、Ag85复合物及热休克蛋白65(Heat shock protein 65,Hsp65)等被广泛研究的抗M.tb保护性抗原同样成为了TB DNA疫苗的候选目标。针对这些优势候选抗原基因,研究者们进行了大量的临床前研究。目前,已有多种TB DNA疫苗在临床前动物实验中获得了比较理想的效果。
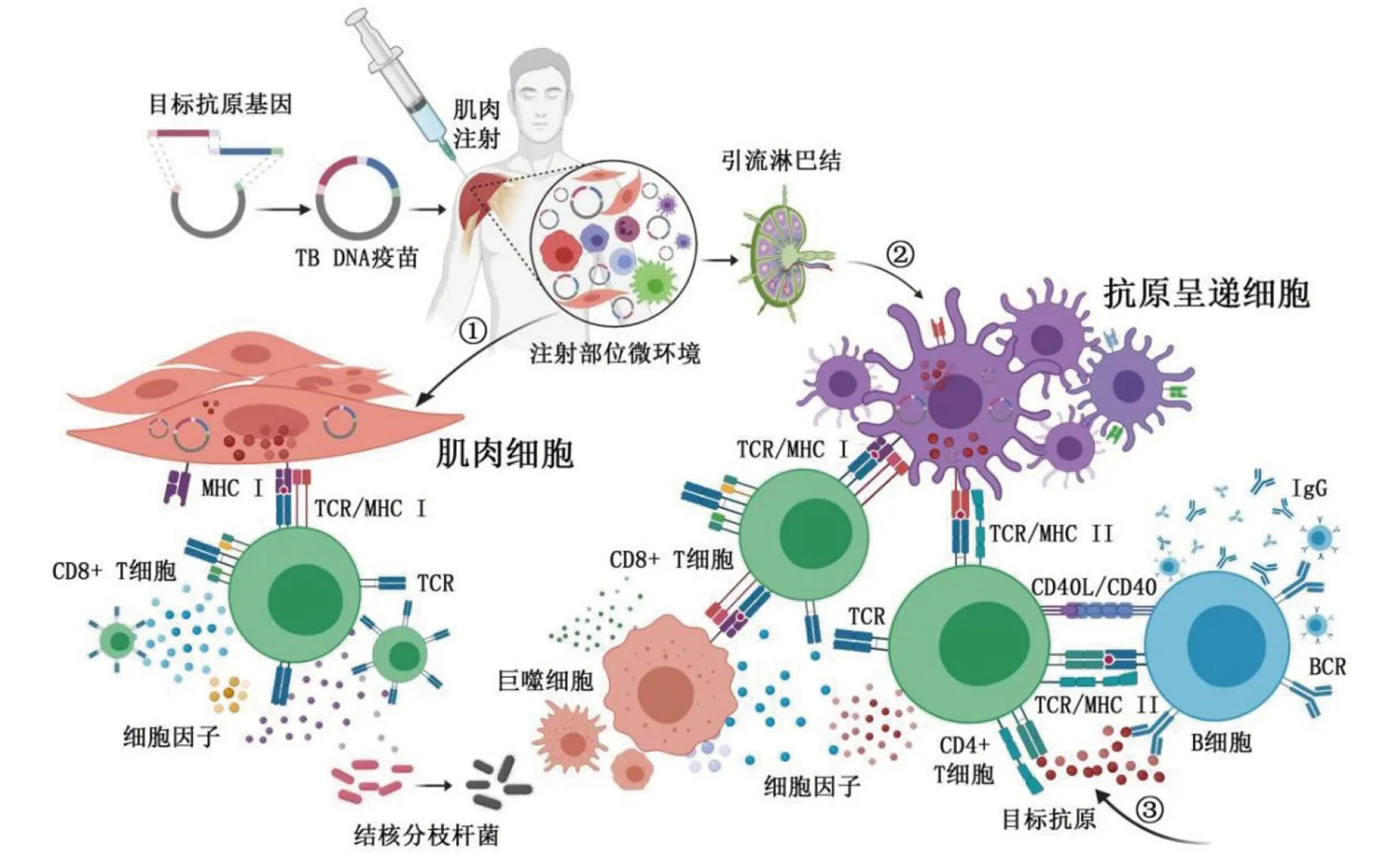
注:①为注射部位肌细胞内化重组DNA质粒,表达目标抗原蛋白(内源性)并递呈抗原肽以激活CD8+ T细胞。②为注射部位APCs内化重组DNA质粒,表达目标抗原蛋白(内源性)并递呈抗原肽以激活CD8+ T细胞。③为被分泌的外源性目标抗原蛋白直接激活B细胞或经MHC II类分子激活CD4+T细胞。图1 TB DNA疫苗经肌肉注射免疫后诱导机体形成免疫应答的可能机制Fig.1 Mechanism of immune response induced by intramuscular immunization with TB DNA vaccine
2.1 CFP-10和ESAT-6 CFP-10和ESAT-6是BCG中丢失的RD1(region of difference,RD)区编码的关键毒力蛋白分子,分别由Rv3874和Rv3875基因编码。两者以完全折叠的结构按1∶1形成紧密的复合物,具有较好的抗原特异性和免疫活性[17-18],其作为新型疫苗的候选抗原除用于TB预防外,亦可作为诊断用特异性抗原用于鉴别M.tb感染和BCG接种[19-20]。
1999年,Kamath AT等[21]就曾尝试用M.tb分泌蛋白MPT64、Ag85B和ESAT-6作为候选基因制备DNA疫苗并在小鼠模型中测试其免疫原性和保护功效。结果发现,DNA疫苗免疫后4周,小鼠IFN-γ CD4+T细胞活化增强,同时体内产生高滴度抗原特异性IgG抗体。这3种DNA载体均显示出一定的保护作用,且其中Ag85B效果最佳,其他依次为ESAT-6和MPT64,但遗憾的是上述三种DNA疫苗均未达到用BCG免疫后形成的保护水平。国内学者王雪梅等[22]构建pVAX1/ESAT-6疫苗,并经电转染免疫小鼠。结果发现,免疫小鼠血清中抗ESAT-6特异性抗体IgG水平明显升高,血清中IFN-γ水平、小鼠脾淋巴细胞增殖水平及分泌IFN-γ淋巴细胞数明显均高于空质粒组和生理盐水对照组。
除单独采用包括ESAT-6在内的M.tb蛋白基因构建成TB DNA疫苗外,与细胞因子或其他蛋白因子构建成多顺反子DNA质粒也被广泛研究。其中Maue AC及其团队[23]发现质粒编码的GM-CSF和CD80/CD86新型ESAT-6:CFP10 DNA疫苗共同给药可增强抗原特异性细胞介导的免疫反应。与单独ESAT-6 DNA疫苗接种相比,ESAT-6:CFP10+GM-CSF+CD80/CD86 DNA 疫苗接种动物表现出外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)CD25表达上调,ESAT-6:CFP10特异性IFN-γ分泌细胞增加以及抗原特异性细胞增殖反应增强等。同时,在一项低剂量毒性牛结核分枝杆菌气溶胶攻击试验中,出生时接种BCG或ESAT-6:CFP10+GM-CSF+CD80/CD86 DNA的小牛在感染后表现出肺和肺相关淋巴结的病变严重程度降低。此外,抗菌肽β-防御素-2与ESAT-6构建的融合DNA疫苗pDE同样显示出与BCG相似的保护功效。pDE免疫小鼠对H37Rv标准株及高毒力临床分离株LAM 5186的攻击形成有效抵抗,感染后的小鼠存活率、肺细菌负荷和组织损伤均得到有效改善。而BCG初免,然后用pDE进行加强的动物则显示出更高的存活率和更少的肺组织损伤[24]。国内学者王庆敏等[25]评估了针对M.tb的泛素(UbGr)融合ESAT-6 DNA疫苗后发现,UbGR-ESAT-6融合DNA疫苗接种改善了抗原特异性细胞免疫反应,与非融合DNA疫苗相比,UbGR-ESAT-6融合DNA疫苗免疫的小鼠中,Th1型细胞因子IFN-γ、IgG2a与IgGl相对比率以及增殖性T细胞反应的产生显著增强。同样,Xu J等[26]构建了一种编码ESAT-6和树突细胞生长因子Flt3配体的重组DNA疫苗pIRES-ESAT-6-FL,该疫苗免疫的小鼠表现出更强的Th1型免疫反应,伴随着更高水平的脾脏淋巴细胞增殖,Th1型细胞因子(IFN-γ和IL-2)以及血清特异性抗体的增加,较低水平Th2型细胞因子(IL-4和IL-10)分泌等。随后,该团队进一步构建编码ESAT-6 3个T细胞表位和Flt3配体的新型重组质粒,并采用肌肉注射该DNA疫苗和鼻内施用表位肽的策略来诱导小鼠更高的免疫反应。最后得到了前期研究相一致的结果,而且还显著增强了其对M.tb攻击的保护作用[27]。
针对ESAT-6 DNA疫苗的治疗作用,Lowrie等[28]曾报道,经ESAT-6 DNA疫苗治疗后,小鼠肺和脾脏中的M.tb荷菌量减少,T细胞谱向Th1型免疫应答方向改变。Yuan W等[29]也同样发现,小鼠接种由ESAT-6与Ag85B及HspX构建的多顺反子质粒DNA疫苗pAEH后,其外周血CD4+和CD8+T细胞比例,分泌ESAT-6、Ag85B和HspX特异性IFN-γ T细胞频率上升,同时伴随着体外IFN-γ和IL-2的产生水平显著增加。此外,被治疗小鼠肺部和脾脏结核样炎症减轻,M.tb的复制被明显抑制等。但值得注意的是吴雪琼团队等则发现相比于单一Ag85A DNA疫苗,含有一个ESAT-6基因拷贝的Ag85A/ESAT-6嵌合DNA疫苗在MDR-TB感染小鼠中的免疫治疗效果被降低[30],而插入两个ESAT-6基因拷贝的嵌合DNA疫苗,则进一步加速MDR-TB临床分离株和药物敏感株感染小鼠的死亡率速度[31]。这也与国外学者Dey B等[32]早期报道新型TB DNA疫苗DNAE-6加强针消除ESAT-6重组卡介苗(rBCG)对豚鼠抗M.tb感染的保护作用相一致。
2.2 Ag85复合物 Ag85复合物是M.tb主要的分泌性蛋白,可从早期培养物中分离,作为重要的毒力因子,其主要通过纤维连接蛋白和弹性蛋白结合并介导M.tb的黏附、侵袭及细胞壁的合成[33-35]。复合物由在氨基酸和基因水平上具有广泛交叉反应性和同源性的Ag85A、Ag85B和Ag85C 3个组分构成,分别由fbpA(Rv3804c)、fbpB(Rvl886c)和fbpCl(Rv3803c)基因编码[36]。Ag85分子能刺激Th1细胞活化并诱导其分泌TNF-α、IFN-γ等多种细胞因子,活动性TB患者血清中也存在大量Ag85特异性抗体[37-38]。正由于这个特性,Ag85复合物在TB诊断和疫苗研发[39]、免疫治疗[40]等方面有着重要的应用潜力。
1996年,Huygen K及其团队[41]对编码Ag85的DNA疫苗免疫原性进行了评估,其发现这些构建体能很好的诱导小鼠体液和细胞免疫反应,并在接下来的抗M.tb保护效果研究中发现Ag85C基因重组DNA疫苗效果不及Ag85A和Ag85B。随后,D’Souza S等[42]也同样证明,Ag85 DNA疫苗经肌肉注射免疫C57BL/6(H-2b)和BALB/c(H-2d)小鼠后,M.tb感染的C57BL/6小鼠对Ag85A和Ag85B来源的抗原肽反应强烈,但对来自Ag85C的抗原肽没有反应;而M.tb感染的BALB/c小鼠仅对来自Ag85A的抗原肽反应。
针对Ag85复合物DNA疫苗不同的免疫方案,Tanghe A等[43]用Ag85质粒DNA、Ag85蛋白以及Ag85质粒DNA初免-Ag85蛋白加强方案免疫C57BL/6小鼠后发现,相比于单独的Ag85蛋白佐剂疫苗,DNA疫苗免疫诱导了更强大的Th1型细胞因子反应,且Ag85质粒DNA初免-Ag85蛋白加强免疫后小鼠脾淋巴细胞中IL-2和IFN-γ反应增加了两到四倍。上述3种免疫方案均能诱导机体产生抗Ag85抗体,但Ag85蛋白佐剂疫苗主要诱导IgG1,而Ag85质粒DNA和DNA初免-蛋白质加强疫苗接种则优先诱导IgG2a抗体的分泌。同时,攻毒实验也发现,外源性Ag85蛋白强化了Th1型CD4+辅助性T细胞在介导保护性免疫应答中的主导作用,加强了DNA疫苗对M.tb攻击感染的保护功效。同样,基于表达Ag85B和Rv3425抗原的DNA疫苗和慢病毒载体疫苗在增强BCG免疫效果和保护C57BL/6小鼠抗M.tb感染方面的研究中发现,慢病毒载体和DNA疫苗极大地提高了BCG对M.tb的保护功效,表现为免疫小鼠体重下降变缓、肺部细菌负荷和组织学损伤显著减轻等[44]。而在另一项以编码堪萨斯分枝杆菌Ag85B蛋白的rBCG-Mkan85B初免,表达Ag85B基因的质粒DNA(DNA-Mkan85B)进行加强免疫的研究中同样发现,DNA-Mkan85B能显著增强小鼠CD8+T细胞抗M.tb免疫应答,并有助于克服当前BCG在抗M.tb保护性免疫方面有限的有效性[45]。
与其他分枝杆菌或非分枝杆菌抗原结合构建编码Ag85A多顺反子DNA疫苗也逐渐被证明是预防TB的有效方法。Zhang X等[46]在研究Ag85A 共表达GM-CSF质粒DNA疫苗中发现,GM-CSF单独或组合共表达对BALB/c小鼠模型中CD4+和CD8+T细胞IFN-γ反应、CTL细胞活性和M.tb攻击的免疫保护作用显著增强。IL-15融合表达构建pcDNA3.1-Ag85A-IL-15质粒肌内免疫C57BL/6小鼠3次后,接种pcDNA3.1-Ag85A-IL-15的小鼠在肺中产生了更多的分泌性IgA (sIgA),并获得了对Ag85A增强的血清IgG反应。免疫小鼠IgG2a/IgG1比率上调,自然杀伤细胞活性及Ag85A特异性脾脏T细胞增殖增强。CD4+T细胞向Th1型极化,并显著上调血清中IFN-γ的水平[47]。Mir FA等[48]利用来自口蹄疫病毒的自裂解肽2A与Rv3407、Ag85A及HspX构建新型TB DNA疫苗,结果发现接种V-2A疫苗的小鼠对所有3种抗原都产生了抗原特异性细胞和体液反应,对M.tb气溶胶攻击的保护作用与BCG相当。同样,国内学者Yao W等[49]将牛疱疹病毒1 VP22 (BVP22)编码基因与Ag85B编码基因整合到DNA载体中,并与单独编码Ag85B的质粒DNA比较其在C57BL/6小鼠中的免疫反应和保护功效。结果发现,小鼠免疫后,除了IFN-γ分泌细胞的数量增加外,共表达BVP22和Ag85B的DNA诱导的Ag85B特异性抗体和脾淋巴细胞增殖反应也显著高于仅接种编码Ag85B的DNA免疫的小鼠。此外,根据肺和脾脏的组织病理学检查和细菌载量测定,BVP22-Ag85B DNA免疫引起的对静脉内M.tb攻击的保护超过了单独由Ag85B DNA引起的反应,且与BCG疫苗无显著性差异。
2.3 热休克蛋白65 Hsp65是Hsp家族中被研究最多、最有希望成为TB疫苗有效抗原的成员之一[50]。Hsp65蛋白细胞表位较多,结构和功能类似于真核Hsp70蛋白,在基质金属肽酶9的水解下,产生大量可刺激宿主适应性免疫应答的免疫原性肽[51]。
早期研究表明,小鼠注射编码M.tb单一抗原Hsp65的质粒DNA后,机体被诱导产生特定的细胞和体液免疫反应,并对随后的M.tb攻击产生抵抗,其保护作用与BCG疫苗相当,且显著优于Hsp65蛋白抗原的免疫效果[52]。国内学者Dai W等[53]也发现,小鼠经肌肉注射100 μg Hsp65或Hsp70 DNA疫苗后,其脾淋巴细胞增殖能力较生理盐水对照组、空载体组显著增强,腹腔巨噬细胞分泌NO水平、血清IL-2和IFN-γ含量也显著上升。Hsp70 DNA疫苗可明显增强小鼠免疫应答,但其强度似乎不如Hsp65 DNA疫苗。BALB/c和C57BL/6小鼠经Hsp65和Hsp70 DNA疫苗初免,BCG加免后发现,这种异源初免-加强免疫方法显著提高了BCG对小鼠抗M.tb感染的疫苗接种效果[54]。进行鼻内或皮下BCG初免,DNA-Hsp65加强的免疫策略也得到了类似的结果[55]。然而,另一项研究则发现新生期接种BCG疫苗的小鼠,成年期再接种pVAXhsp65 DNA疫苗加强剂的保护功效发生明显改变。免疫小鼠虽能检测到高水平的血清抗hsp65抗体、IFN-γ和IL-5等细胞因子,且肺匀浆中也均能检测到这些细胞因子的存在,但该疫苗未能显著降低感染小鼠肺组织荷菌量以及减轻肺实质的结核样炎症。这表明BCG疫苗的预致敏增强了pVAXhsp65 DNA疫苗的免疫原性,但未能增强成年小鼠抗M.tb攻击的保护力[56]。
除单独表达Hsp家族抗原外,融合其他因子以增强疫苗免疫效果也是构建TB DNA常用方法。日本学者Masaji Okada研究团队等用日本血凝病毒(Hemagglutinating virus of Japan,HVJ)递送表达Hsp65和IL-12的DNA疫苗用于TB预防和治疗[57]。小鼠和食蟹猴TB疫苗预防评价模型中,HVJ-E/Hsp65 DNA+IL-12 DNA与BCG疫苗具有协同作用,该DNA疫苗表现出较强的预防功效,M.tb感染小鼠存活率为100%[58-59]。治疗效果评价模型中,MDR-TB和XDR-TB 感染DBA/1小鼠模型经3次HVJ-E/Hsp65 DNA+IL-12 DNA疫苗治疗后,小鼠存活时间延长且体内肝脏、脾脏和肺组织等M.tb荷菌量均显著减少。非人灵长类动物中,HVJ-E/Hsp65 DNA+IL-12 DNA疫苗能显著增加TB感染猴子的体重,改善红细胞沉降率,并促进机体外周血淋巴细胞(Peripheral blood lymphocyte,PBL)增殖和IL-2的产生;感染猴治疗后16周的存活率为100%,显著高于生理盐水对照组的60%[60]。同样,国内学者师长宏等[61]构建的Hsp65-IL-2-DNA疫苗也可通过改善小鼠Th1型反应以增强Hsp65-DNA疫苗对小鼠TB的免疫原性及治疗效果。胡方靖等[62]构建Hsp65和hGMCSF双顺反子真核表达质粒pIHsp65GM并研究其作为TB DNA疫苗的免疫原性及其对M.tb感染小鼠的保护效果。结果表明,pIHsp65GM DNA疫苗能有效诱导小鼠产生特异性IgG抗体,促进脾淋巴细胞增殖和IFN-γ分泌,且免疫小鼠脾脏和肺组织荷菌量均低于对照组。王庆敏等[63]也发现Hsp65融合UbGr同样可以增强特异性细胞介导的免疫应答,与单独使用Hsp65 DNA疫苗组相比,UbGr-Hsp65 DNA疫苗更能显著诱导小鼠体内Th1免疫反应的极化,改善脾脏T细胞的增殖以及IFN-γ等的产生。
3 增强TB DNA疫苗免疫效果的策略
临床前动物实验中,单一或多种TB DNA疫苗联合使用均获得了一定的保护效果,但很难达到或超过经典疫苗BCG的保护效率。此外,相同DNA疫苗免疫效果在不同动物个体中差异较大,有些疫苗在小型啮齿类动物中免疫保护效果较好,但在如豚鼠、非人灵长类等中大型动物中的保护效果却表现不佳。影响TB DNA疫苗免疫效果的因素有多种,而只有针对性的提出解决策略,各个击破,才能从根本上提升TB DNA疫苗的免疫效率。
3.1 选择合适的保护性抗原基因 保护性抗原基因即DNA疫苗表达的目标蛋白基因,M.tb大约有4 000个基因,各种各样的蛋白质有数千种。TB DNA疫苗要求表达出的蛋白分子可诱导机体产生抗M.tb的保护性免疫应答,同时考虑该基因是否需要进行密码子优化,有无内含子以及是否能在哺乳动物细胞中被正确剪切、转录与表达。此外,目标抗原是否为单一抗原、多抗原重组或与其他细胞因子嵌合表达,以及被表达抗原为分泌型或非分泌型等。
3.2 选择合适的表达载体与启动子 TB DNA疫苗能否在哺乳动物细胞内高水平地表达出保护性抗原,表达载体和启动子的选择尤为重要。载体满足在原核宿主细胞,如大肠杆菌中拷贝复制,而在真核细胞内不复制、不整合至宿主染色体外,不同载体所含的酶切位点也与其进入机体后的稳定程度有关。目前,用于构建DNA疫苗的载体质粒有多种,如pcDNA3.0、pcDNA3.1、pcDNA4.0、PC1、pSV2、pGFP、VR1320和pBK 等,但多数疫苗主要以PUC或pBR322为基本骨架。此外,作为控制外源基因表达的启动子也存在组织特异性,其来源和强弱也有明显差异,如猿猴空泡病毒40(Simian virus 40,SV40)、人巨细胞病毒(Human cytomegalovirus,CMV)以及人延长因子1α(Elongation factor-1α,EF-1α)启动子等,强启动子可短时间内诱导机体产生较强的免疫应答,而弱启动子则可能诱导长期的持续性免疫应答。其中以CMV启动子的调节功能最佳,因此应用也最多。载体除具有增强子-启动子、选择标记(Ampr、Kanr)、PolyA尾、翻译起始和转录终止序列等元件外。有些载体还具有内含子序列,以起到显著提升外源基因表达水平的作用。
3.3 选择合适的疫苗递送方式 鉴于TB DNA疫苗转染效率较低的特性,有必要将质粒疫苗有效地递送至目标组织或细胞。不同递送途径下接种部位参与的免疫应答细胞不同,所诱发的保护性免疫效果也存在有一定的差异。TB DNA疫苗可以通过不同递送方式进行给药,包括化学法(如,纳米颗粒和脂质体包裹)、物理法(如,电穿孔、基因枪和微针贴)、生物法(如,细菌和病毒载体)及常规注射器注射(如,肌内、皮内和静脉接种)等[64-66]。安全有效的递送载体和递送方式,一方面促进组织细胞对DNA疫苗的摄取,同时保护DNA疫苗免受血清或胞质核酸酶的破坏[67];另一方面,高效新颖的递送方式大大节约了DNA疫苗的用量,减轻接种部位的组织损伤。
3.4 选择合适的基因疫苗佐剂 与传统的TB亚单位疫苗佐剂不同,TB DNA疫苗佐剂主要为蛋白分子类佐剂,它们的功能是通过靶向先天免疫受体或调节分子信号通路的介导来激活机体体液或细胞免疫应答。佐剂因子既可构建成表达质粒与目的基因质粒联合接种,也可将佐剂因子基因与保护性抗原基因连接成融合基因后插入表达质粒进行共表达,其主要包括细胞因子、趋化因子、协同刺激分子、补体分子、PRR激动剂和免疫靶向基因等[68-71]。
3.5 选择合适的疫苗接种剂量与免疫程序 尽管DNA疫苗的优点之一是较长的免疫持久性,单针接种即可获得长期免疫力,但加强免疫亦可明显增强其应答水平。同时,适宜的接种剂量、间隔时间和接种针次才能确保机体获得满意的免疫应答水平。接种高剂量DNA疫苗,一方面,质粒DNA可能在体内长期过高水平地表达外源性抗原,最终导致机体对该抗原出现免疫耐受;另一方面,质粒DNA可能诱导自身免疫反应,接种后出现抗DNA抗体,影响TB DNA疫苗的免疫效果。
4 TB DNA疫苗研究存在的问题
DNA疫苗的研究是近20年发展起来的一项新的生物技术,它已成为疫苗研究领域中的热点之一,特别是其研究方向与WHO儿童疫苗计划中关于利用一种疫苗预防多种疾病的长远目标相吻合,现在已获得了迅速的发展。TB DNA疫苗也正基于一种疫苗用于包括LTBI在内的不同类型TB的防治目标,研发了不少预防性或治疗性疫苗,被认为在TB防治中占有很大的优势。近年来,尽管TB DNA疫苗取得了可喜的进展,但同时也存在着一些“瓶颈问题”制约着此类疫苗的研发步伐。
4.1 疫苗的安全性仍存在一定争议 虽然DNA疫苗接种后整合入宿主细胞基因组、引起宿主细胞发生恶性转化或免疫系统功能紊乱的可能性很少,且目前所有临床前动物模型研究均已证明该类疫苗安全可靠,但没有足够的临床依据能排除这种理论上的可能危险。WHO在《关于DNA疫苗质量保证指南》中也要求DNA疫苗的研制必须考虑其特殊的安全性等问题。此外,由于用于一般化学药物的传统安全性或毒性试验对重组DNA产品不一定适用,用传统毒性试验来评价重组DNA产品往往也存在一定的困难,并受到多种因素的影响。我国《人用重组DNA制品质量控制技术指导原则》也提出,对重组DNA产品的临床前安全性试验要求,除了一般生物制品的毒性试验要求之外,应采取较为灵活的处置方法。
4.2 疫苗的作用机理尚需进一步探讨 DNA疫苗在宿主的注射组织部位表达保护性目标抗原,从而激发免疫应答,这个过程与胞内感染的M.tb侵入宿主细胞的过程相似,但作用机制却有本质的区别。DNA质粒引入体内后,其必须通过所有DNA递送系统共有的屏障才能转染至组织细胞或目标APCs。然而,如树突状状细胞(Dendritic cells,DCs)等对外来DNA质粒引入其细胞具有抗性,从而使编码外来抗原的DNA载体难以进行转染[72-73]。因此,在研究TB DNA作用机制的同时,更需克服DNA转染过程中来自胞内与胞外的其他屏障。
4.3 疫苗评价的内容需进一步完善 由于DNA疫苗的特殊性,使得其与传统BCG疫苗或亚单位蛋白疫苗评价内容有所不同,国际上包括我国在内对DNA疫苗的产品质量及生产过程提出相关技术指导原则[74],但针对TB DNA疫苗包括其原材料、生产以及最终产品等质量的控制尚需进一步完善。如表达载体和宿主细胞、诱发机体病理性自身免疫的抗DNA“抗体”评价。DNA质粒中残留的内毒素(≤ 10 E.U./mg pDNA)、细菌基因组gDNA(≤ 2 μg/mg pDNA)、RNA(≤ 0.2 μg/mg pDNA)和蛋白质(≤ 3 μg/mg pDNA)等不同杂质纯度评价。DNA疫苗超螺旋(SC构型)、开口环状(OC构型)及线性(L构型)等不同质粒构象比率评价。DNA疫苗抗生素、RNase酶残留量评价以及DNA疫苗自身保护效力标准的制定等。
4.4 临床前动物模型需进一步优化 临床前动物试验是疫苗安全性和有效性的重要保证,是疫苗进入临床研究的最后一道关卡。TB DNA疫苗的有效性研究在小鼠、豚鼠或非人灵长类动物模型中表现出不一致的现象。一方面,与TB动物模型选用动物品系及建模标准的不统一有关;另一方面,不同年龄、不同品系及不同动物个体肌间结缔组织不同。大个体动物的结缔组织更为丰富,因而与肌肉注射后DNA载体的转染效率较低等有关。
5 TB DNA疫苗的应用前景
目前,人们对DNA疫苗的研究日益深入,其中艾滋病和T细胞淋巴瘤的DNA疫苗已进入了临床前研究,前列腺癌、肺癌、乳腺癌等DNA疫苗也正处于不同的研究阶段。美国FAD已批准了包括COVID-19(ClinicalTrials.gov Identifier:NCT04591184)、单纯疱疹病毒2型疫苗(ClinicalTrials.gov Identifier:NCT00274300)以及乙型肝炎疫苗(ClinicalTrials.gov Identifier:NCT00513968)在内的多种DNA疫苗进入临床试验,这预示着DNA疫苗在21世纪将成为人类与各种疾病抗争的有利武器,也显示出DNA疫苗的巨大潜力和应用前景。TB DNA除借助传统优势抗原以外,利用计算机模拟技术结合生物信息学和免疫学等分子建模方法已被广泛用于新型TB DNA疫苗设计和分析[75-80]。通过计算机方法预测M.tb蛋白潜在T细胞表位及其与MHC分子不同等位基因的结合能力,筛选出各种保护性抗原的优势表位用于新型TB DNA疫苗构建。随着研究的不断深入,相信将来有一天,TB DNA疫苗可以突破其劣势的一面,向着更安全、更有效、更经济的方向发展,在TB疫苗中扮演举足轻重的角色,为全球终止TB疫情提供力量。
