艾绒的质量标准提高研究
2022-03-31袁铭铭姚闽雷景邦
袁铭铭,姚闽,雷景邦
1.江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029;2.江西省药品监督管理局,江西 南昌 330029
艾叶Artemisiae ArgyiFolium 来源于菊科蒿属植物艾Artemisia argyiLevl.et Vant.的干燥叶,具有散寒止痛,温经止血的功效[1]。现代研究表明,艾叶的化学成分主要为挥发油类、有机酸类、黄酮类以及三萜类等[2-5]。艾叶具有平喘镇咳、抗病毒、解热镇静、止血、祛痰、抗凝血、抗菌、抗氧化等作用[4-6]。艾绒是由艾叶料剔除尘土粗梗、粉碎、然后过筛筛除叶肉、叶梗以及叶脉等粉末得到筛上层艾绒[7],目前市场上出售的艾绒,多数标以比例2∶1、5∶1、10∶1、15∶1、30∶1 等标签,如叶绒比2∶1的表示为将2 kg 的艾叶制备得到1 kg 的艾绒,即艾绒在炮制过程中筛除掉的杂质越多,得到的艾绒的量越低,艾绒的纯度越高,一般质量越好。而目前对于艾绒质量的研究较少。本研究为艾绒建立稳定、可靠、准确的鉴别和含量测定方法,填补该药质量标准项下空白项,为其质量控制提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有DFY-1000C 高速摇摆式粉碎机(温岭市林大机械有限公司),Agilent 1260 型高效液相色谱仪(HPLC)(美国Agilent 公司),XSE-205 型十万分之一电子天平(瑞士梅特勒-托利多公司),ME204TE 型万分之一电子天平(瑞士梅特勒-托利多公司)。
1.2 主要药品与试剂
异泽兰黄素(批号:CFN99117,纯度99.2%)对照品购于上海洽姆仪器科技有限公司;艾叶(批号:121345-201804)对照药材购于中国食品药品检定研究院;乙腈(SIGMA 公司)为色谱纯;水为去离子超纯水,其他试验用试剂试药均为分析纯。
本研究共收集艾叶药材5 批,分别来自江西赣州(1 批)、湖北蕲春(1 批)、湖北随州(1 批)和河南南阳(2 批),所有药材经鉴定均为菊科植物艾的干燥叶。参考艾绒制备工艺流程,本研究采用DFY-1000C 高速摇摆式粉碎机将各批次艾叶粉碎,将粉碎的艾叶过筛,通过过筛后剩余艾绒的质量制成不同叶绒比的艾绒饮片,具体艾绒信息见表1。

表1 20批不同叶绒比等级的艾绒信息
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 供试品溶液制备 称取艾绒样品1 g,加石油醚(60~90 ℃)25 mL,超声处理30 min,过滤,滤液蒸干,用正己烷1 mL 使溶解,即得。
2.1.2 对照药材溶液制备 取艾叶对照药材1 g,按照“2.1.1”项下方法制备对照药材溶液,即得。
2.1.3 方法与结果 照《中国药典》(2020 年版四部附录)薄层色谱法[8]试验,分别吸取艾叶对照药材溶液和供试品溶液各5 μL,点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-甲苯-丙酮(10∶8∶0.5)作为展开剂,2%香草醛硫酸溶液为显色剂,并在105 ℃加热至斑点显色清晰,日光下检测,在和艾叶对照药材色谱相应的位置上,显相同颜色的斑点。经过验证,该方法斑点分离度较好、斑点清晰,可作为艾绒的专属性鉴别方法,色谱图如图1 所示。
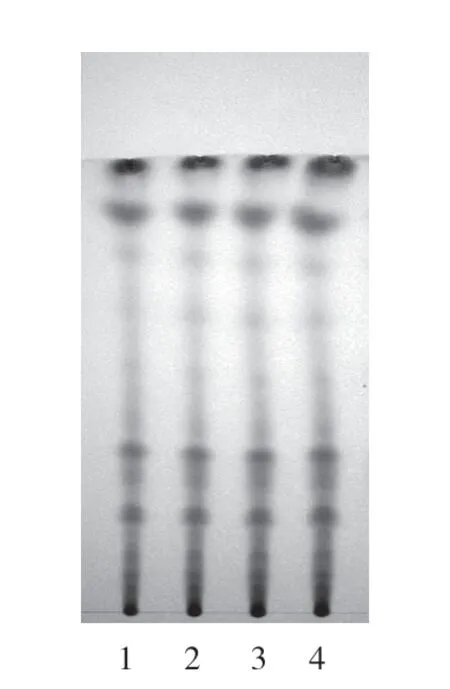
图1 艾绒与对照药材的薄层色谱图
2.2 高效液相含量测定
2.2.1 溶液制备(1)艾绒样品溶液的制备:取艾绒样品0.5 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇溶液50 mL,称定重量,加热回流1 h,放冷至室温,再次称重,用80%甲醇溶液补足减失的重量,摇匀,经0.45 μm 微孔滤膜滤过,取续滤液,即得。(2)异泽兰黄素对照品溶液的制备:精密称取异泽兰黄素对照品18.85 mg,置于100 mL容量瓶中,用80%甲醇使溶解并定容至刻度,摇匀,精密量取上述异泽兰黄素对照品溶液5 mL 置于50 mL 容量瓶中,用80%甲醇使溶解并定容,摇匀,即得每1 mL 含异泽兰黄素浓度为0.018 7 mg/mL 的对照品溶液。(3)空白溶液的制备:以供试品的提取溶液(80%甲醇溶液)作为空白溶液。
2.2.2 色谱条件 采用CAPCELL PAK C18MG Ⅱ S5(4.6 mm×250 mm,5 μm)色谱柱,以乙腈-0.1%磷酸溶液(36∶64)为流动相;流动相流速为1.0 mL/min;设定波长为344 nm;柱温30 ℃;进样体积为10 μL。
2.2.3 专属性考察 分别精密吸取“2.2.1”项下供试品溶液、异泽兰黄素对照品溶液以及空白溶液,按“2.2.2”项下色谱条件进样测定,记录色谱图。结果如图2 所示,待测成分的色谱峰分离度良好,理论塔板数按异泽兰黄素色谱峰计不低于5 000;空白溶液对待测成分均无干扰,表明该方法专属性好。
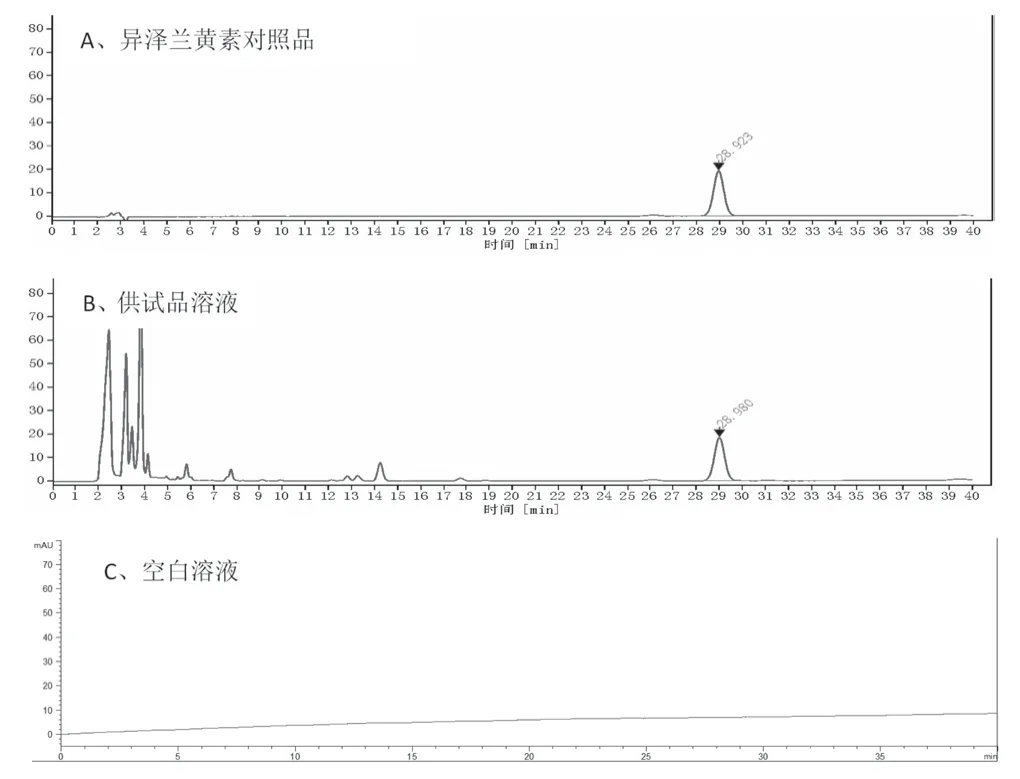
图2 艾绒的HPLC色谱图
2.2.4 线性关系的考察 精密吸取“2.2.1”项稀释后的对照品溶液1、2、5、10、20、30 µL,分别按“2.2.2”项色谱条件进样测定,以异泽兰黄素的进样量(x,µg)作为横坐标,测得的峰面积为纵坐标(y)进行线性关系考察,得回归方程Y=3 188.693 3X+4.759 6,r=0.999 9。结果表明,异泽兰黄素在0.018 7~0.561 µg 和峰面积具有较好的线性关系。
2.2.5 精密度试验 精密吸取异泽兰黄素对照品溶液10 μL,照“2.2.2”项下色谱条件进行进样测定6 次,记录峰面积。结果,异泽兰黄素峰面积的RSD(n=6)为0.35%,表明该仪器的精密度良好。
2.2.6 重复性试验 称取同一艾绒样品(编号AR-1)6 份,每份0.5 g,精密称定,按“2.2.1”项下方法制备艾绒样品溶液,然后按照“2.2.2”项下色谱条件进行进样测定峰面积,记录每份样品的峰面积,并按外标法计算艾绒样品中异泽兰黄素的含量。结果测得异泽兰黄素的平均含量(n=6)为1.747 mg/g,RSD 为0.71%,表明该方法的重复性良好。
2.2.7 稳定性试验 取同一艾绒样品(编号AR-1),按“2.2.1”项下方法制备艾绒样品溶液,分别与制备后在室温下放置0,2,4,8,12,24 h 后照“2.2.2”项下色谱条件进行进样测定,记录峰面积,结果,异泽兰黄素峰面积的RSD(n=6)0.50%,表明该艾绒样品溶液在室温下放置24 h 内稳定。
2.2.8 加样回收率试验 分别精密称取已知含量的艾绒样品(编号AR-1)6 份,每份0.25 g,精密称定,分别按已知量的100%加入含异泽兰黄素(0.009 35 mg/mL)的溶液50 mL,按“2.2.1”项下方法制备回收率样品溶液,然后照“2.2.2”项下色谱条件进行进样测定,记录峰面积,计算加样回收率。结果见表2。
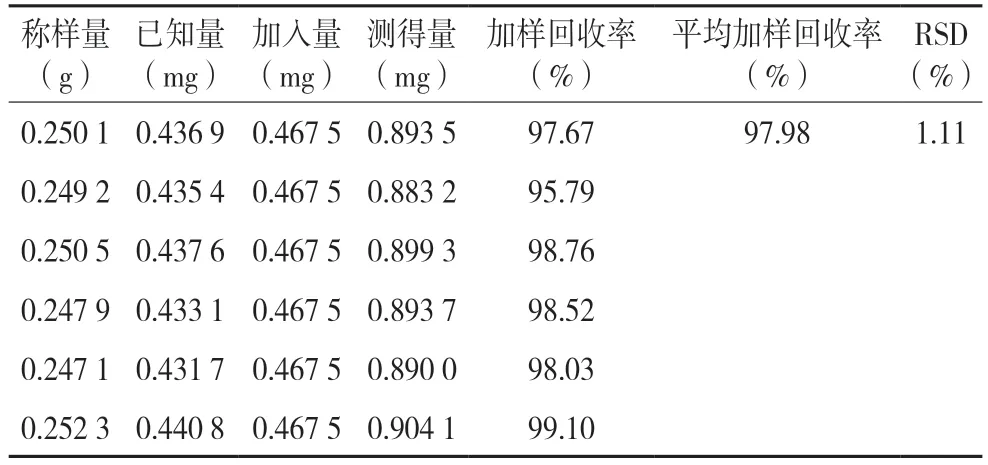
表2 艾绒中异泽兰黄素的加样回收率试验结果(n=6)
2.2.9 艾绒样品含量测定 取20 批艾绒样品,按“2.2.1”项下方法制备艾绒样品溶液,然后照“2.2.2”项下色谱条件进样测定,记录峰面积,并按外标法分别计算艾绒样品中异泽兰黄素的含量,结果见表3。
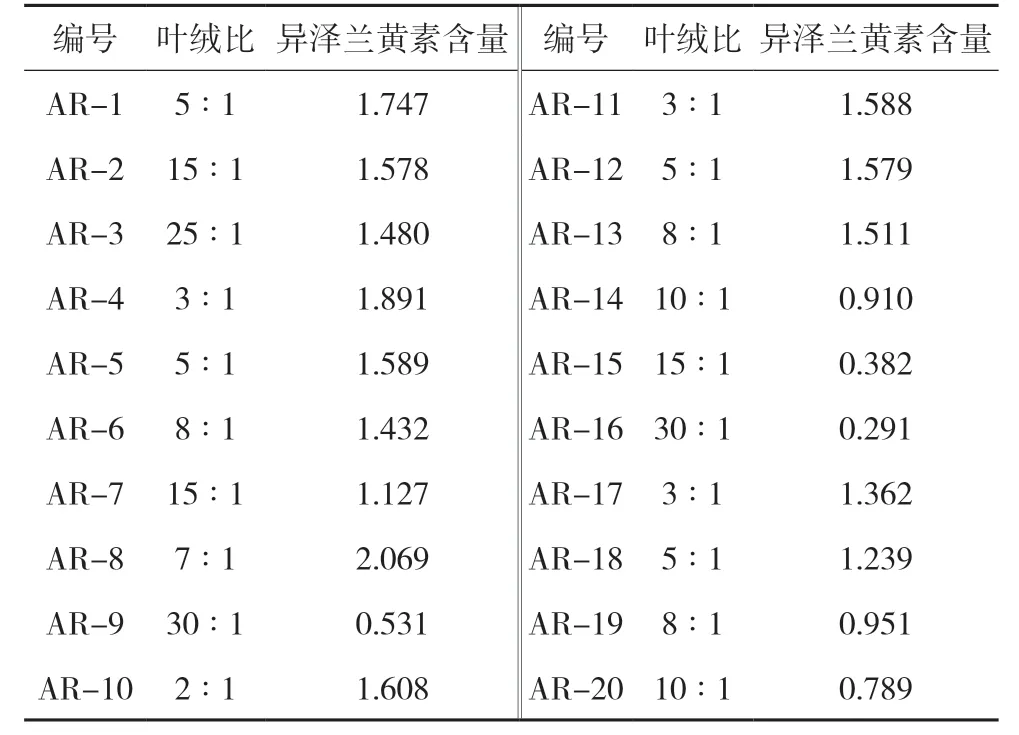
表3 艾绒中异泽兰黄素的含量结果(n=3,mg/g)
3 讨论
3.1 薄层色谱鉴别项
通过考察石油醚(60~90 ℃)-乙酸乙酯(3∶1)、三氯甲烷-甲醇(15∶1)以及石油醚(60~90 ℃)-甲苯-丙酮(10∶8∶0.5)三个不同展开剂系统,结果显示石油醚(60~90 ℃)-甲苯-丙酮(10∶8∶0.5)作为展开剂分离效果最好。
3.2 含量测定项
3.2.1 样品提取方法的优化 本研究分别采用30%
甲醇、50%甲醇、80%甲醇、甲醇、乙醇为提取溶剂对艾绒样品进行提取。结果显示,以80%甲醇为提取溶剂时,异泽兰黄素色谱峰的分离度较好,且含量最高,因此选择80%甲醇作为艾绒样品的提取溶剂。又分别考察了超声提取和回流提取两种提取方法对艾绒样品中异泽兰黄素的影响,发现回流提取的色谱峰峰面积明显大于超声提取,含量更高,故本研究选择回流提取的方式作为艾绒样品的提取方式。此外,考察不同提取时间(30、60、90 min),不同料液比(1∶50、1∶100、1∶200 g/mL)对异泽兰黄素含量的影响,最终择优选择提取时间60 min、料液比1∶50(g/mL)。
3.2.2 色谱条件的优化 本研究考察了4 种流动相体系(甲醇-水、乙腈-水、乙腈-0.1%磷酸溶液)进行了色谱条件的摸索。发现以乙腈-0.1%磷酸溶液(36∶64)作为流动相时,样品图谱中异泽兰黄素的色谱峰峰形和分离度均较好,故选择以乙腈-0.1%磷酸溶液(36∶64)作为流动相。同时,采用DAD检测器在200~400 nm 波长范围内扫描,异泽兰黄素在为344 nm 附近有最大吸收,且色谱峰与其余色谱峰分离良好,基线较平,故最终选择344 nm 作为检测波长。
4 小结
本实验:(1)建立了艾绒薄层鉴别方法,该法斑点清晰,分离度好;(2)测定了20 批不同叶绒比艾绒中含量,结果不同批次的含量差异较明显,同时呈现出叶绒比越大,含量越低,这可能与艾绒在加工制备时需要不断的过筛,筛除掉艾粉和艾渣,艾粉主要为艾叶的叶肉组织,其内含有大量的有机成分。因此,叶绒比越大的艾绒,所含的杂质和艾粉越少,异泽兰黄素含量就越低。本实验所建立的定性定量方法为进一步完善艾绒的质量评价方法提供参考依据。
