miR-205-5p对RBM47的调控作用及对食管鳞癌细胞侵袭迁移的影响*
2022-03-30张怀忠吴旭辉吴功志朱双媚
张怀忠, 吴旭辉, 吴功志, 朱双媚
丽水市人民医院 1胸心外科, 2肿瘤放疗科(浙江丽水 323000)
食管癌是世界上第八大癌症,其病死率位于世界恶性肿瘤的第6位,是消化道系统及胃肠道最常见、最具侵袭性的肿瘤之一[1-2]。食管鳞癌(esophageal squamous cell carcinoma,Escc)是我国食管癌的主要病理类型,患者发病率及病死率较高[3-4]。随着我国医疗技术的发展,手术及放疗等多学科治疗虽能在一定程度上改善患者生存,但患者预后及5年生存率仍不理想[5]。故寻找有效的分子标志物及探究Escc高侵袭迁移的分子机制,对改善Escc患者预后有潜在的临床意义。研究证实微小RNA(MicroRNA,miRNA)与肿瘤迁移、侵袭关系密切[6],miRNA家族的miR-205已被证实可增强DNA修复,抑制细胞凋亡并促进Escc细胞集落存活[7-8]。miR-205的亚型miR-205-5p也被发现参与皮肤鳞癌、胃癌、宫颈癌等多种肿瘤的侵袭、迁移生物学过程[9-10]。但miR-205-5p在Escc侵袭、迁移过程中的调控机制研究较少。另外,近来研究发现RNA结合蛋白47(RBM47)丢失是导致结直肠癌、乳腺癌及非小细胞肺癌转移的重要因子之一[11-12]。但RBM47是否也参与Escc侵袭、迁移过程还未见报道。本研究2019年3月至2021年1月用基因预测网站发现miR-205-5p与RBM47之间存在靶向关系,并通过培养Escc细胞,探究miR-205-5p与RBM47在肿瘤侵袭迁移过程的调控机制,以期为Escc的靶向治疗提供参考。
1 材料与方法
1.1 材料 人食管上皮细胞(HET-1A)及人食管鳞状细胞癌细胞系(TE14和KYSE70)(上海细胞研究所,MZ0641、MZ-2281、MZ1694);RPMI-1640培养基(上海经科化学科技有限公司,GNM-31800);10%胎牛血清(上海联硕生物科技有限公司,A3160801);链霉素-青霉素混合液(北京百奥莱博科技有限公司,SJ0704);CCK-8试剂盒(上海吉至生化科技有限公司,CA1210-5000T);RNA提取试剂盒(北京天漠科技开发有限公司,TR205-50);逆转录试剂盒(上海科敏生物科技有限公司,205111);Matrigel基质胶(上海钰博生物科技有限公司,YB356234);RBM47、侵袭迁移相关蛋白E-钙粘蛋白(E-cadherin)及锌指E-盒结合同源异形盒1(ZEB1)等抗体(美国abcam公司,ab154176、ab40772、ab203829);ECL显色试剂盒(上海古朵生物科技有限公司,GD-Y2042);BCA蛋白定量试剂盒(上海恒斐生物科技有限公司,AR0146);qRT-PCR仪(上海力康科技有限公司,T960);酶标仪(奥地利Tecan公司,Tecan Infinite F50)。
1.2 方法
1.2.1 细胞培养 取HET-1A及Escc细胞系(TE14和KYSE70)常规复苏后,用RPMI-1640培养基(含10%胎牛血清和100 U/mL青霉素-链霉素),在37℃、5% CO2恒温培养箱中培养,并用0.25%胰蛋白酶进行消化传代。
1.2.2 qRT-PCR检测不同细胞系中miR-205-5p、RBM47 mRNA相对表达水平 用RNA提取试剂盒分别提取Escc细胞系(TE14和KYSE70)和HET-1A细胞系中总RNA,用逆转录试剂盒得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒说明书进行PCR反应(反应体系:上下游引物各0.5 μL,H2O 8 μL,2×SYBR mix 10 μL,10×cDNA模板1 μL。反应条件:95℃预变性10 min、95℃变性20 s、60℃退火55 s、50个循环、72℃延伸15 min)。miR-205-5p以U6为内参,RBM47以GAPDH为内参,用2-ΔΔCt算法,计算miR-205-5p、RBM47 mRNA表达水平。各引物序列由大连宝生物公司合成,见表1。

表1 引物序列表
1.2.3 细胞转染及分组处理 取KYSE70细胞系,用胰蛋白酶消化后,按照5×104个/孔的密度将细胞接种于96孔板内,并设置为空白对照组、miR-205-5p抑制剂(miR-205-5p-inhibitor)组、miR-205-5p抑制剂阴性对照(miR-205-5p-NC)组、RBM47过表达腺病毒(Ad-RBM47)组、Ad-RBM47阴性对照(Ad-eGFP)组,每组设置6个复孔。空白对照组不作任何处理正常培养,其余各组待细胞融合度达50%~60%时,用转染试剂盒向KYSE70细胞转染miR-205-5p-inhibitor及miR-205-5p-NC试剂,得到miR-205-5p-inhibitor组及miR-205-5p-NC组;采用腺病毒向KYSE70细胞转染RBM47过表达序列及空载体,得到Ad-RBM47组及Ad-eGFP组。各转染组于转染后24 h,取细胞进行后续试验。
1.2.4 RT-qPCR检测各组细胞miR-205-5p、RBM47 mRNA的相对表达水平 取转染24 h后的各组细胞,用RNA提取试剂盒提取总RNA,按1.2.2项下的检测方法,检测各组细胞miR-205-5p、RBM47 mRNA表达水平。
1.2.5 CCK-8法检测细胞增殖活性 取转染后24 h的各组细胞,加入10 μL CCK-8溶液继续培养2 h后,在酶标仪上于450 nm波长下检测各组细胞的OD值,以空白对照组为对照,根据公式细胞存活率=(试验组OD值/空白组OD值)×100%计算细胞存活率,以存活率代表细胞增殖活性。
1.2.6 Transwell小室法检测细胞迁移侵袭能力 将转染后24 h的各组细胞,重悬为浓度为1×108个/mL的细胞悬液。取Transwell小室,向小室上室加入含10%胎牛血清的培养液100 μL,于小室下室加入含10 %胎牛血清的培养液室温孵育24 h后,取出小室,用4%多聚甲醛固定和结晶紫染色后,于光学显微镜下,随机取5个视野进行计数,以细胞数目多少代表细胞迁移能力。在Transwell小室上室铺比例为(Matrigel胶∶培养基=1∶8)的普通Matrigel胶工作液50 μL,室温孵育过夜过夜并待Matrigel胶凝固后,其余步骤同迁移试验,作为细胞侵袭能力检测。实验重复6次。
1.2.7 Western blot检测各组细胞RBM47、E-cadherin、ZEB1蛋白相对表达水平 取转染24 h后的各组细胞,用蛋白提取试剂盒及BCA定量试剂盒提取并测定细胞蛋白浓度后,取50 μg蛋白样品行电泳及半干法转膜反应,加入一抗(RBM47、E-cadherin、ZEB1抗体,稀释倍数均为1∶1 500,内参抗体GAPDH稀释倍数为1∶2 000),于4℃孵育过夜后,加入辣根过氧化物酶二抗(稀释倍数1∶5 000)于室温下孵育3 h。显影曝光后,用化学发光成像分析系统拍照并分析灰度值。每组试验重复3次。
1.2.8 双荧光素酶验证miR-205-5p与RBM47的靶向关系 合成RBM47的3′非翻译区(3′UTR)的miR-205-5p识别序列,克隆至pmiRGlo载体,得到pmiRGlo-RBM47-3′UTR-WT。另外对miR-205-5p识别区RBM47碱基进行突变连接至pmiRGlo载体,得到pmiRGlo-RBM47-3′UTR-MUT,分别将pmiRGlo-RBM47-3′UTR-WT、pmiRGlo-RBM47-3′UTR-MUT质粒与miR-205-5p NC、miR-205-5p mimics共转染,得到miR-205-5p mimics+RBM47-3′UTR-MUT组、miR-205-5p NC+RBM47-3′UTR-MUT组、miR-205-5p mimics+RBM47-3′UTR-WT组、miR-205-5p NC+RBM47-3′UTR-WT组,各组均于24 h后添加萤火虫和海参荧光素酶试剂(按照双荧光素酶报告基因检测试剂盒说明书)上机检测。每孔的数值以萤火虫荧光活性/海参荧光活性显示,试验重复3次。
1.2.9 miR-205-5p-inhibitor与si-RBM47共转染后对细胞侵袭迁移能力的影响 取KYSE70细胞按照1×105个/孔的密度接种于96 孔板内,并设置为:miR-205-5p-inhibitor+si-RBM47组、miR-205-5p-inhibitor+si-RNA-NC组、miR-205-5p-NC+si-RBM47组、miR-205-5p-NC+si-RNA-NC组、未转染组(空白对照组),miR-205-5p-inhibitor+si-RBM47组转染miR-205-5p抑制剂及RBM47干扰载体(si-RBM47);miR-205-5p-inhibitor+si-RNA-NC组转染miR-205-5p-inhibitor及RBM47空载体(si-RNA-NC),miR-205-5p-NC+si-RBM47组转染miR-205-5p-NC及si-RBM47;miR-205-5p-NC+si-RNA-NC组转染miR-205-5p-NC及si-RNA-NC,空白对照组不作任何处理,各组均于转染后24 h,取细胞按1.2.6方法检测细胞侵袭迁移能力。
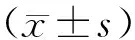
2 结果
2.1 不同细胞系中miR-205-5p、RBM47 mRNA表达的影响 与正常食管上皮细胞(HET-1A)相比,ESCC细胞系(TE14和KYSE70)中miR-205-5p表达升高(P<0.05),RBM47 mRNA表达降低(P<0.05),其中在KYSE70细胞系中,miR-205-5p表达最高,RBM47 mRNA表达最低。见表2。

表2 不同细胞系中miR-205-5p、RBM47 mRNA表达比较
2.2 抑制miR-205-5p或激活RBM47表达对细胞miR-205-5p及RBM47 mRNA表达的影响 与空白对照组比较,miR-205-5p-inhibitor组细胞miR-205-5p表达降低(P<0.05),RBM47表达升高(P<0.05);Ad-RBM47组细胞RBM47 mRNA表达升高(P<0.05),miR-205-5p表达差异无统计学意义(P>0.05)。miR-205-5p-NC组及Ad-eGFP组上述指标与空白组对照组相比,差异无统计学意义(P>0.05)。见表3。

表3 各组细胞miR-205-5p及RBM47 mRNA表达比较
2.3 抑制miR-205-5p或激活RBM47表达后对细胞增殖活性的影响 与空白对照组比较,miR-205-5p-inhibitor组及Ad-RBM47组细胞增殖活性降低(P<0.05)。miR-205-5p-NC组及Ad-eGFP组上述指标与空白对照组相比,差异无统计学意义(P>0.05)。见表4。
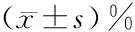
表4 抑制miR-205-5p或激活RBM47表达后各组细胞增殖活性比较
2.4 抑制miR-205-5p或激活RBM47表达对细胞侵袭迁移能力的影响 与空白对照组比较,miR-205-5p-inhibitor组及Ad-RBM47组细胞侵袭迁移能力降低(P<0.05)。miR-205-5p-NC组及Ad-eGFP组上述指标与空白对照组相比,差异无统计学意义(P>0.05)。见图1、表5。
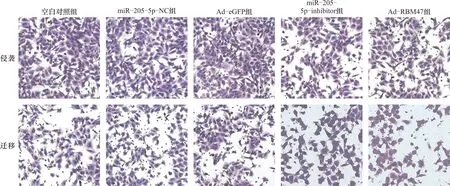
图1 各组细胞侵袭迁移Transwell图(×200)
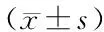
表5 各组细胞侵袭迁移能力比较 个
2.5 抑制miR-205-5p或激活RBM47表达对细胞RBM47、E-cadherin、ZEB1蛋白表达的影响 与空白对照组比较,miR-205-5p-inhibitor组及Ad-RBM47组细胞ZEB1蛋白表达降低(P<0.05),E-cadherin、RBM47表达升高(P<0.05)。miR-205-5p-NC组及Ad-eGFP组上述指标与空白对照组相比,差异无统计学意义(P>0.05)。见图2、表6。
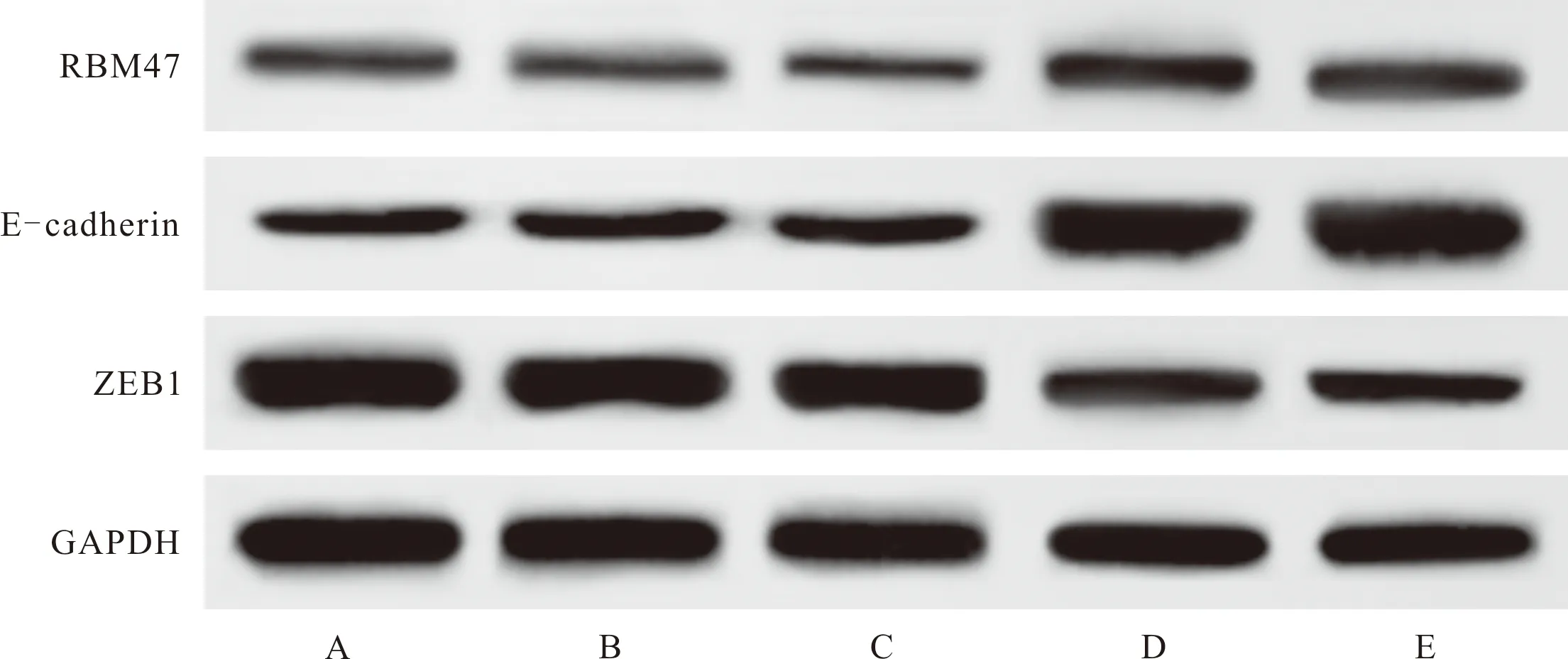
注:A:空白对照组;B:miR-205-5p-NC组;C:Ad-eGFP组;D:miR-205-5p-inhibitor组;E:Ad-RBM47组

表6 各组细胞中RBM47、E-cadherin、ZEB1蛋白表达水平比较
2.6 双荧光素酶试验验证miR-205-5p与RBM47靶向关系 miRtarbase预测显示,miR-205-5p与RBM47有结合位点。与miR-205-5p-NC+RBM47-3′UTR-WT组比较,miR-205-5p-mimics+RBM47-3′UTR-WT组荧光素酶活性降低(P<0.05),miR-205-5p-NC+RBM47-3′UTR-MUT组、miR-205-5p-mimics+RBM47-3′UTR-MUT组荧光素酶活性比较差异无统计学意义(P>0.05)。见图3~4。

图3miRtarbase预测miR-205-5p与RBM47靶向关系
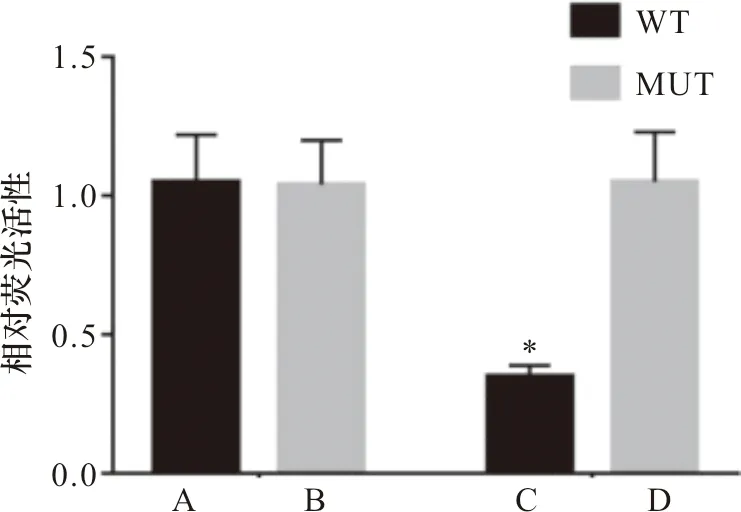
注:A:miR-205-5p-NC+RBM47-3′UTR-WT;B:miR-205-5p NC+RBM47-3′UTR-MUT组;C:miR-205-5p mimics+RBM47-3′UTR-WT组;D:miR-205-5p mimics+RBM47-3′UTR-MUT组;*与miR-205-5p-NC+RBM47-3′UTR-WT比较P<0.05
2.7 miR-205-5p-inhibitor与si-RBM47共转染后对细胞侵袭迁移能力影响 与空白对照组比较miR-125b-NC+si-RBM47组细胞侵袭迁移能力升高(P<0.05);miR-205-5p-inhibitor+si-RNA-NC组细胞侵袭迁移能力降低(P<0.05)。与miR-205-5p-inhibitor+si-RNA-NC组相比,miR-205-5p-inhibitor+si-RBM47组细胞侵袭迁移能力升高(P<0.05)。miR-125b-NC+si-RNA-NC组与空白对照组相比,上述指标差异无统计学意义(P>0.05)。见图5、表7。
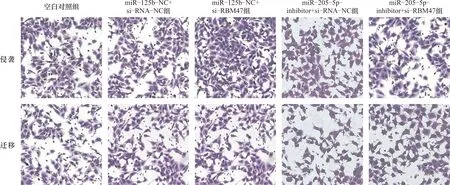
图5 各组细胞侵袭迁移Transwell图(×200)
表7 各组细胞侵袭迁移能力比较 个
3 讨论
据世界流行病学分析,预计到2040年世界食管癌患病率及病死率将是2018年患病人数的1.6倍左右[12]。食管癌中的亚型-Escc因其较高的发病率及转移率,而受到临床研究的重视[13]。MicroRNA(miR)与肿瘤增殖、凋亡及侵袭、迁移等生物学过程关系密切,且是最有前途的癌症诊断生物标志物之一[14]。余长云等[15]及Liu等[16]发现沉默miR-205-5p可抑制头颈鳞状细胞癌及结直肠癌的增殖、侵袭、迁移过程,提示miR-205-5p可作为促癌基因发挥生物学过程。杨屹立等[17]及Yamada等[18]发现miR-205-5p过表达可抑制胃癌及前列腺癌的增长及迁移过程,提示miR-205-5p可作为抑癌基因参与肿瘤生物学过程。而miR-205-5p在Escc发生发展过程中的调控作用研究较少。Ibuki等[6]发现miR-205-5p在Escc患者血清中表达水平高于食管腺癌患者,提示miR-205-5p过表达可能是导致Escc侵袭与转移的危险因素之一。本研究发现,miR-205-5p在Escc细胞系(TE14和KYSE70)中表达均异常高于人正常食管上皮细胞系(HET-1A),且抑制KYSE70细胞中miR-205-5p表达后,KYSE70细胞增殖、侵袭、迁移能力显著低于空白对照组,提示miR-205-5p在Escc细胞中发挥促癌作用,沉默其表达可抑制Escc恶性生物学过程。研究证实E-cadherin为抑癌因子,ZEB1为致癌因子,且两者与肿瘤侵袭迁移关系密切[19]。范晓娜等[20]发现双皮质素样激酶1基因敲除可通过抑制ZEB1表达,上调E-cadherin表达,影响Escc细胞上皮间质转化来抑制Escc细胞侵袭迁移进程,提示E-cadherin、ZEB1与Escc侵袭迁移过程有关。本研究也在miR-205-5p抑制剂组检测到miR-205-5p表达降低后,与Escc侵袭迁移相关蛋白E-cadherin上调,ZEB1蛋白表达降低,进一步证实,抑制miR-205-5p表达,可抑制Escc侵袭迁移进程。但miR-205-5p促进Escc恶性生物学进程的分子机制还需继续探究。
RNA结合蛋白(RBP)在肿瘤上皮间质转化及侵袭迁移过程也发挥重要作用[21]。研究证实RNA结合蛋白RBM47可调控mRNA剪接、碱基编辑及多聚腺苷化过程,并在肿瘤发展过程中发挥显著作用[11]。Blanc等[22]发现RBM47基因敲除可抑制小鼠肠道RNA基因编辑,并推测RBM47降低可能是结直肠癌发生发展的危险因子。Vanharanta等[23]发现RBM47能改变靶mRNA子集的剪接和翻译,可通过使其靶RNA失活抑制乳腺癌的重新启动和生长,并推测RBM47的丢失是导致乳腺癌侵袭迁移的重要原因之一。本研究也发现,RBM47在Escc细胞系(TE14和KYSE70)中表达均异常低于人正常食管上皮细胞系(HET-1A),且上调RBM47在KYSE70中表达后,随着RBM47 mRNA及蛋白表达的升高,与Escc侵袭迁移相关蛋白E-cadherin上调,ZEB1蛋白表达降低,Escc细胞表现出较低的侵袭迁移能力,提示RBM47可抑制Escc细胞侵袭迁移进程。本研究还发现,抑制miR-205-5p表达后,RBM47 mRNA及蛋白也呈升高趋势,进一步分析发现miR-205-5p与RBM47存在靶向负调控作用。为明确二者关系,本研究采用miR-205-5p-inhibitor与si-RBM47共转染,结果显示,miR-205-5p-inhibitor+si-RBM47组细胞侵袭迁移能力显著高于miR-205-5p-inhibitor+si-RNA-NC组,提示RBM47低表达可逆转miR-205-5p-inhibitor对Escc侵袭迁移能力的抑制作用。
综上所述,Escc细胞中miR-205-5p表达升高,RBM47表达降低,下调miR-205-5p表达可抑制Escc细胞侵袭迁移能力,其抑制作用可能与上调RBM47表达有关,这为阐明Escc发生发展的靶向调控机制提供一定理论依据,但本研究还存在一定的不足,miR-205-5p的调控机制复杂,miR-205-5p与Escc的其他靶向调控机制有待进一步探究。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:张怀忠提出研究思路、设计研究方案、实施研究过程、论文撰写;吴旭辉、吴功志资料收集整理,进行统计学分析,指导论文修改。
