毒害艾美耳球虫配子体抗原EnGAM22单克隆抗体的制备与鉴定
2022-03-30蔡为民李文静王乐乐苏丁泽阳刘丹丹许金俊陶建平
蔡为民,李文静,王乐乐,苏丁泽阳,朱 玉,刘丹丹,许金俊,陶建平
(扬州大学兽医学院,江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
鸡球虫病是由艾美耳球虫(Eimeria)寄生于鸡肠道引起的一种寄生性原虫病,给全球养鸡业造成巨大的经济损失[1-2]。鸡球虫生活史包括裂殖生殖、配子生殖和孢子生殖三个阶段,孢子生殖形成的孢子化卵囊被鸡食入后,在肠道内释放子孢子,子孢子侵入肠黏膜上皮细胞进行裂殖生殖,接着进行配子生殖,最后形成卵囊。卵囊随粪便排出体外,在外界环境中进行孢子生殖,形成具有感染性的孢子化卵囊[3]。因此,卵囊是球虫在宿主间传播的重要形式。球虫卵囊有一坚韧的卵囊壁,主要由来自大配子成壁体上的配子体蛋白[3-4]。毒害艾美耳球虫配子体抗原EnGAM22是卵囊壁的前体蛋白,在本实验室前期研究中对该抗原基因进行了克隆与原核表达,重组蛋白免疫鸡后对毒害艾美耳球虫(Eimerianecatrix)感染有一定的免疫保护力[5]。但该蛋白如何参与卵囊壁的形成尚不清楚。单克隆抗体具有高特异性和灵敏性,与免疫荧光、免疫电镜等技术结合可将目的抗原在虫体中定位,是研究寄生虫虫体细微结构和发育分子机制的重要检测工具,对寄生虫病的免疫治疗与机理研究具有重大意义[6]。迄今,关于鸡球虫配子体蛋白单克隆抗体的研究较少,Krücken等[7]和Wiedmer等[8]研究发现针对EtGAM56单克隆抗体E2E5可以干扰柔嫩艾美耳球虫的发育,但有关E.necatrix单克隆抗体尚未见报道,因此本研究以原核表达的重组配子体抗原rEnGAM22免疫BALB/c小鼠制备单克隆抗体,并应用单抗进行天然蛋白的虫体定位。研究结果可为球虫卵囊壁形成机制研究提供工具,也为鸡球虫多肽和新型疫苗分子的设计及诊断试剂的开发奠定基础。
1 材料与方法
1.1 菌株、细胞、虫株
重组菌株pET-28a(+)-Engam22/BL21由本实验室构建保存;小鼠骨髓瘤细胞SP2/0由扬州大学兽医学院张小荣老师惠赠;毒害艾美耳球虫(Eimerianecatrix)、柔嫩艾美耳球虫(E.tenella)、堆型艾美耳球虫(E.acervulina)、巨型艾美耳球虫(E.maxima)均由扬州大学兽医学院寄生虫病学教研室建株并定期传代保种。
1.2 实验动物
BALB/c与ICR小鼠,购自扬州大学比较医学中心。黄羽鸡,购自江苏省海门市京海肉鸡集团公司,雏鸡孵出后即运回实验室,饲养在无球虫卵囊污染的笼具和环境中,饲喂不添加抗球虫药物的全价饲料,鸡自由采食。
1.3 主要试剂
High Affinity Ni-Charged Resin亲和纯化层析柱、Protein G纯化介质购自金斯瑞生物科技公司;HRP标记羊抗鼠IgG购自BBI公司;SDS-PAGE蛋白上样缓冲液(6×)、TMB显色液均购自碧云天生物技术公司;QuickAntibody-Mouse 3 W、腹水专用佐剂和小鼠单抗Ig类亚型鉴定用酶标二抗均购自北京博奥龙免疫技术有限公司;PEG1500购自Sigma公司;硝酸纤维素膜购自默克公司;ECL化学发光试剂购自Tanon公司;FITC标记羊抗鼠IgG购自KPL公司;小牛血清白蛋白(BSA)购自上海生工生物有限公司;Brofdrod蛋白定量试剂盒购自TaKaRa公司。鼠抗rEnGAM22多克隆抗体由本实验室制备保存。
1.4 重组蛋白的诱导表达与纯化及鉴定
参照刘丹丹[5]的方法大量制备rEnGAM22蛋白,并经Western blot鉴定其与抗毒害艾美耳球虫康复血清反应特异性。重组蛋白经不同浓度尿素透析复性纯化后,存于-80 ℃冰箱备用。
1.5 间接ELISA检测方法的建立
采用方阵滴定法确定重组抗原rEnGAM22的最佳包被浓度,并测定小鼠血清抗体效价。将重组抗原rEnGAM22用碳酸盐缓冲液(pH 9.6)从4 μg·mL-1倍比稀释到0.125 μg·mL-1包被酶标板,4 ℃过夜后用1% BSA封闭液封闭;用PBS将待检血清以及阴性血清从1∶200倍比稀释到1∶25 600,二抗为HRP标记的羊抗鼠IgG,用PBS按照1∶20 000倍稀释(说明书推荐倍数);TMB显色液37 ℃避光作用15 min,2 mol·L-1H2SO4终止反应,用酶标仪检测OD450 nm值。当待检血清OD450 nm值/阴性血清OD450 nm值≥2.1(即P/N ≥ 2.1),判定为阳性。选择小鼠待检血清孔OD450 nm值接近于1.0且P/N值最大时,待检孔的抗原包被浓度为最佳包被浓度[9]。
1.6 动物免疫与单抗制备
取重组抗原rEnGAM22与Quick Antibody-Mouse 3W免疫佐剂1∶1混合后,免疫3只BALB/c小鼠,20 μg·只-1,100 μL·只-1,腿部肌内注射;首免后第二周进行第二次免疫,第三周进行眼眶后静脉丛采血,建立ELISA方法并检测小鼠血清抗体效价。效价合格后加强免疫,随后第3天取小鼠脾制备脾细胞,参照马琰等[10]的方法将骨髓瘤细胞与脾细胞按照1∶10混合后加入PEG1500诱导细胞融合;用建立的ELISA方法进行3次阳性杂交瘤细胞的筛选,用有限稀释法对阳性杂交瘤细胞进行4次亚克隆,最终获得能稳定分泌特异性抗体的杂交瘤细胞。将稀释好的1×106个杂交瘤细胞腹腔注射10周龄提前致敏的BALB/c小鼠,接种后第7天小鼠腹围变大,行动迟缓,用无菌注射器针头抽取小鼠腹水,用Protein G亲和层析柱纯化小鼠腹水单抗。
1.7 单克隆抗体效价测定以及亚型鉴定
用建立的ELISA方法进行杂交瘤细胞上清以及小鼠腹水单抗效价检测。设置阴、阳性小鼠血清对照孔,杂交瘤细胞上清用PBS从1∶100开始倍比稀释,腹水单抗首孔用PBS从1∶1 000开始倍比稀释。单克隆抗体的亚型鉴定选用北京博奥龙免疫技术有限公司酶标二抗即用套装,操作按说明书进行。
1.8 单克隆抗体的特异性鉴定
1.8.1 鸡球虫天然配子体蛋白提取物的制备 将毒害艾美耳球虫(2×104)、柔嫩艾美耳球虫(2×104)、堆型艾美耳球虫(1×105)、巨型艾美耳球虫(5×104)孢子化卵囊分别经嗉囊接种30日龄无球虫感染的黄羽鸡,分别在感染后卵囊出现的前5 h,每隔1 h剖杀感染球虫的鸡,打开肠腔,刮取肠黏膜涂片,用生物显微镜(10×40倍)观察小肠或盲肠中配子体的数量,直至出现大量配子体时,剖杀全部试验鸡,取出肠道,剖开肠腔后弃内容物,用预冷PBS冲洗肠道黏膜,用手术刀片刮取肠黏膜。将肠黏膜在冰浴中超声裂解(功率30%,超声2 s,间隙3 s,30 min),用Broadford蛋白定量试剂盒测定蛋白浓度,分装保存-80 ℃冰箱备用。
1.8.2 特异性鉴定 将重组抗原rEnGAM22,毒害艾美耳球虫、柔嫩艾美耳球虫、巨型艾美耳球虫、堆型艾美耳球虫天然配子体蛋白提取物加入SDS-PAGE蛋白上样缓冲液煮沸10 min后离心,取上清进行SDS-PAGE电泳;转印到硝酸纤维素膜上,转印结束后置于含30 g·L-1BSA封闭液中4 ℃过夜;杂交瘤细胞上清原液为一抗,室温孵育50 min;二抗为HRP标记的羊抗鼠IgG,用30 g·L-1BSA封闭液按1∶25 000倍稀释(说明书推荐倍数),室温孵育40 min;ECL显色,Tanon5200全自动化学发光成像分析系统观察结果并扫描拍照。
1.9 EnGAM22蛋白在虫体中的定位
雏鸡感染毒害艾美耳球虫144和156 h后分别扑杀,取盲肠黏膜组织涂布于载玻片上,自然干燥后用预冷的甲醇作用10 min;随后用0.1% Triton X室温作用10 min,100 g·L-1山羊血清封闭1 h;一抗为杂交瘤细胞上清,37 ℃孵育1 h;二抗为FITC标记的羊抗鼠IgG,用100 g·L-1山羊血清按1∶100倍稀释(说明书推荐倍数),37 ℃孵育1 h;滴加抗荧光淬灭液,封片,荧光显微镜观察结果。
2 结 果
2.1 获得并鉴定重组抗原rEnGAM22
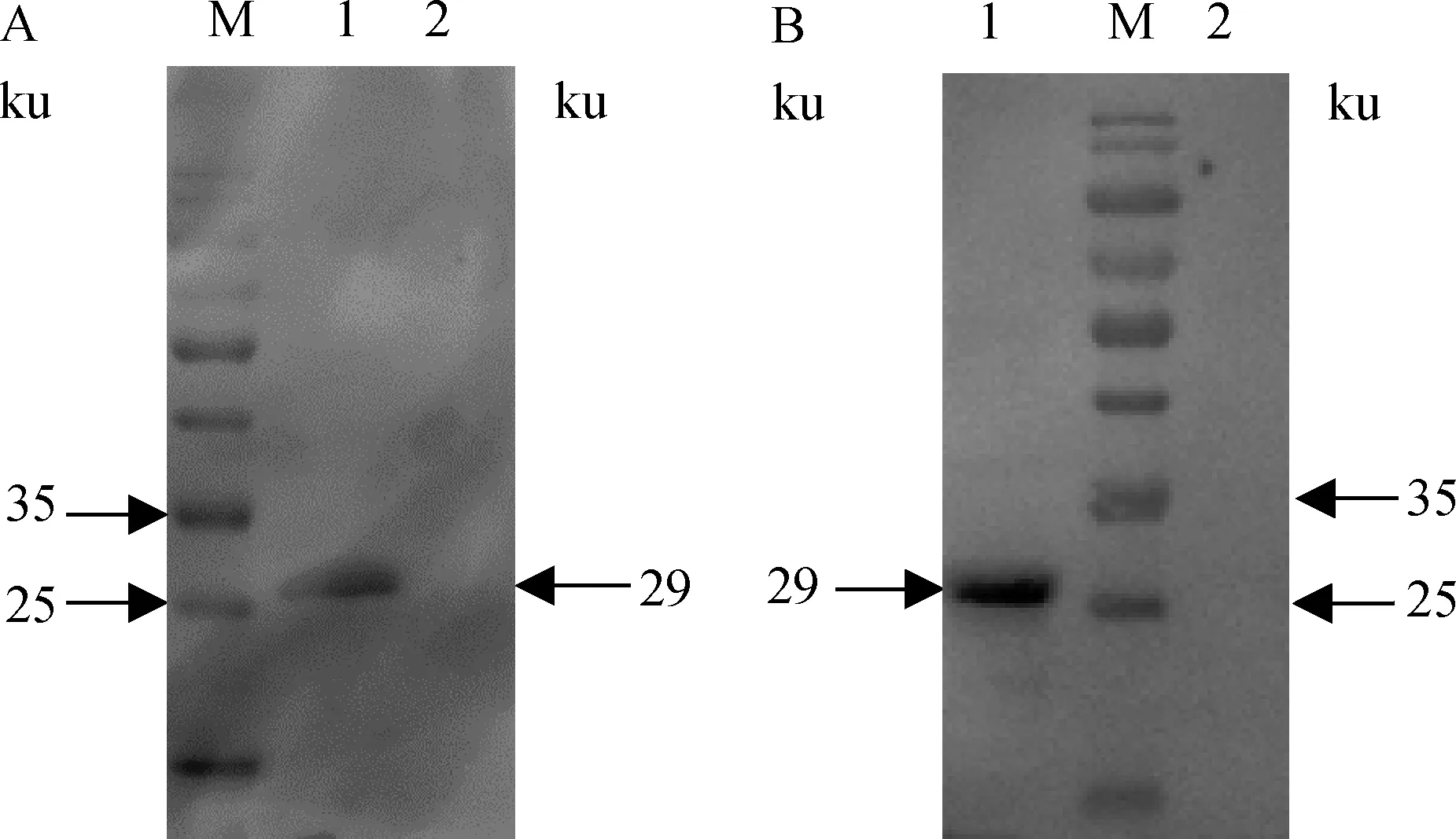
纯化复性后的重组抗原rEnGAM22在约29 ku处有一单一条带(图1A)。经Western blot分析重组抗原rEnGAM22在29 ku处能与抗毒害艾美耳球虫康复血清发生特异性反应(图1B),而组氨酸标签蛋白未发生反应。经过透析复性浓缩后,重组抗原浓度为1.8 g·L-1。

M.蛋白质相对分子质量标准;1.rEnGAM22蛋白;2.组氨酸标签蛋白;3.rEnGAM22蛋白
2.2 间接ELISA方法测定免疫小鼠血清抗体效价
间接ELISA方阵滴定结果表明,当重组抗原质量浓度为0.125 μg·mL-1,血清稀释度为1∶25 600时,阳性血清OD450 nm值最接近1.0,且P/N 值最大,确定重组抗原rEnGAM22的最佳包被浓度为0.125 μg·mL-1,小鼠血清抗体效价均达到1∶10 000以上,加强免疫第3 天取小鼠脾制备脾细胞,进行细胞融合。
2.3 获得稳定的阳性杂交瘤细胞株
待融合细胞长至底面积的1/3时,用建立好的ELISA方法进行阳性杂交瘤细胞的筛选并及时对阳性杂交瘤细胞进行亚克隆,4次亚克隆之后获得两株能稳定分泌特异性抗体的杂交瘤细胞株,分别命名为2F3和3D3。将杂交瘤细胞连续传代并收集细胞上清,用间接ELISA方法检测细胞上清抗体效价,结果表明复苏后的杂交瘤细胞仍能稳定分泌抗体,说明杂交瘤细胞稳定性较好。
2.4 腹水的纯化
采用Protein G亲和层析纯化法纯化小鼠腹水,纯化后的腹水单抗均可见1条大小为50 ku的重链以及1条大小为25 ku的轻链,未见其他杂带,表明腹水单抗纯化效果较好(图2)。

M.蛋白质相对分子质量标准;1.纯化后2F3腹水单抗;2.纯化后3D3腹水单抗
2.5 单克隆抗体效价测定以及亚类鉴定
将纯化的重组抗原rEnGAM22包被酶标板,测定杂交瘤细胞培养上清、腹水效价以及鉴定抗体亚类。腹水单抗效价明显高于细胞上清效价,单抗2F3和3D3亚型分别为IgG2a和IgG2b(表1)。

表1 单抗的效价和亚类鉴定
2.6 球虫天然配子体蛋白提取物的浓度测定及定量
用Broadford蛋白定量试剂盒测定蛋白浓度,毒害艾美耳球虫天然配子体蛋白提取物浓度为1.69 g·L-1,柔嫩艾美耳球虫为1.68 g·L-1,堆型艾美耳球虫为2.02 g·L-1,巨型艾美耳球虫为1.47 g·L-1。
2.7 单克隆抗体的特异性鉴定
2.7.1 对重组抗原进行特异性识别 Western blot结果显示,单抗2F3和3D3均能特异性识别重组抗原rEnGAM22,大小在29 ku左右,而不与组氨酸标签蛋白发生特异性反应(图3)。
M.蛋白质相对分子质量标准;1.重组抗原rEnGAM22;2.组氨酸标签蛋白
2.7.2 对毒害艾美耳球虫天然配子体蛋白特异性识别 Western blot结果显示,单抗2F3和3D3均能特异性识别毒害艾美耳球虫配子体约37 ku大小的天然目的蛋白(图4A、B),而鼠抗rEnGAM22多抗识别的天然目的蛋白条带大小在35~37 ku之间(图4C),表明单抗2F3和3D3能特异性识别虫体中天然的rEnGAM22抗原。

M.蛋白质相对分子质量标准;1.配子体蛋白提取物
2.7.3 对异种鸡球虫天然配子体蛋白特异性识别 Western blot结果显示,单抗2F3和3D3均不能识别柔嫩、堆型、巨型艾美耳球虫天然配子体蛋白(图5A、B),而用鼠抗rEnGAM22多抗检测时,在柔嫩、堆型、巨型艾美耳球虫配子体蛋白提取物中均出现小于17 ku的非特异性条带(图5C),表明单抗2F3和3D3的特异性较鼠抗rEnGAM22多抗要好。
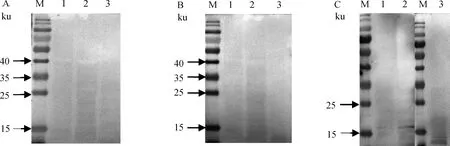
M.蛋白质相对分子质量标准;1.柔嫩艾美耳球虫;2.堆型艾美耳球虫;3.巨型艾美耳球虫
2.8 EnGAM22蛋白在毒害艾美耳球虫虫体中定位
以两株单抗为一抗,对配子体蛋白EnGAM22进行虫体内定位(图6)。结果显示,配子体蛋白EnGAM22定位在大配子体的成壁体与卵囊的卵囊壁(图6h~k),未出现在第三代裂殖子(图6g),表明EnGAM22蛋白参与卵囊壁的形成。

a~f.光镜下的第三代裂殖子(MZ)、卵囊(O)、配子体(GAM);g~l.免疫荧光定位结果;m~r.虫体自发荧光。g、h、i.McAb 2F3;j.McAb 3D3;k.鼠抗rEnGAM22多抗;l.小鼠阴性血清
3 讨 论
高纯度的免疫原是制备单克隆抗体的关键[11],天然蛋白结构复杂[12],难以达到较高纯度,而原核表达的重组抗原易获得且表达量和纯度较高,因此本研究选择用重组抗原rEnGAM22作为免疫原制备单克隆抗体。pET-28a(+)原核表达载体中组氨酸标签蛋白虽然为小分子量多肽,但可刺激机体产生抗组氨酸标签蛋白的抗体[13]。为此,在本研究中筛选第一次阳性杂交瘤细胞时采用平行对照,即将重组抗原rEnGAM22以及组氨酸标签蛋白同时作为检测原,用建立的间接ELISA方法筛选杂交瘤细胞,而且在单克隆抗体的特异性鉴定中将组氨酸标签蛋白作为对照进行单克隆抗体的特异性验证,以确保准确筛选出分泌特异性抗体的阳性杂交瘤细胞。结果成功制备了两株抗配子体抗原EnGAM22单克隆抗体2F3和3D3,亚型分别为IgG2a、IgG2b,特异性强,纯化后腹水效价分别为1∶256 000、1∶64 000。
用单抗2F3和3D3以及鼠抗rEnGAM22多抗对鸡球虫配子体蛋白提取物进行Western blot检测时,两株单抗在毒害艾美耳球虫配子体蛋白提取物中仅检测到一大小为37 ku的特异性条带,在柔嫩、堆型与巨型艾美耳球虫配子体蛋白提取物中未检出任何条带,而鼠抗rEnGAM22多抗在毒害艾美耳球虫配子体蛋白提取物中检测到大小为35~37 ku的3条带,在柔嫩、堆型与巨型艾美耳球虫配子体蛋白提取物中检到小于17 ku的非特异条带,这一结果表明单抗2F3和3D3的特异性较鼠抗rEnGAM22多抗要强。此外,EnGAM22蛋白按其基因序列推导的理论分子量为21.38 ku[14],但用单抗2F3和3D3检测毒害艾美耳球虫配子体蛋白提取物,检测到的EnGAM22天然蛋白分子量为37 ku,这一现象同样见于巨型艾美耳球虫配子体蛋白EmGAM82和EmGAM56、以及柔嫩艾美耳球虫配子体蛋白EtGAM22,究其原因可能是球虫配子体蛋白中存在不寻常氨基酸组成所致[15]。
球虫卵囊壁为一双层结构,主要有蛋白质和脂类组成,在蛋白质分子间有二酪氨酸键交联,故卵囊壁可自发蓝色荧光[16]。球虫配子体蛋白是卵囊壁的前体蛋白,在配子生殖阶段特异性表达[3]。Wiedmer等[17]用抗大鼠E.nieschulzi大配子体的单克隆抗体鉴定出一种富含酪氨酸的糖蛋白EnGAM82,并定位于Ⅱ型成壁体上。本研究用单抗2F3和3D3对配子体蛋白EnGAM22进行虫体内定位时,在第三代裂殖子中未检测出蛋白,而在发育中的配子体和卵囊中均检测出蛋白,且蛋白均定位在配子体的成壁体和卵囊壁上,与用鼠抗rEnGAM22多抗定位结果一致,也与刘丹丹等[14]的研究结果相一致,显示EnGAM22蛋白参与卵囊壁的形成,这也表明单抗2F3和3D3可用作研究卵囊壁形成机制的分子工具。
单克隆抗体与多克隆抗体相比,具有无限量生产、高度的特异性和均一性等优点,已被广泛应用于球虫新基因和新抗原筛选、发育过程与致病机理探索、疾病诊断和预防治疗等方面的研究[18]。Wallach等[19]用抗配子体蛋白EmGAM56的单抗被动免疫雏鸡,可对巨型艾美耳球虫感染产生一定免疫保护力,与非免疫对照组相比,免疫鸡的卵囊产量减少40%~50%。Karim等[20]用柔嫩艾美耳球虫卵囊壁蛋白制备的单抗(C11B9F3)免疫的雏鸡,与非免疫对照组相比,免疫鸡感染同种球虫—柔嫩艾美耳球虫的卵囊产量降低42%~54%,感染异种球虫—巨型艾美耳球虫的卵囊产量降低35%。本研究研制的单抗2F3和3D3是否具有被动免疫保护作用有待进一步研究。
4 结 论
成功制备了两株抗毒害艾美耳球虫配子体抗原EnGAM22单克隆抗体2F3和3D3,其亚型分别为IgG2a和IgG2b,特异性强;用单抗免疫荧光定位结果显示,EnGAM22蛋白参与卵囊壁的形成,表明单抗2F3和3D3可用作研究卵囊壁形成机制的分子工具。
