非洲猪瘟病毒p54蛋白单克隆抗体的制备及阻断ELISA方法的建立
2022-03-30徐玲玉曹琛福李中圣陈俊宏柳腾飞王新凯贾伟新
徐玲玉,曹琛福,李中圣,陈俊宏,柳腾飞,王新凯,贾伟新,3*
(1.华南农业大学兽医学院,国家非洲猪瘟区域实验室(广州)/人兽共患病防控制剂国家地方联合工程实验室/农业农村部人畜共患病重点实验室/农业农村部兽用疫苗创制重点实验室/广东省动物源性人兽共患病防控重点实验室,广州 510642;2.深圳海关动植物检验检疫技术中心,深圳 518045;3.岭南现代农业科学与技术广东省实验室,广州 510642; 4.广东海大畜牧兽医研究院有限公司,广州 511400)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒科非洲猪瘟病毒属唯一成员非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种烈性、接触性传染病。ASFV不仅能感染家猪、野猪,还能使软蜱带毒成为传播媒介[1-3]。猪感染ASFV后的临床特征是内脏器官出血、高热不退,死亡率高达100%[4]。世界动物卫生组织(OIE)将ASF列为法定报告动物疫病[5],中国也将其列为一类动物疫病。1921年全球首次报道了发生于1910年肯尼亚的ASF疫情,中国在2018年8月3日首次报道ASF感染后半年内便蔓延到河南、江苏等31个省份,疫情几乎波及整个中国,造成直接经济损失达数百亿元,对我国生猪产业造成极大损失[6-7]。ASFV是目前已知的唯一一种DNA虫媒病毒,该病毒较大且带有囊膜、外壳呈二十面体对称(260~300 nm),基因组全长为170~190 kb[8],编码50多种结构蛋白和100多种非结构蛋白[9-10]。
目前,ASF的流行出现了新的特点,ASFV自然弱毒株与强毒株同时存在,感染猪出现超长潜伏期,精准剔除难度增加,因此监测ASFV抗体成为早期发现ASF的重要手段[11]。而抗体监测的成效取决于监测手段的便捷性和准确性。由于ELISA检测成本低廉且操作简便,OIE将其作为检测ASF的首选血清学方法,国内外常将p30、p72作为检测抗原的蛋白[12]。目前,国外进口的试剂盒价格昂贵,操作复杂,在非规模化养猪场难以推广[13]。因此,研制适用于我国临床使用的ASFV检测试剂盒十分必要。目前已经建立针对ASFV核酸、蛋白和抗体的检测方法,大部分检测方法以ASFV蛋白p72等作为检测对象[14]。p54存在于病毒衣壳的内部,具有和8 ku的细胞动力蛋白轻链(DLC8)直接结合从而使病毒进入宿主细胞复制位点的功能[15]。有研究表明,猪免疫重组p54蛋白后,机体会产生一定量的中和抗体,ASFV与细胞吸附之前可以被针对p54的抗体中和[16-17]。因此,p54蛋白具有较好的抗原性,是理想的检测抗原,但基于p54建立的阻断ELISA检测方法报道较少。
基于此,本研究以ASFV p54蛋白为包被抗原,利用制备的1株mAb建立了检测ASFV抗体的阻断ELISA方法,并进行了验证,该方法具有较好的特异性和敏感性,为我国ASF的防控提供了技术支持。
1 材料与方法
1.1 血清、细胞和试剂盒
非洲猪瘟标准阳性血清购自西班牙ASF参考实验室;商品化试剂盒购自西班牙INGENASA公司;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV)阳性血清均购自中国兽医药品监察所;SP2/0细胞由本实验室保存。
1.2 主要试剂
大肠杆菌由深圳市康百得生物科技有限公司供应;LB培养基购自北京奥博星生物技术有限公司;氨苄青霉素抗生素购自Sigma公司;纯化Ni柱购自GE Healthcare;HRP快速标记试剂盒购自湖州英创生物科技有限公司;HAT、HT、弗氏完全佐剂、弗氏不完全佐剂聚乙二醇(PEG)均购自Sigma公司;可拆卸ELISA酶标板购自Costar公司;TMB购自上海西宝生物科技有限公司。
1.3 包被抗原的制备
1.3.1 重组菌株的构建与鉴定 基于流行病学调查分析选择GenBank中已登录的ASFV p54蛋白基因序列作为参考(GenBank序列号:FJ174405.1),委托苏州金唯智生物科技有限公司合成携带p54基因的质粒,并将质粒中p54基因片段转入pUC57载体,构建包含ASFVp54序列的重组质粒pUC57-ASFVp54。胶回收目的片段和载体片段后,分别取目的基因6 μL、载体片段2 μL、T4 DNA Ligase 1 μL、10×T4 Ligation Buffer 1 μL混匀,在16 ℃连接4 h。将连接产物转入大肠杆菌BL21(DE3)中,并涂布于含100 μg·mL-1氨苄青霉素的LB琼脂平板上,在37 ℃培养12 h后,挑取单个菌落于含50 μg·mL-1氨苄青霉素的LB液体培养基中,37 ℃培养12 h后,对菌液进行PCR鉴定,利用质粒上的T7引物(F:TAATACGACTCAC-TATAGGG, R:GCTAGTTATTGCTCAGCGG)进行PCR扩增,随后进行凝胶电泳检测。菌液鉴定体系组分如下:Accurate Taq Mix(2×)10 μL,菌液2 μL,引物F、R各0.5 μL,去离子水7 μL,随后将PCR产物送生工生物(上海)公司进行测序,测序结果与GenBank中的序列进行比对。
1.3.2 ASFV p54蛋白的表达、纯化与鉴定 挑取单个菌落,接种于含氨苄青霉素的LB液体培养基中,37 ℃恒温摇床振荡培养至OD600 nm值为0.6~1.0,加入异丙基硫代-β-D-半乳糖苷(IPTG)诱导表达(终浓度为1 mmol·L-1),表达2 h后收集菌液。将菌液在4 ℃、10 000 r·min-1离心15 min后去除上清并收集菌体。用PBS洗涤菌体,再次离心去除上清。加入破菌缓冲液重悬菌体,冰上超声破碎,破碎后4 ℃、10 000 r·min-1离心15 min,收集上清,采用Ni Sepharose 6 Fast Flow 进行蛋白亲和层析纯化,收集洗脱物,进行SDS-PAGE分析和Western blot鉴定。纯化的蛋白,利用Pierce BCA Protein Assay Kit测定含量。
1.4 单克隆抗体(mAb)的制备
1.4.1 抗原免疫 取3只6周龄的BALB/c小鼠,3只小鼠分别标记为A、B、C。每两周免疫1次,共免疫3次。第一次免疫用PBS将原核表达且纯化好的p54蛋白稀释至200 μg·mL-1。取100 μL与完全弗氏佐剂按体积比1∶1混合均匀,乳化30 min。取200 μL乳化好的抗原在小鼠背部和大腿进行肌内注射,第二、三次免疫则采用不完全弗氏佐剂混匀的抗原。对照组注射等体积的PBS乳化液。从第一次免疫开始每次免疫后14 d将小鼠断尾取血制备血清,用间接ELISA方法检测血清抗体效价。选择抗体效价最高的小鼠,在融合前3 d加强免疫。
1.4.2 检测p54蛋白的间接ELISA方法 根据间接酶联免疫吸附试验(iELISA)方法的一般操作程序,将纯化的p54蛋白稀释至2.5 μg·mL-1,包被酶联免疫吸附试验微孔板,并用脱脂奶粉封闭。将ASFV阳性血清加入包被板,在37 ℃孵育45 min,用PBST洗涤3次后,加入HRP标记的兔抗猪IgG,在37 ℃孵育15 min。最后用显色底物溶液显色,读取OD450 nm值[18]。阴性对照OD450 nm<0.2时试验成立:S/N(待检样品OD450 nm/阴性对照OD450 nm)≥2.1,判定结果为阳性。
1.4.3 杂交瘤细胞的筛选及克隆 细胞融合前1 d制备好饲养细胞,将骨髓瘤细胞SP2/0和免疫后小鼠脾细胞进行常规PEG融合。并采用间接ELISA方法检测每孔杂交瘤细胞培养上清,对能产生抗体的阳性孔利用有限稀释法进行亚克隆,杂交瘤细胞筛选,利用有限稀释法对杂交瘤细胞进行单克隆[14]。
1.4.4 腹水型mAb制备、纯化 采用10周龄的BALB/c雌鼠,每只小鼠腹腔注射0.5 mL液体石蜡,7 d后再次通过腹腔注射阳性杂交瘤细胞(约5×106个)。每天定时观察小鼠的身体状况,约1周后小鼠会出现腹部膨胀的情况,此时收集腹水并离心,上清液即为含ASFV p54 mAb的腹水。利用Thermod单抗纯化试剂盒对收集到的腹水进行纯化。
1.5 mAb亚类鉴定与Western blot分析
用Sigma公司的单抗亚类鉴定试剂盒进行mAb亚类鉴定。将鉴定好亚型的mAb与转至硝酸纤维膜上的原核表达的p54蛋白进行杂交,同时用大肠杆菌细胞超声破碎上清作为阴性对照,用纯化得到的mAb作为一抗进行孵育,用HRP标记的羊抗鼠IgG作为二抗进行孵育显色,验证mAb的特异性。
1.6 阻断ELISA检测方法的建立及初步应用
1.6.1 最佳工作条件的确定 采用方阵法确定阻断ELISA方法的最佳反应条件:最佳包被抗原浓度(5、2.5、2.0、1.25、1、0.625 μg·mL-1,50 μL·孔-1,4 ℃包被过夜),HRP-mAb-p54最佳稀释度(1∶200、1∶400、1∶800、1∶1 000、1∶1 200),待检血清(1∶40、1∶80、1∶160、1∶320),HRP-mAb-p54最佳孵育时间(15、30、60 min),最佳底物显色时间(3、6、10 min)。
1.6.3 特异性试验 选取猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV)6种常见猪病病原的阳性血清作为样品,根据阻断率临界值判断该方法的特异性。
1.6.4 敏感性试验 将标准ASFV阳性血清做1∶80、1∶160、1∶320、1∶640、1∶1 280倍比稀释,利用建立的阻断ELISA方法进行检测,确定该方法敏感性。
1.6.5 重复性试验 采取同一批次包被的ELISA板,用ASFV阴、阳性血清各3份进行批内重复试验;取不同批次包被的ELISA板,用ASFV阴、阳性血清各3份进行批间重复试验。分别计算各血清样品的平均抑制率、标准方差和变异系数。
1.6.6 初步应用和符合性试验 使用采集自广东、云南等省份的猪血清1 000份,利用本研究建立的阻断ELISA方法进行检测。再选取部分阴性样品和全部阳性样品利用商品化检测试剂盒(西班牙INGENASA)进行验证,并计算二者的符合率。
2 结 果
2.1 包被抗原制备
2.1.1 重组菌株的构建与鉴定结果 将菌液进行PCR扩增和测序鉴定,结果显示(图1),在预期462 bp处出现了目的条带,表明重组菌株构建成功。序列比对结果显示,p54基因与ASFV SY18株相似性达100%。
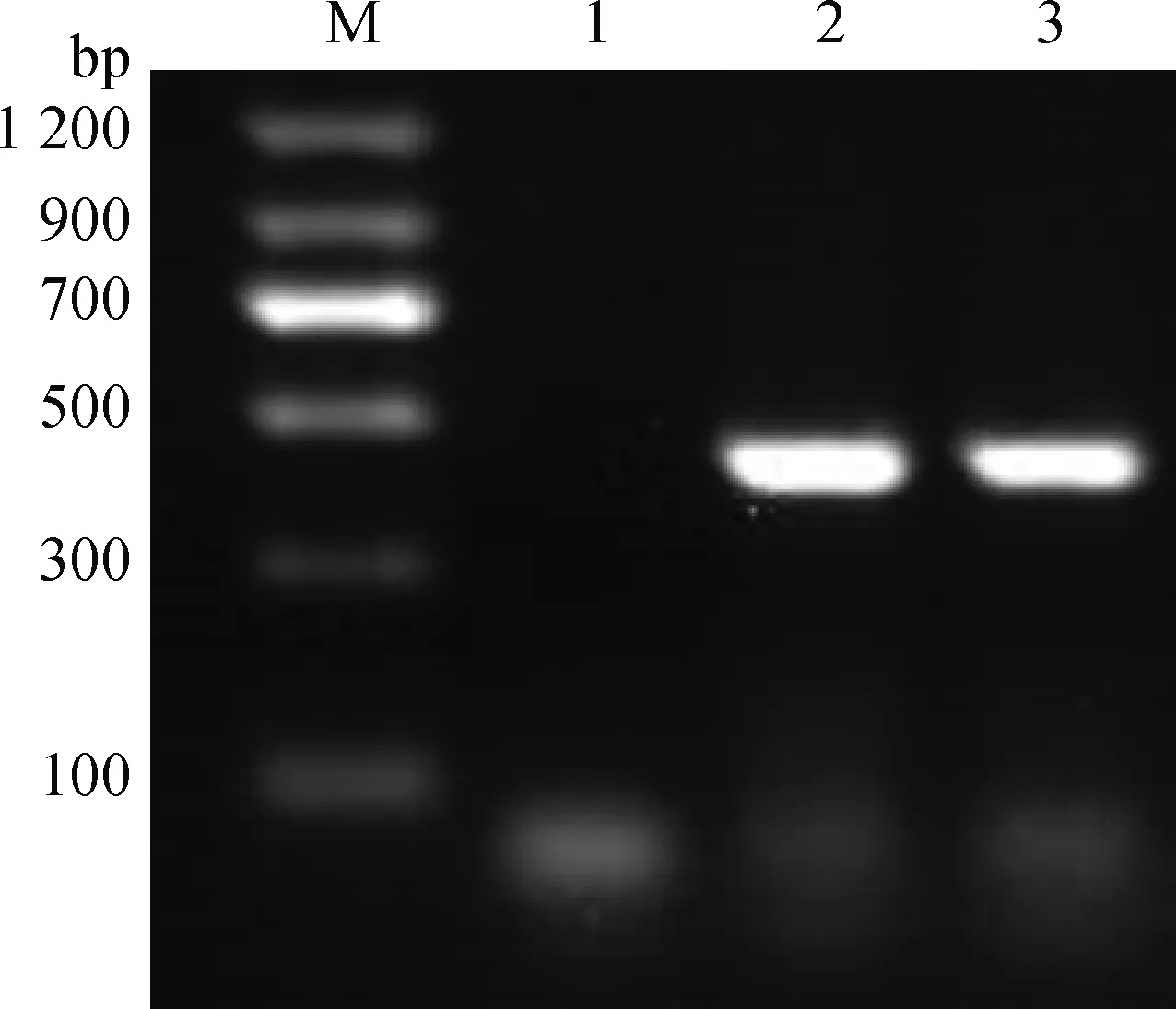
M.DNA marker Ⅱ相对分子质量标准;1.阴性对照;2.阳性对照;3.菌液
2.1.2 ASFV p54蛋白的表达、纯化与鉴定结果 将经Ni柱亲和层析纯化过程中每一步骤上清液收集起来,分别进行SDS-PAGE检测分析,结果显示(图2A),最终产生的柱脱液在预期的28 ku处出现了目的条带,纯化得到的蛋白纯度较高、杂蛋白少。Western blot进一步分析,结果显示(图2B),重组的p54蛋白能够与ASF阳性血清反应,预期目标处出现特异性条带。利用Pierce BCA Protein Assay Kit测定p54蛋白的浓度为2.5 mg·mL-1。
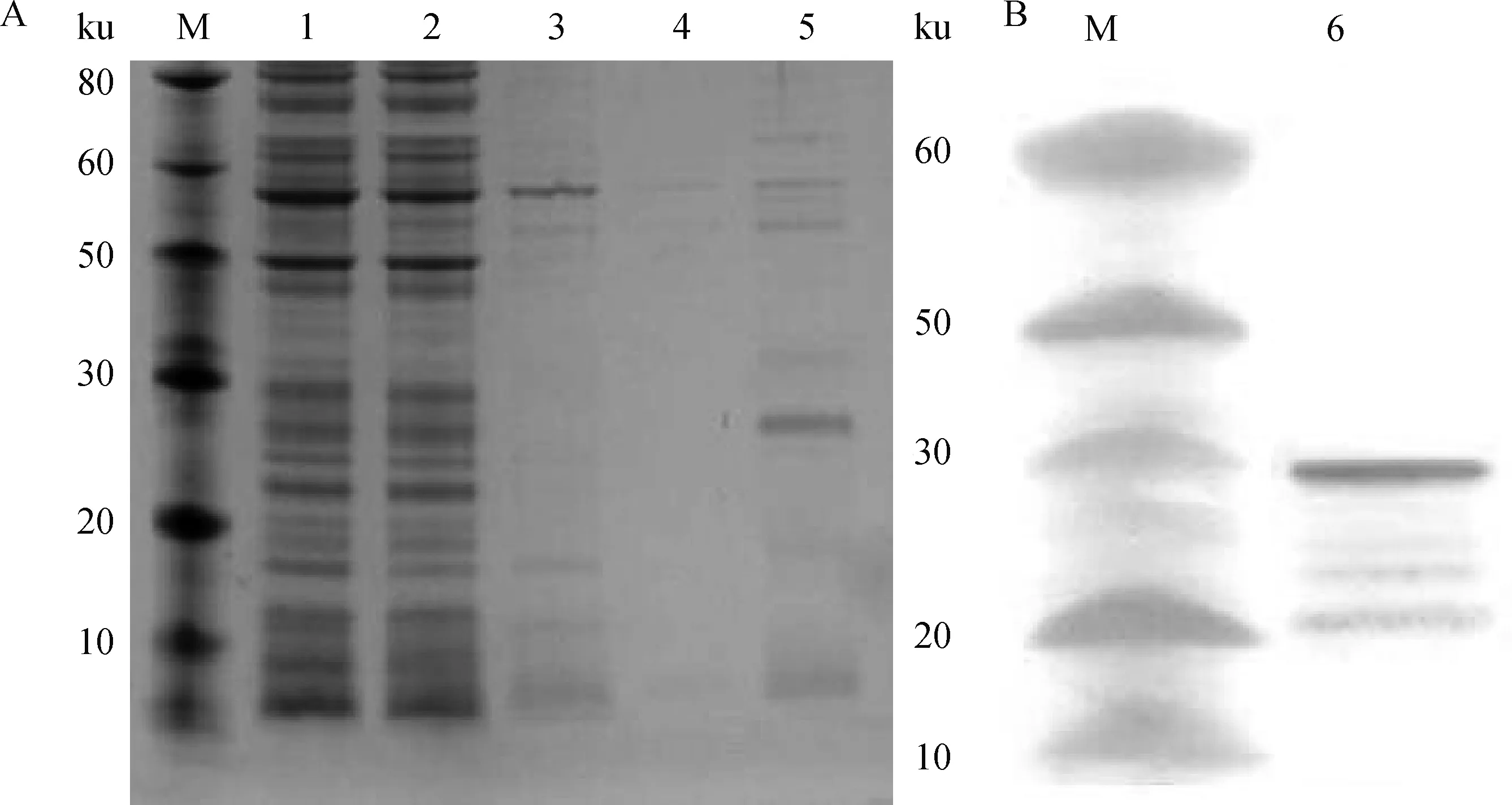
M.蛋白质相对分子质量标准;1.裂解上清;2.过柱穿透液;3.第1次洗脱组分;4.第2次洗脱组分;5、6.纯化的p54蛋白
2.2 单克隆抗体(mAb)制备
2.2.1 免疫小鼠的选择及血清效价的测定结果 相同的方法3次免疫3只小鼠后,经过间接ELISA分析,编号为C的BALB/c小鼠在第3次免疫后血清测得的OD450 nm值最高,血清效价可以达到6.4×104,故选择C小鼠脾用作细胞融合。
2.2.2 杂交瘤细胞的筛选及克隆结果 经间接ELISA筛选获得2株阳性杂交瘤细胞,经过6次筛选后阳性率为100%。选取其中1株进行试验,并命名为mAb-p54。
2.2.3 腹水型单抗的制备、纯化结果 测定腹水型单抗效价为1.28×105,利用Thermod单抗纯化试剂盒纯化,结果显示(图3),经过纯化后mAb中的杂蛋白明显减少,纯化效果好。纯化后测定mAb的浓度为1 mg·mL-1,制备的mAb可以满足免疫学检测方法的建立和免疫检测产品的研发。对mAb进行HRP标记,以此作为阻断ELISA方法建立时的阻断酶标二抗。
2.2.4 单克隆抗体亚类鉴定与Western blot结果 用Sigma公司的单抗亚类鉴定试剂盒进行单克隆抗体亚类鉴定,经鉴定单克隆抗体亚型为IgG1型。Western blot结果表明(图4),单抗不与大肠杆菌蛋白结合,可以和原核表达的重组蛋白p54结合,表明得到的单抗特异性较好。
2.3 阻断ELISA检测方法的建立及初步应用
2.3.1 最佳反应条件的确定 根据方阵滴定及优化后的各反应条件,确定阻断ELISA方法最优条件如表1所示。

表1 阻断ELISA检测方法的反应条件优化结果

2.3.3 特异性试验 利用建立的阻断ELISA方法检测CSFV、PRRSV、PCV2、FMDV、SIV、PRV 6种猪常见病毒阳性血清样本各2份及ASFV阳性血清1份,共计13份样品,结果显示:仅ASFV阳性血清阻断率达80%以上;其余均低于40%。表明该方法特异性较强。
2.3.4 敏感性试验 利用建立的阻断ELISA方法检测倍比稀释的ASFV阳性血清(稀释倍数为1∶80、1∶160、1∶320、1∶640、1∶1 280),结果显示,当阳性血清1∶640稀释时,阻断率为55.5%,仍为阳性结果,表明该方法敏感性较高。
2.3.5 重复性试验 利用建立的阻断ELISA方法对6份血清样品的批内重复试验及批间重复试验的变异系数均在10%以内,表明该方法重复性较好。
2.3.6 初步应用和符合性试验结果 采用100份从广东、云南等地区采集的猪血清样品,利用进口商品化的非洲猪瘟抗体ELISA检测试剂盒和本研究建立的阻断ELISA方法进行检测,结果显示,进口商品化的非洲猪瘟抗体ELISA检测试剂盒检测呈阳性的样品数为26,阴性的样品数为74;本研究建立的阻断ELISA方法检测呈阳性的性样品数为26,阴性样品数为72。通过计算,两个试剂盒的阳性符合率为100%,阴性符合率为97.3%,总符合率为98%(表2)。临床应用证明,本研究建立的阻断ELISA方法敏感性好,特异性强,与进口商品化试剂盒符合率高,可适用于临床血清学样品的非洲猪瘟抗体检测。

表2 符合率试验结果
3 讨 论
当前我国部分省区出现了低致死率的ASFV基因Ⅱ型自然变异流行株,相比典型强毒株致病力降低,主要引起持续感染和慢性病程,具有很强的水平传播能力,这些变异株临床表现具有一定的隐蔽性,早期诊断难度加大,给我国ASF防控带来全新的挑战[19-20]。鉴于ASF流行出现的新特点,对ASF早期诊断除了检测ASFV外,检测ASF抗体显得尤为重要。2021年3月7日,农业农村部印发了《非洲猪瘟疫情应急实施方案(第五版)(农牧发[2021]7号),提出了对ASFV抗体检测可采用阻断ELISA、间接ELISA、抗原夹心ELISA、间接免疫荧光等方法。因此,研制敏感性、特异性和稳定性好的ASFV抗体检测技术迫在眉睫。
使用ASFV结构蛋白建立ELISA检测方法具有成本低、特异性好、灵敏度高和检测速度快等优势,能够用于大量样品的自动化检测,是目前应用最广泛的检测方法[21-23]。本研究筛选出的ELISA包被抗原为原核表达的ASFV p54蛋白,p54蛋白是ASFV主要的结构蛋白之一,包含假定的跨膜域,对病毒形态的形成至关重要[24-26]。本研究中采用的酶标单抗所针对的抗原位点非常保守,理论上能检测到世界目前所有流行非洲猪瘟病毒株的阳性血清。有研究表明,p54的缺失会影响ASFV的稳定性,在病毒复制、转染、维持结构稳定性方面p54都发挥着重要作用,是ASFV的主要免疫原蛋白。p54蛋白抗原性良好,当猪被ASFV感染后其抗体大概在1周后出现,且持续数周[24,27-30],作为包被抗原建立的ELISA检测方法可以用于ASFV感染后全程的监测。
4 结 论
基于ASFV主要的结构蛋白p54蛋白建立检测ASFV的阻断ELISA方法,该方法特异性好、重复性好、灵敏度高,与国外同类商品化试剂盒具有良好的符合性。建立的检测方法为我国ASFV防控提供了技术支持,可用于ASFV免疫检测和血清流行病学调查。
