荷斯坦公牛X和Y精子核形态差异及其影响因素分析
2022-03-30丁凤玲上官爱哨李喜和张淑君
丁凤玲,上官爱哨,周 扬,丁 瑞,孙 伟,李喜和,张淑君*
(1.华中农业大学 动物遗传育种与繁殖教育部重点实验室,武汉 430070;2.内蒙古赛科星繁育生物技术集团股份有限公司,呼和浩特 011517)
精子形态与受精能力、运动能力有关。射精中形态正常精子百分比的减少与其生育力降低有关[1-2]。在对伊比利亚鹿和公羊的研究中发现,头小而细长的精子与快速运动密切相关,在高生育力雄性中更常见[3-4]。然而许多对精子的分析仍依赖于耗时和主观的人工评分,缺乏准确性和可重复性,试验操作人员之间的变异系数约为10%~80%,这限制了形态学评估作为精液质量预测指标的广泛应用[5-7]。
利用家畜性别控制精子和人工授精极大地提高了畜牧业生产效率和经济效益[8-10]。目前,流式分选在公牛精子性别分选中广泛应用[11],然而该技术仍存在精子受损较多和成本较高等不足之处[11-13]。研究还发现,流式分选可导致精子细胞膜磷脂紊乱[14]和蛋白质分布改变[15]等,从而使精子运动能力降低,顶体的完整性降低[16]。
精子的冷冻保存已成为繁殖、育种和保种的必要手段[17]。然而,随着冷冻过程中温度的急剧变化,细胞内发生了多种物理化学变化,严重损害精子质量和生育能力[18]。精子的结构和功能也都会受到冷冻的影响。细胞膜上的磷脂[19]和某些细胞骨架蛋白[20-21]的分布发生改变,鞭毛中与ATP代谢相关的蛋白质(HSP90)的丰度降低[22]。精子的遗传物质在冷冻过程中也发生了改变[23-25],包括DNA损伤和早期胚胎发育相关的精子mRNA转录活性下调[26]。冷冻保存还会诱导多种表观遗传变化,包括DNA甲基化水平增加和组蛋白修饰改变[27]。
哺乳动物X和Y精子的发生与成熟过程是相同的,但研究发现二者在DNA含量、运动能力等方面存在差异[28]。然而,荷斯坦公牛新鲜性控精子(X和Y精子)及其冷冻性控精子的核形态差异及其主要影响因素还不清楚。因此,本试验拟分析性控X和Y精子核形态及其差异,研究流式分选和冷冻过程分别对公牛精子、性控X和Y精子核形态的影响,为流式分选、冷冻等精液生产技术的改进打下基础。
1 材料与方法
1.1 主要仪器和试剂
1.1.1 主要仪器 SX型流式细胞仪(DakoCytomation,美国Fort Colllins公司),移液枪(德国Eppendorf公司),高速低温离心机(德国Thermo centrifuge X3R公司),电子天平(BL1500型,德国Sartorius公司),低速离心机(F8AΦ6×30型,中国北京医用离心机厂),无菌操作台(SW-CJ/2D型,中国江苏净化公司),荧光显微镜(Ti2-U型,日本尼康),数显恒温水浴锅(中国常州诺基有限公司)。
1.1.2 主要试剂 Hoechst-33342(Sigma,St Louis,美国);磷酸盐缓冲盐水(PBS,GE Healthcare Life Sciences,美国),4%多聚甲醛固定液,多聚赖氨酸(PDL),DAPI(4’,6-diamidino-2-phenylindole,4’,6-二脒基-2-苯基吲哚),抗荧光淬灭封片液,以上试剂均购于武汉碧云天生物技术公司。
1.2 精液处理及精子染色
于内蒙古赛科星繁育生物技术(集团)股份有限公司种公牛站选取15头健康、年龄相当的种公牛。使用假阴道法采集精液样本,原精送达实验室后,将精液转移到50 mL的离心管中,在室温(18 ℃)下保存30~60 min。按照以下程序进行精子分离。首先,用Hoechst-33342荧光染料(106个精子用量为0.3 mmol·L-1)对1 mL精液进行染色,在35 ℃黑暗条件下孵育1 h;其次,将样品通过30 mm尼龙网过滤器去除碎片及成团精子,在黑暗室温下保持15 min;然后,使用高速SXXDP流式细胞仪分离精子。分离后的X精子的纯度可达90%以上。将分离后的精液洗涤两次(在PBS中20 ℃以700 r·min-1离心10 min),去除上清保留精子沉淀。
精液冷冻步骤:将缓冲液(主要成分:柠檬酸钠、蛋黄、果糖、甘油、青霉素、链霉素)加入精液样品中,从25 ℃缓慢冷却至4 ℃,在4 ℃中平衡4 h。随后将试管精液在8 min内从4 ℃冷却至-140 ℃,转移到液氮罐中保存。冷冻样品在液氮中保存约10 h后,在37 ℃水浴解冻30 s,然后进行活力检测,确保每根吸管中的精子活力大于0.35。
制片步骤:取适量精液,加入1 mL预冷的PBS洗2次,1 500 r·min-1离心5 min,弃上清;加入4%多聚甲醛固定10 min;加入1 mL预冷的PBS洗2次,1 500 r·min-1离心5 min,弃上清;向EP管中加入PBS,使精子浓度为105个·mL-1,取100 μL精液涂于经多聚赖氨酸处理过的载玻片上,通风晾置数分钟,不能干透;加入DAPI染精子核10 min;加抗荧光淬灭剂封片,随后置于荧光显微镜下观察。
1.3 精子核形态分析
使用荧光显微镜(尼康,日本)观察载玻片上的精子(100×物镜,3.3×目镜),视频信号是通过安装在显微镜上的Sony CCD AVC-D7CE摄像机(索尼,日本)获取的。视频帧采集卡的阵列大小为512×512×8位,可提供262 144个像素和256个灰度的数字化图像。图像的水平和垂直轴分辨率均为每像素0.083 μm。仅考虑不与其他细胞重叠的精子进行分析。每个样本拍摄至少10个显微镜的视野,每个样本至少包含300个精子核。为了减少主观误差,载玻片中精子的处理和拍摄均由同一个人完成。
利用Image J软件的插件(Nuclear Morphology Analysis,version 1.15.0)分析精子图像。测定和分析精子核形态的8个参数,包括4个描述精子核大小的参数以及4个描述精子核形状的衍生参数。描述大小的主要参数是面积(A,area以μm2为单位,作为边界内所有像素区域的总和)、周长(P,perimeter以μm为单位,作为外部边界的总和)、最小直径(W,width,以μm为单位,Feret直径的最小值)和最大直径(L,length,以μm为单位,Feret直径的最大值)。4个描述精子核形状的衍生参数为椭圆度(ellipticity, L/W)、圆度(circularity, 4×π×A/P2),伸长度为(elongation,(L-W)/(L+W))和规则度(regularity, π×L×W/4×A)。
1.4 数据处理和统计分析
分析使用的软件是“Nuclear Morphology Analysis”(version 1.15.0)及R软件相关的数据处理工具。经过调试,设定的精子核面积大小范围是3 000~5 000(单位为像素),精子核椭圆度的大小范围为0.70~0.85,从而剔除掉有重叠的精子。统计结果用“平均值±标准误”表示。使用非参数检验——Mann-Whitney U检验,然后使用Bonferroni进行多重检验,校正后的P<0.05则认为具有显著性差异。
2 结 果
2.1 公牛精子核形态图像的信息
采集15头荷斯坦公牛的精子,通过流式分选和冷冻分别获得6种精子样本共3.7万个精子核图像(图1)。由于在每类精子中剔除了精子图像数量较少的公牛,故每种精子样本公牛头数不等,如表1所示。

A.染色后荧光显微镜拍摄照片;B.同一张图Image J软件识别的精子图像
2.2 性控X和Y精子核形态差异的比较
对12头荷斯坦公牛(因精子核图像较少删除了3头公牛)X和Y精子共7 950个精子核图像的大小(面积、周长、长和宽)与形状(椭圆度、圆度,伸长度和规则度)进行比较分析,从精子核大小的变化发现,12头公牛中有4头公牛(4/12)X和Y精子的核面积、周长、长度和宽度存在显著性差异(图2A);比较精子核形状的变化,4头(4/12)公牛X和Y精子的核伸长度和圆度有显著性差异,2头(2/12)公牛的精子核规则度和椭圆度有显著性差异(图2B)。
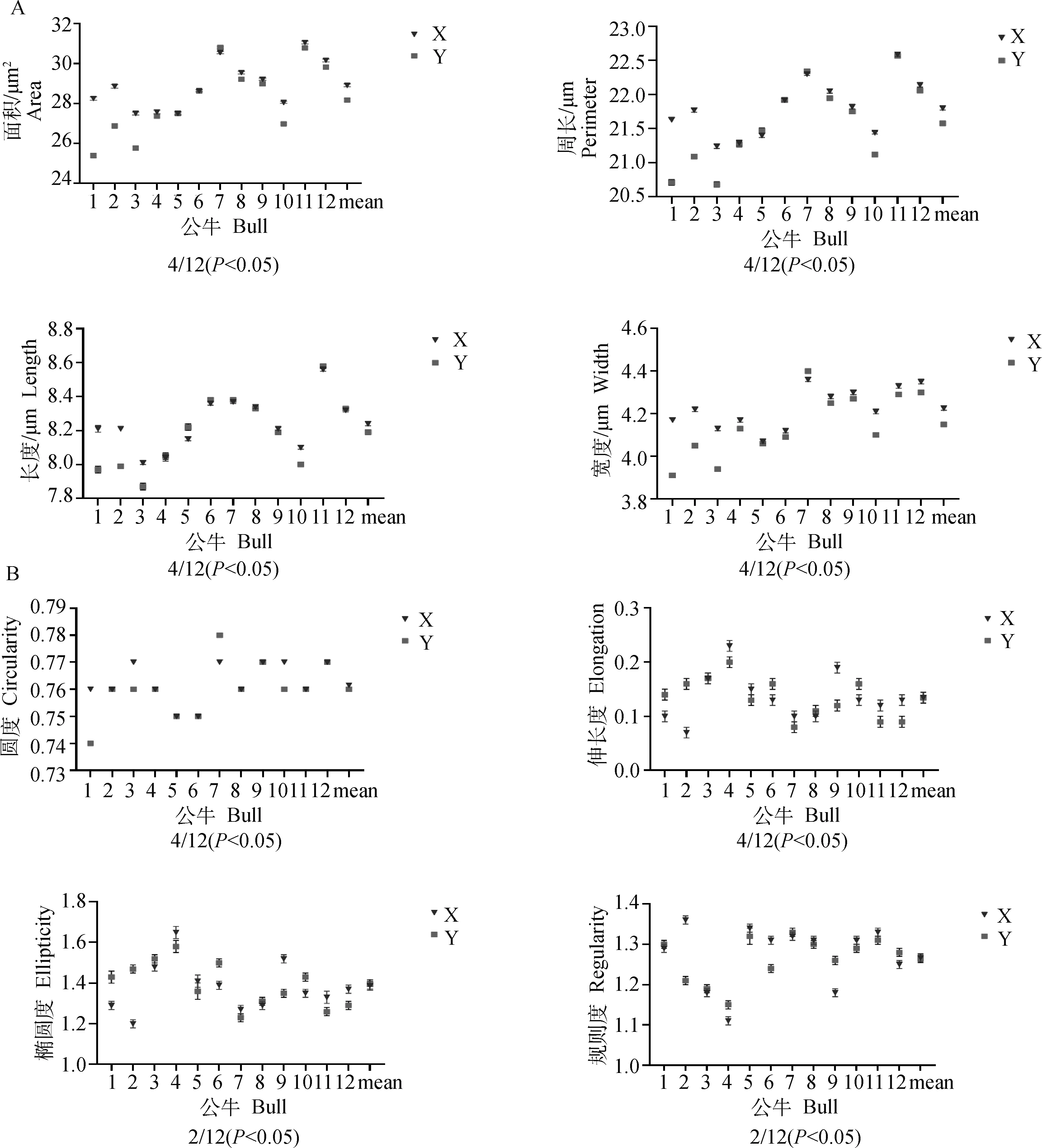
A.精子核面积、周长、长度和宽度;B.精子核圆度、伸长度、椭圆度和规则度。X轴为牛的个体编号,X轴的最后一项为所测牛只的均值;Y轴为各项参数的“平均值±标准误”
2.3 流式分选对牛精子核形态的影响
对流式分选前后11头荷斯坦公牛的精子核形态进行比较,分析了约1.13万个精子核图像(表1)。流式分选前后精子纯度如图3所示。
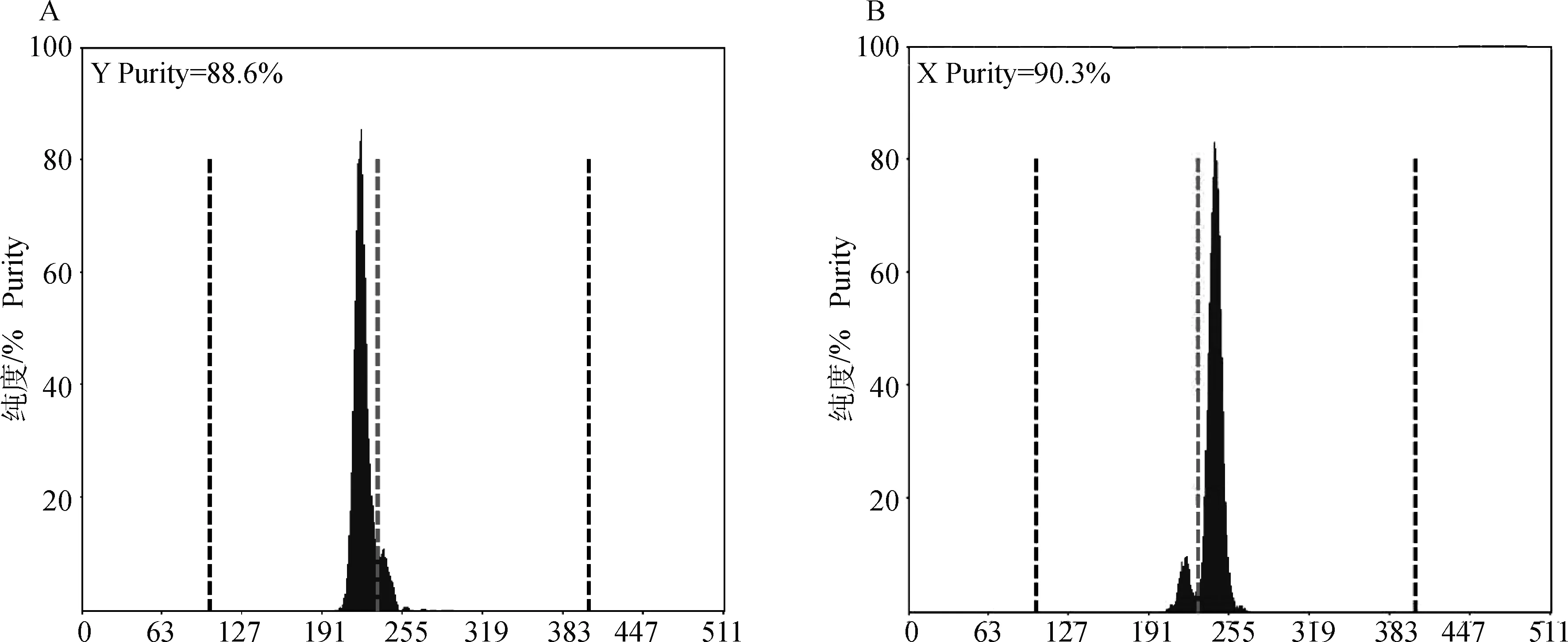
A.分选后Y精子纯度;B.分选后X精子纯度
2.3.1 流式分选对精子核大小的影响 对11头公牛的精子核面积、周长、长和宽4个参数在流式分选前后的平均值和标准误进行统计分析(图4),结果发现流式分选对精子核大小具有显著性影响,其中8头(8/11)公牛的精子核面积、周长和长度在流式分选后发生显著性变化,6头(6/11)公牛的精子核宽度在分选后发生显著性变化。
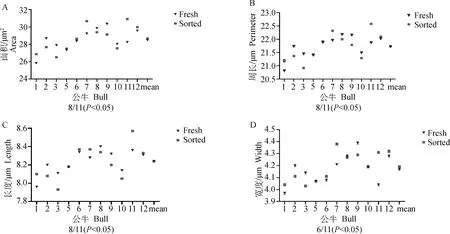
A.精子核面积;B.精子核周长;C.精子核长度;D.精子核宽度
2.3.2 流式分选对精子核形状的影响 比较11头公牛流式分选前后的精子核形状(图5),11头公牛中有5头(5/11)公牛精子核椭圆度、伸长度和规则度发生显著性变化,3头(3/11)公牛精子核圆度发生显著性变化。但是11头公牛精子核形状参数的平均值在流式分选前后差异不显著。
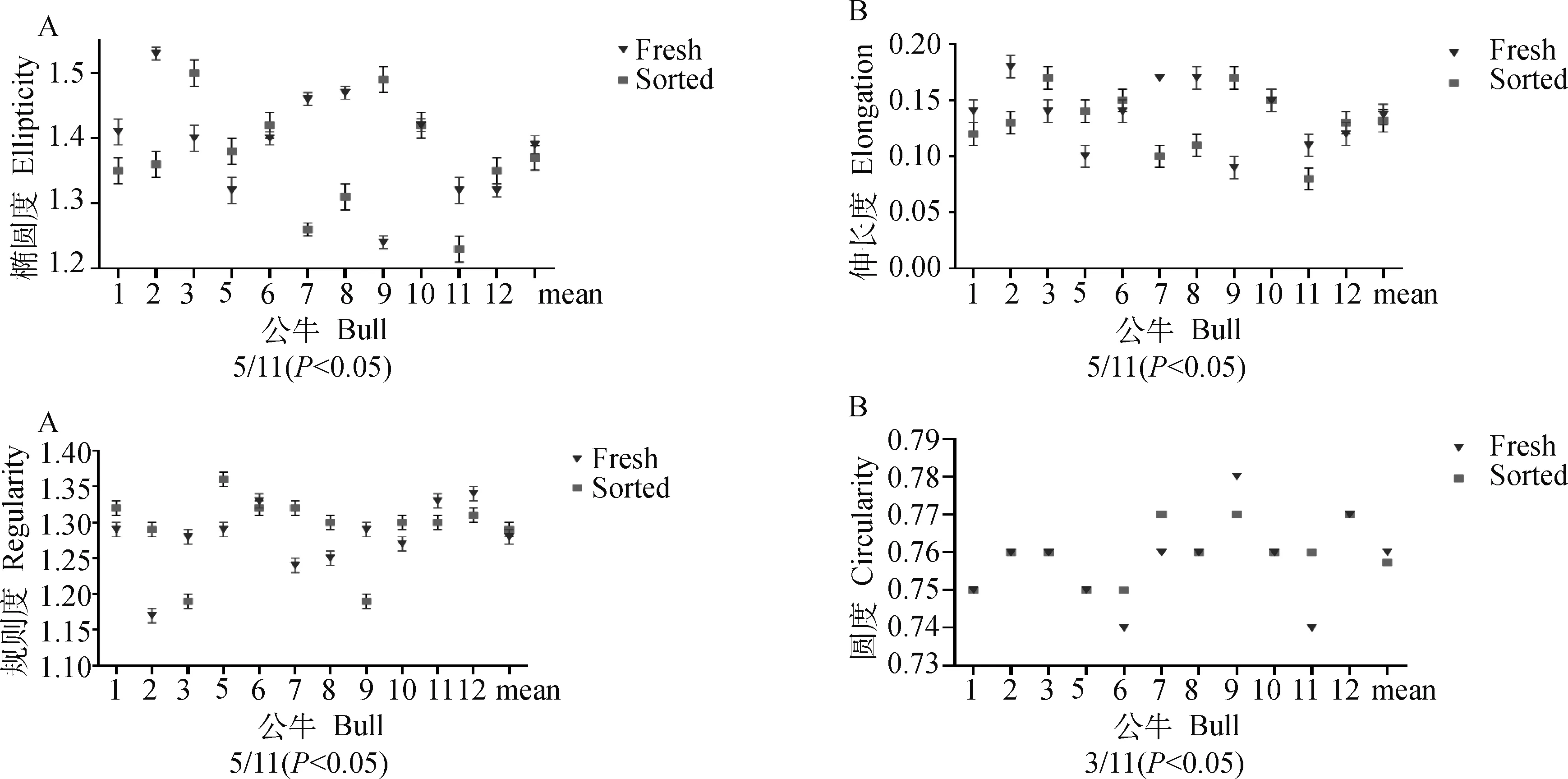
A.精子核椭圆度;B.精子核伸长度;C.精子核规则度;D.精子核圆度
2.4 冷冻对牛精子核形态的影响
本试验分析了冷冻对14头荷斯坦公牛精子核形态的影响,此外,为了研究冷冻对性控X和Y精子核形态的影响是否有差异,本试验对公牛冷冻前后的X和Y精子也进行了比较分析。
2.4.1 冷冻对精子核形态的影响 采集14头公牛冷冻前后约1.1万个精子核图像,分析冷冻对精子核形态的影响。11头(11/14)公牛的精子核面积和周长存在显著性差异,9头(9/14)公牛的精子核长度有显著性差异,10头(10/14)公牛的精子核宽度存在显著性差异,冷冻后精子核大小相关的4个参数发生显著性变化的公牛数量比例均大于50%(图6A)。而精子核形状相关的4个参数具有显著性差异的公牛个体比例均少于50%,其中有5头(5/14)公牛的精子核圆度有显著性差异,6头(6/14)公牛的精子核规则度、伸长度和椭圆度有显著性差异(图6B)。

A.精子大小,包括核面积、周长、长度和宽;B.精子形状,包括核椭圆度、圆度、伸长度和规则度
2.4.2 冷冻对X和Y精子核形态的影响 为比较冷冻对分选的X和Y精子核形态的影响是否有差异,本研究比较了12头公牛精子核大小和形状在冷冻前后的变化,结果发现,Y精子冷冻后精子核大小发生显著性变化的公牛数量(11/12)比X精子(5/12)多6头。
与未冷冻的X精子相比,少于50%公牛的X精子核大小在冷冻后发生显著改变,5头(5/12)公牛的精子核面积、周长和宽度发生显著变化,3头(3/12)公牛的精子核长度发生了显著变化。同时,少数公牛的精子核形状发生变化,4头(4/12)公牛的精子核椭圆度、伸长度和规则度发生显著变化,所有公牛的精子核圆度都没有显著变化。然而,Y精子冷冻后,超过50%公牛的精子核大小发生显著变化,11头(11/12)公牛的精子核面积、周长和宽度发生显著变化,9头(9/12)公牛的精子核长度有显著变化。少数公牛Y精子的核形状发生变化,4头公牛(4/12)的精子核椭圆度和伸长度发生显著变化,7头公牛(7/12)的精子核圆度和2头(2/12)公牛的规则度发生显著变化。
为了更直观地显示X和Y精子大小在冷冻过程中变化差异,以分析两者抗冻性的差异,本研究计算出了12头公牛Y与X精子核大小的冷冻前后的差值,统计分析每头公牛X和Y精子核大小差异(包括面积、周长、长和宽4个参数)的总和,并将其绘制为图7,从图中可知,精子核面积和周长是X和Y精子核大小差异的主要原因。为了更准确地反映X和Y精子核面积和周长在冷冻过程中变化差异,本研究进一步统计分析了12头公牛X和Y精子核面积和周长;冷冻前X和Y精子核大小具有显著差异的只有4头公牛,冷冻后精子核大小具有显著性差异的公牛增加到了8头,如表2所示。
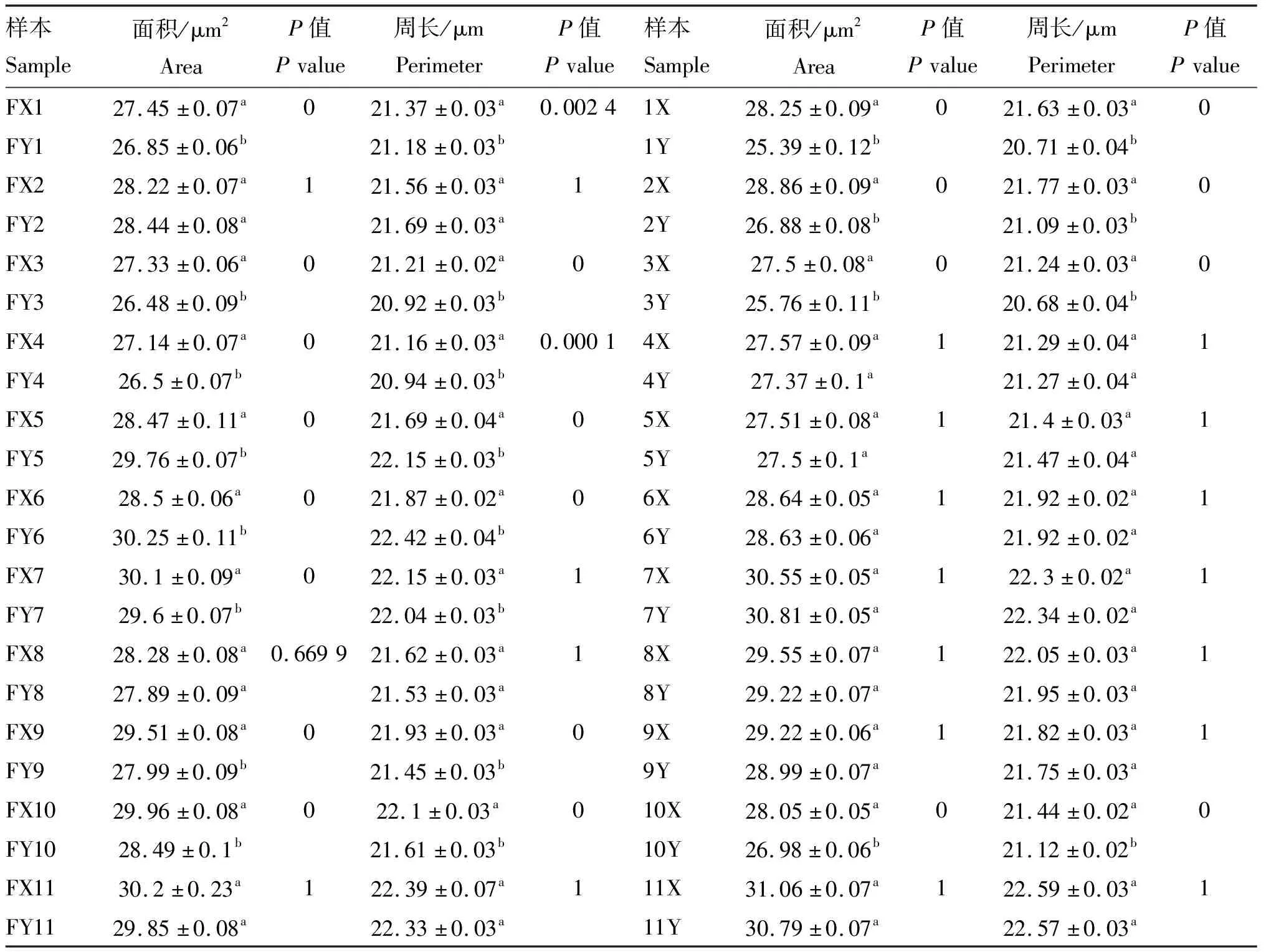
表2 冷冻对公牛X和Y精子面积及周长的影响
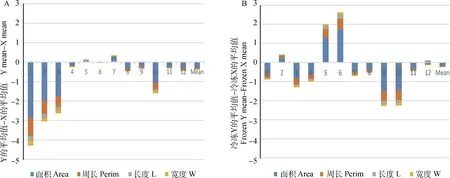
A.新鲜的Y精子与X精子的差值;B.冷冻后Y精子与X精子的差值。蓝色代表精子核面积,红色代表周长,灰色代表精子核长度,黄色表示精子核宽度
3 讨 论
为了获得准确的研究结果,在文献报道的不同物种X和Y精子核形态差异相关研究的基础上,本研究特别采取了以下措施:1)采用较新的图像处理插件Nuclear Morphology Analysis,能快速准确的采集和分析精子核二维图像;2)对较多的精子样本进行比较分析,为了比较荷斯坦公牛X和Y精子核形态及其差异,本研究采集了12头公牛共7 950个精子图像用于比较分析,大于现有研究报道的400~3 300个精子核图像[29];3)对精子核形态的8个参数进行了全面系统的比较分析,除了分析公牛X和Y精子核大小(精子核面积、周长、长度和宽度)的差异之外,还比较了其形状(精子核圆度、椭圆度、伸长度和规则度)差异;4)在分析和统计方法上,不是直接比较12头公牛X精子核的平均值与Y精子核的平均值的差异,本研究首先检验了数据的正态性和均方差性,发现精子核参数的分布不符合正态分布,所以选择非参数检验——Mann-Whitney U检验,对同一头牛的X和Y精子使用配对检验,然后使用Bonferroni进行多重检验,校正后的P<0.05认为具有显著性差异。本研究在比较了12头荷斯坦公牛X和Y精子核形态差异后,发现4头公牛性控X和Y精子核大小及形状存在显著差异,但X和Y精子核形态具有显著性差异的公牛数量比例(4/12)少于50%,12头公牛性控X和Y精子形态相关参数的平均值不存在显著性差异。因此,流式分选后的公牛X和Y精子核形态存在一定的差异,但是只有少数公牛的X和Y精子核形态存在显著差异。
本研究分析了流式分选、冷冻2种因素对荷斯坦公牛精子核形态(大小和形状)的影响,结果发现流式分选和冷冻对牛精子核大小具有显著性影响,对核形状的影响相对较小。现有文献只报道了冷冻显著影响精子核大小[30],没有关于冷冻对精子核形状影响的研究报道,有关流式分选对精子核大小和形状影响的研究报道也不多。
通过比较流式分选前后11头荷斯坦公牛的精子核形态,分析了约1.13万个精子核图像,结果显示流式分选后的精子核大小和形状都发生了变化,而精子核形状发生显著性变化的牛只数少于精子核大小发生显著性变化的牛只数。此前在针对牛、小鼠和猪的研究中发现,流式分选过程可以导致分选的细胞发生明显变化[31],包括精子细胞膜磷脂紊乱[14]、蛋白质分布改变[15]等。在牛中,研究者发现流式分选的精子运动能力降低,精子顶体的完整性降低,这些都会影响精子的生育能力。原因可能是机械[32]和化学物质相关的流式分选过程会影响精子与输卵管的结合[33]以及线粒体的完整性[34],从而影响精子的运动能力和活力。
通过比较14头荷斯坦公牛冷冻前后精子核形态(大小和形状)的变化,发现冷冻后11头(11/14)公牛精子核大小和6头(6/14)公牛精子核形状发生显著变化。与流式分选对精子核形态的影响结果类似,相对于精子核大小的变化而言,精子核形状的稳定性较高。除此之外,通过比较冷冻对X和Y精子核形态的差异影响,发现冷冻后Y精子核大小发生显著性变化的公牛数量(11/12)比X精子(5/12)多6头,在冷冻过程中Y精子核大小变化较大,以上结果显示,冷冻对性控X和Y精子核大小影响存在显著性差异。现有研究认为,精子的抗冷冻性与多种因素有关,不同亚群的精子具有不同的运动、功能和形态特征[35];能够快速运动且头部面积较小的精子亚群更能抵抗冷冻保存损伤。然而,由于用传统的分子方法难以单独分析存在于精液中的不同精子群,因此冷冻保存期间精子亚群之间存在差异的分子机制仍然不清楚,有研究者提出这些亚群之间的运动学和功能差异可能归因于不同的蛋白质谱[36]。本研究发现,冷冻对Y精子核大小的影响大于对X精子的影响,推测X精子比Y精子具有更强的抗冻能力。目前还没有关于X和Y精子抗冻能力差异的研究报道。现有报道认为,冷冻过程中X和Y精子在运动性能和能量代谢通路等存在差异,如参与形成精子尾部骨架结构的蛋白、线粒体膜蛋白、参与能量代谢调节的糖酵解酶和钙调素等存在差异[37-38]。冷冻导致精子活力和运动性能降低的原因主要有3个:1)冷冻过程中的氧化应激反应破坏线粒体活性,并损害轴突蛋白以及线粒体蛋白,从而使精子丧失运动能力[39];2)冷冻过程改变了公牛精子中与氧化磷酸化和糖酵解相关酶的丰度和含量[40],而这两者是反刍动物细胞代谢产生ATP的主要过程;3)由于细胞骨架蛋白对温度敏感,一些细胞骨架蛋白的丰度也会降低[41]。本研究认为,X和Y精子核大小对冷冻的抗性不同,推测X和Y精子在细胞骨架和能量代谢存在的差异以及冷冻过程对线粒体活性和ATP生成的不利影响可能是其部分影响因素。此外,本研究还发现,虽然性控X和Y精子形态相关参数的平均值不存在显著性差异,但少数荷斯坦公牛(约1/3)X和Y精子核形态具有显著性差异(P<0.05),值得进一步研究。由于目前流式分选技术分选获得的公牛X和Y精子准确率不能达到100%,本研究的结果还需要更多样本和更准确的方法进行验证。
4 结 论
本研究使用较新的图像处理插件分析了15头荷斯坦公牛约3.7万个精子核的图像,分析公牛X和Y精子核形态差异,流式分选和冷冻2种因素对公牛精子核形态的影响,以及冷冻对X和Y精子核形态的差异影响。明确了流式分选和冷冻对荷斯坦公牛精子核大小有显著影响,冷冻对荷斯坦公牛Y精子核大小的影响程度高于X精子等,将为公牛精液冷冻、性控精子分选等技术的完善提供参考。
