有机种植对玉米根际土壤代谢物的影响
2022-03-30龙飞宇刘佳斌刘贺鸣王宏燕
王 玲,龙飞宇,刘佳斌,刘贺鸣,王宏燕*
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.中国石油大学(北京)克拉玛依校区工学院,新疆 克拉玛依 834000)
有机种植系统禁止使用合成肥料和农药等人工材料,采用生态友好管理措施,以改善土壤健康状况,通常被认为较常规种植系统更可持续[1]。土壤细菌群落多样性通常被认为是反映生态系统土壤质量状况的生物指标,有机种植为当前土壤微生物群落问题提供有益解决方案。Lenc等试验结果显示,有机种植降低土壤源性植物病害[1]。Li等研究结果显示,有机种植方式提高土壤病害抑制能力[2]。Hartmann等研究结果表明,有机肥施用引起土壤微生物群落变化,促进土壤健康[3]。
根际土壤是植物生长最关键区域,是养分转化和土壤微生物群落研究热点。Lareen等试验结果表明,10%净光合作用固定碳可作为根系分泌物释放至根际,形成根际中不同微生物群落[4]。Swenson等研究结果表明,根际土壤微生物对有机化合物的新陈代谢也影响土壤微生物群落[5]。Mohanram和Kumar研究表明,根与微生物之间相互作用对植物生长非常重要[6]。可通过高通量测序与代谢组学方法了解根际土壤微生物群落结构和土壤代谢产物,阐明其相互作用。
土壤代谢组学作为一项新兴技术,可直接检测土壤微生物对不同条件的生物反应。Miller等试验结果显示,土壤代谢谱差异受作物种类、植物基因型和生长基质等多方面影响[7]。Johns等研究表明,土壤代谢组学将土壤中有机/无机化合物和微生物群落结合,土壤代谢物可用作土壤污染生物标志物[8]。因此,利用土壤代谢组学方法区分有机种植和常规种植的微生物群落功能可行,阐明根际代谢产物将有助于了解微生物群生化特征和不同种植方式下根际过程。
现阶段有机种植条件下,根际土壤代谢物研究较少,且根际土壤中代谢组学与细菌群落缺乏联合研究。本研究选择黑龙江典型盐碱黑土区作为采样点,开展高通量测序和土壤代谢组学研究,旨在了解根际代谢物与土壤健康之间关系,揭示不同种植条件下玉米根际土壤代谢产物之间差异,通过差异代谢产物参与代谢通路,研究其参与的生物学过程,分析不同种植条件下根际土壤群落功能机制,通过根际化学与细菌群落相关性分析,以阐明有机种植条件下玉米根际土壤细菌群落结构功能与土壤代谢物关系。
1 材料与方法
1.1 试验设计
试验地点位于黑龙江省大庆市萨尔图区喇嘛甸镇试验园区,地理位置为46°42′N,124°46′E,属于北温带亚欧大陆性季风气候,年平均气温为3.8℃,年降水量为457.0 mm,土壤类型为苏打盐渍土。
试验选取两种类型样地,分别为常规种植模式农田样地(CONV)和2004年后标准化有机种植模式农田样地(ORGN),常规种植在广泛调查基础上,根据当地农民平均施肥量和施肥施药方式,使用传统农药和除草剂,有机种植样地不使用任何农药和除草剂等化学物质,严格执行有机产品生产行业标准。种植玉米品种均为先玉335,播种和收获时间相同,有机样地采用多菌株组合微生物核心技术生产的生物有机肥,有机质≥40%,总养分(N+P2O5+K2O)≥4%。有机种植与常规种植农田等氮处理,其中有机种植施用有机肥(含氮量1.5%)7 260 kg·hm-2,玉米秸秆还田量4 500 kg·hm-2(含氮量0.58%),常规种植施用复合肥(N-P-K=14%-16%-15%)643.5 kg·hm-2和尿素(N=46%)96.75 kg·hm-2。
1.2 土壤采集和理化性质测定
2020年7月于玉米抽雄期分别在有机种植和常规种植农田取样,每次重复选取5棵玉米植株,随机挖取3个剖面并收集10~15cm土层玉米根,轻轻摇动根部后取样,所有根际土壤均是从距根表面不到5 mm地方采集,共6次重复。所有取样土壤置于冷藏箱运回实验室,提取DNA前,保存在-80℃。土壤理化性质参照鲍士旦《土壤农化分析》测定[9]。土壤碱化度=钠离子交换量/阳离子交换量。土壤含盐量测定,1∶5土水比混合,振荡5 min后过滤得到上层清液,烘干法测定总土壤含盐量质量分数。
1.3 高通量测序
采用Z.N.A.土壤DNA试剂盒(美国欧米茄)提取土壤DNA,NanoDrop(Thermo Science)测量,并通过琼脂糖凝胶电泳作评估。针对16SrRNA V4-V5区特异性引物F515(5´GTGCCA GCM GCCGCG 3´)和R907(5´CCGTCA ATTCMTTTRAGTTT3´)对细菌16SrRNA作扩增,每个样品引物序列中均包含6 bp特异性标签序列用于区分不同样品。PCR反应程序为:95℃3 min,35个循环:95℃30 s:55℃30 s:72℃45 s,72℃10 min。每个样品3个重复,PCR扩增产物混合后使用2%琼脂糖凝胶电泳(80 V,20 min)鉴定和分离条带,使用凝胶回收试剂盒(Agarose Gel DNA Purification Kit,TaKaRa)对PCR产物纯化,QuantiFluorTM-ST荧光定量系统(Promega,Madison,USA)检测定量,使用Illumina Miseq平台测序。
1.4 土壤代谢物测定
将1 g土样放入5 mL Eppendorf(EP)管中,加入1 mL甲醇∶水=3∶1(V/V)和1 mL乙酸乙酯,以10μL阿多酚(0.5 mg·mL-1)为内标。样品在45 Hz球磨机中匀浆4 min,后在冰水中超声5 min,随后样品在12 000 r·min-1和4℃下离心15 min,将上清液转移到5 mL EP管中。再次加入1 mL甲醇∶H2O=3∶1(V/V)和1 mL乙酸乙酯。重复研磨和离心步骤,将上清液合并在真空浓缩器中干燥,不加热。用30μL盐酸甲氧胺(20 mg·mL-1)溶解样品,80℃孵育30 min。
代谢物用气相色谱仪(Agilent7890,圣克拉拉,加利福尼亚州)和Pegasus HT质谱仪(GCTOF-MS,Leco,圣约瑟夫,密西西比州)检测。为消除和减少试验和分析过程中误差,对代谢组数据作标准化处理,去除缺失值大于20%特征值,缺失值填充方法采用极小值填充,为减少系统误差,提高样品之间可比性对数据作归一化处理。
1.5 统计分析
指数分析采用mothur(version v.1.30.2),用于指数评估的OTU相似水平97%(0.97);RDA分析采用R语言vegan包中RDA分析和作图;两组比较分析采用R(version 3.3.1)的stats包和python的scipy包;主成分分析(PCA)采用ropls(Rpackages);VIP分析采用ropls(R)和scipy(Python);差异代谢物分析采用ropls(R packages),聚类分析和KEGG通路分析采用scipy(Python),对代谢产物数据作log化处理,使其符合正态分布,利用Student´st检验数据差异;相关性分析采用scipy(Python)Version1.0.0。
2 结果与分析
2.1 土壤理化性质
由表1可知,种植方式导致土壤理化性质不同,有机种植处理中盐碱地土壤pH、碱化度和总盐量显著低于常规种植处理,土壤中全氮(TN)、有机质(OM)和速效钾(AK)显著升高,与其他研究结果一致。李思萌等研究有机种植对盐碱地理化性质的影响结果表明,有机处理提高全氮、全磷(TP)和速效钾含量[10]。有机处理中pH降低,主要原因在于有机种植通过秸秆还田和施用有机肥,改善土壤孔隙度和土壤粒级结构,促进盐分下降。有机种植处理的速效氮(AN)含量显著低于常规种植,与常规处理施用化肥,速效养分含量较高有关。总体看,有机种植处理提高土壤中全量养分含量,则与有机种植施用有机肥有关。

表1 有机种植与常规种植土壤理化性质Table 1 Physico-chemical properties of the organic and conventional soil
2.2 土壤代谢物
2.2.1 土壤代谢物代谢图谱分析
采用LC-MS非靶向代谢组学方法,分别以正离子模式和负离子模式测定土壤中4 458种和3 187种代谢物。根据人类代谢组数据库(HMDB)和京都基因和基因组百科全书(KEGG),共鉴定并命名483种代谢物。脂类及类脂分子181种、有机杂环化合物52种、有机酸及衍生物45种、有机氧化合物37种、苯丙素和聚酮类化合物29种、苯环型化合物21种、核苷、核苷酸和类似物7种、含氮有机化合物6种、生物碱及衍生物3种、烃类化合物3种、有机硫化合物2种、其他类化合物97种。在这些化合物中,脂类及类脂分子数量最多,占代谢物总数37.47%,其次是有机杂环化合物(10.77%)、有机酸及其衍生物(9.32%)和有机氧化物(7.66%)。所检测得到化合物,即土壤代谢物,来自植物根系分泌物、微生物代谢物和微生物,以及植物、微生物和土壤有机质分解。然而,区分代谢物来自微生物或植物仍是根际代谢组学面临的最大挑战。
2.2.2 主成分分析
采用多变量数据分析方法,研究种植方式对土壤代谢物的整体影响,以区分有机种植和常规种植方式下代谢变化,使用统计学上主成分分析法(PCA)作分析,PCA从总体上反应样本间差异及代谢物表达模式差异大小。使用ropls(Rpackages)软件(Version1.6.2)作分析,得到一组拟合两个主成分PCA模型,阳离子累计R2X=0.568,阴离子累计R2X=0.543,模型参数数值均大于0.5,且二者数值均在置信区间,说明根据试验建立PCA模型稳定,可用于代谢组学试验及代谢差异分析。图1主成分分析结果表明,有机种植处理中代谢产物与常规处理明显不同,沿第一坐标轴表现明显分离。
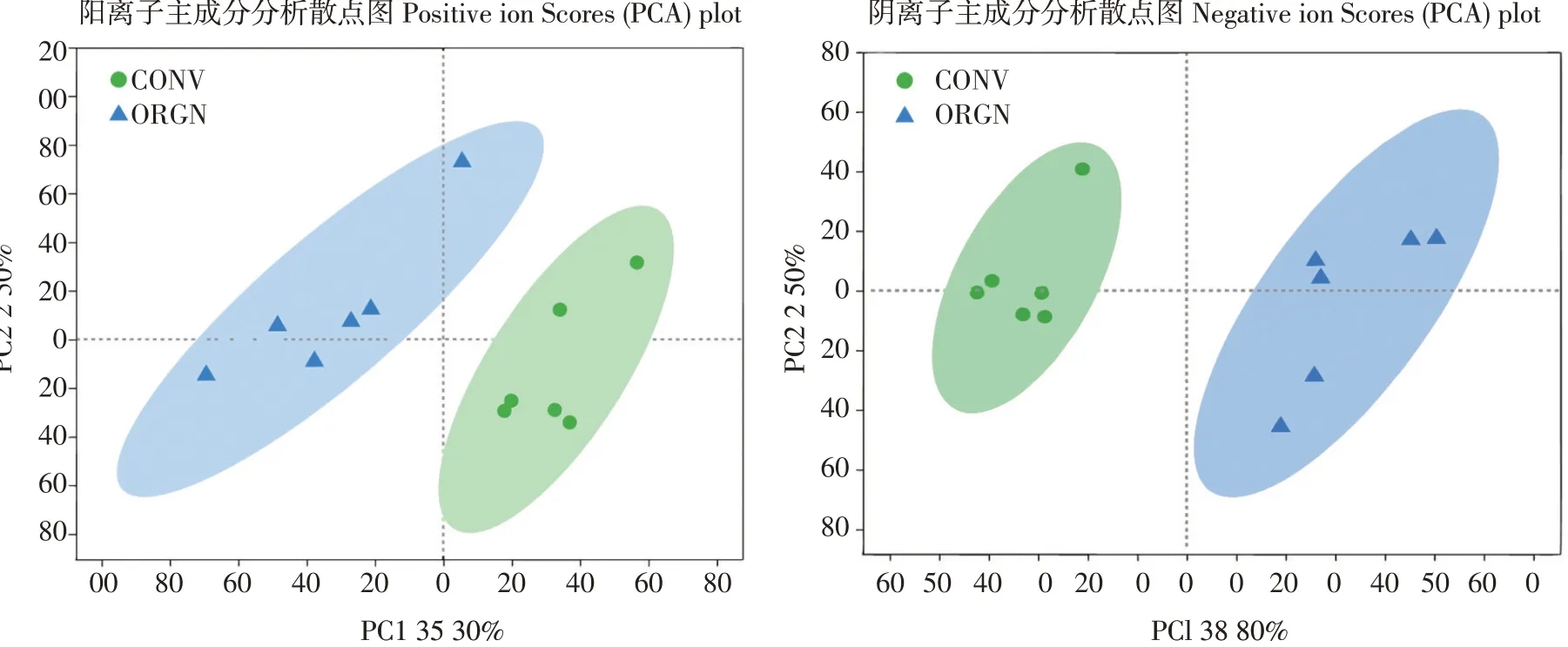
图1 差异代谢产物阴阳离子主成分分析Fig.1 Principal component analysisof positiveand negativeof differential metabolites
2.2.3 土壤差异代谢物确定
通过差异火山图(见图2)可知,土壤中检测到176种代谢物在有机土壤和常规土壤中含量存在显著差异(P<0.05,VIP>1)。其中有机土壤中,36种代谢产物表达量上升,包含生物碱及衍生物1种、核苷、核苷酸和类似物1种、有机氧化合物2种、苯丙烷和聚酮化合物2种、有机酸及衍生物3种、有机杂环化合物7种、脂质和类脂质分子9种,其他类11种;140种代谢产物表达量下降,包含碳氢化合物2种、有机氮化合物2种、核苷、核苷酸和类似物3种、苯类代谢物4种、有机氧化合物8种、苯丙烷和聚酮代谢物9种、有机酸及衍生物11种、有机杂环化合物16种、脂质和类脂质分子45种,其他类40种。结果表明,脂类代谢产物在有机和常规处理中比例最高,其中生物碱及衍生物代谢物仅在有机种植处理中上升,研究表明其对病原菌具有拮抗作用,可提高植物抗逆性,促进植物生长[2]。
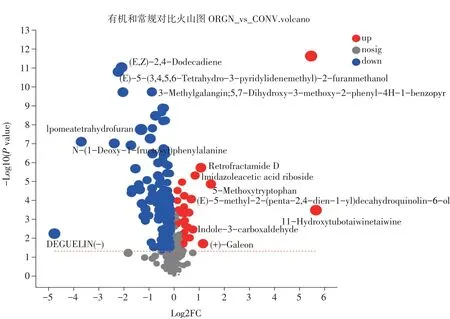
图2 根际土壤差异代谢产物火山图Fig.2 Volcanic map of differential metabolitesin soil rhizosphere
苯类、碳氢类和有机氮化合物代谢产物仅在常规处理中上升,苯类代谢产物在常规处理中增多可能与常规处理中杀虫剂、杀菌剂某些成分或农药中的苯类化合物有关。碳氢和有机氮化合物在常规处理中含量显著上升可能与施用氮肥有关,Chen等研究表明,氮肥施入土壤可激发土壤氮素矿化、吸收,并极易被微生物吸收利用[11]。
为进一步说明土壤代谢物详细变化,本研究计算OPLS-DA模型中VIP值。VIP值>1.0和P值<0.05代谢物被认为是受不同种植处理显著影响的代谢物(t检验)。VIP值最高的前30种代谢物列在图3中。所有VIP值高的代谢物在根际土壤中均有显著变化,有机处理中奥洛他定氮氧化物(Olopatadine n-oxide)、11-羟基吐温(11-Hydroxytubotaiwine)、(+)Galeon(苯丙烷和聚酮化合物)、Retrofractamide D(有机杂环化合物)、5-甲氧基色氨酸(5-Methoxytryptophan)代谢物相对含量与常规处理相比显著上升,且差异倍数达到2倍以上。而DEGUELIN(-)、替曲那新(Tetronasin)、异丙醇四氢呋喃(Ipomeatetrahydrofuran)、N-(1-脱氧-1-果糖基)苯丙氨酸(N-(1-Deoxy-1-fructosyl)phenylalanine)、6-苯基-3-己烯-2-酮(6-Phenyl-3-hexen-2-one)、5,7-二羟基-3-甲氧基黄酮(5,7-Dihydroxy-3-methoxyflavone)、17-羟基孕酮(17-Hydroxyprogesterone)、15-脱氧-β-12,14-前列腺素J2(15-Deoxydelta-12,14-PGJ2)、(E,Z)-2,4-十二碳二烯((E,Z)-2,4-Dodecadiene)、(E)-5-(3,4,5,6-Tetrahydro-3-pyridylidenemethyl)-2-furanmethanol(氢吡啶类化合物)、5-甲氧基色酚(5-Methoxytryptophol)含量较常规处理显著下降,差异倍数同样达到2倍以上。有机种植处理中根际土壤代谢物增加最多的是奥洛他定氮氧化物,下降最多的是17-羟基孕酮。奥洛他定氮氧化物属于有机酸及其衍生物,Shi等研究发现,作为主要根系分泌物的有机酸是根际土壤微生物群落变化主要驱动因素[12],说明有机处理刺激玉米有机酸分泌。本试验还发现有机处理中部分氨基酸代谢产物含量降低,与前人研究一致,Ding等研究发现有机肥施用显著降低部分氨基酸及其前体含量,说明有机肥施用明显抑制土壤中氨基酸合成和代谢[13]。

图3 根际土壤差异代谢产物VIP分析Fig.3 VIPanalysis of differential metabolites in soil rhizosphere
2.2.4 土壤代谢物代谢途径
通过途径富集分析阐明土壤代谢过程具体变化。如图4所示,嘧啶代谢(Pyrimidinemetabolism)、色氨酸代谢(Tryptophan metabolism)、类固醇激素生物合成(Steroid hormone biosynthesis)、星形孢菌素生物合成(Staurosporine biosynthesis)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、苯丙氨酸代谢(Phenylalanine metabolism)、苯丙烷生物合成(Phenylpropanoid biosynthesis)、吲哚生物碱生物合成(Indole alkaloid biosynthesis)是差异代谢产物之间最重要代谢通路,这些通路主要参与氮代谢和碳代谢途径,其中嘧啶代谢、硫代葡萄糖苷生物合成、类固醇激素生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成、星形孢菌素生物合成达到显著差异,嘧啶代谢途径中胸苷(Thymidine)、脱氧胞啶(Deoxycytidine)在有机处理中含量显著下降,尿嘧啶(Uracil)含量显著上升,类固醇激素生物合成途径中3种差异代谢物雄性激素(Testosterone)、17-羟基孕酮和四氢皮质酮(Tetrahydrocortisone)在有机处理中显著下降,星形孢菌素生物合成通路中主要有两种代谢产物L-脯氨酸(L-Proline)和L-色氨酸(L-Tryptophan),同时参与矿物质吸收,在有机处理中显著下降,苯丙烷生物合成途径中4-羟基-3-甲氧基肉桂醛(4-Hydroxy-3-methoxycinnamaldehyde)同样参与次生代谢产物合成途径,在有机处理中上升,而L-苯丙氨酸参与矿物质吸收、生物代谢等多种途径在有机处理中显著下降。

图4 土壤代谢物代谢途径富集Fig.4 Enrichment of metabolic pathway of soil metabolites
2.3 土壤细菌多样性和群落结构
土壤细菌群落丰富度和多样性见表2。有机处理土壤Shannon指数、ACE指数和Chao指数均高于常规处理,且差异显著(P<0.05)。有机系统中微生物多样性增加与所应用管理密切相关,包括采用减少或不存在化学品投入和生物植物保护等相关有机修复和实践措施。常规种植方式中微生物多样性减少可通过使用杀虫剂、杀真菌剂和除草剂等引起的直接或间接长期胁迫解释,这些农用化学品减少总微生物多样性,可能抑制或消除某些微生物群,造成适应生长的微生物群落存活。国外研究同样发现有机种植生物多样性水平更高[14]。

表2 有机种植与常规种植土壤细菌群落多样性指数Table2 Diversity index of soil bacterial community in organic and conventional soil
通过db-RDA约束性对应分析(Distance-based redundancy analysis),采用Bray-Curtis距离算法,将对应分析与多元回归分析结合,每一步计算均与环境因子进行回归,从而反映环境因子与土壤细菌群落结构相关性关系。db-RDA分析结果表明(见图5),pH、OM、TN、TP和TK是导致细菌群落结构变化最重要土壤因子。与前人研究一致,Dean等研究表明土壤微生物多样性和群落结构变化均与土壤特性相关[15]。Bell等研究发现农业种植方式对土壤微生物群落结构和多样性的影响可能是由土壤pH和养分含量的直接影响造成[16]。另外,本研究中有机种植和常规种植土壤中细菌群落可沿第一坐标轴分离,这与土壤代谢物结果一致。

图5 土壤细菌群落db-RDA约束性对应分析Fig.5 Distance-based redundancy analysisof soil bacterial community
基于各处理中群落丰度数据,运用单因素方差分析(one-way ANOVA),对不同处理中细菌群落中表现出丰度差异的物种作组间差异显著性检验,得到物种差异检验柱形图(见图6)。放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)在有机种植土壤中显著高于常规种植,其相对丰度升高与土壤中未分解的有机物有关,放线菌门具有降解纤维素的能力,能够分解有机种植中施入的大量有机物[17],绿弯菌门可用于根际中古老或较老的土壤有机质降解,绿弯菌门某些属降解有机物质,例如纤维素,半纤维素或几丁质。变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)在有机种植土壤中显著低于常规种植,变形菌门具有降解难降解有机化合物的能力,常规种植含量升高可能与施入农药有关。酸杆菌门被报道适应养分贫瘠的土壤,研究表明酸杆菌门相对丰度可作为土壤质量健康的一个指标[18],土壤质量越好酸杆菌门相对丰度越低,表明有机种植方式较常规种植方式更能保持土壤质量。

图6 土壤细菌群落组间差异显著性检验Fig.6 Test of significance of differencebetween groupsof soil bacterial community
2.4 土壤差异代谢产物与细菌群落相关性
土壤中代谢产物与土壤微生物之间存在相互作用,研究细菌群落和代谢产物之间相关性具有重要意义。为进一步阐明根际差异代谢物和微生物之间关系,基于细菌群落中有机种植与常规种植之间具有显著差异的物种,依据细菌相对丰度和差异代谢产物峰面积评估Pearson相关性,构建相关性热图关联分析(见图7)。结果显示,土壤细菌群落中变形菌门、酸杆菌门、疣微菌门(Verrucomicrobiota)、苏氏杆菌门(Sumerlaeota)、蛭弧菌门(Bdellovibrionota)、Abditibacteriota、纤维杆菌门(Fibrobacterota)、蓝藻菌门(Cyanobacteria)与绝大多数差异代谢物之间呈正相关,而放线菌门、绿弯菌门、Patescibacteria、Latescibacterota、盐厌氧菌门(Halanaerobiaeota)、Deinococcota与绝大多数差异代谢物呈负相关。差异代谢产物中考马林酸甲醚(Coumarinic acid methyl ether)、加诺德里奥尔I(Ganoderiol I)、维拉宁A(Vialinin A)、4-羟基-3-甲氧基肉桂醛、(E)-2,6-二甲基-2,5-庚二烯酸、亚甲胺对土壤细菌群落的作用与其他差异代谢物呈相反趋势。变形菌门与甲基三烯酮(Methyltrienolone)、Sylpin,3-[4-羟基-3-(3-甲基-2-烯-1-基)苯基]丙-2-烯酸(3-[4-hydroxy-3-(3-methylbut-2-en-1-yl)phenyl]prop-2-enoic acid)呈极显著正相关,放线菌门与6-脱氧叶黄素乙(6-deoxyerythronolide B)、前列腺素F3a(Prostaglandin F3a)、3-[4-羟基-3-(3-甲基-2-烯-1-基)苯基]丙-2-烯酸呈极显著负相关,绿弯菌门与甲基三烯酮、3-[4-羟基-3-(3-甲基-2-烯-1-基)苯基]丙-2-烯酸呈极显著负相关。其他研究同样发现细菌群落和根际代谢产物之间相关性,Li等发现秸秆还田作用下细菌群落结构与糖、有机酸具有相关性[19],贾甜华研究同样发现植物根际微生物与根系分泌物之间具有相关性[20]。
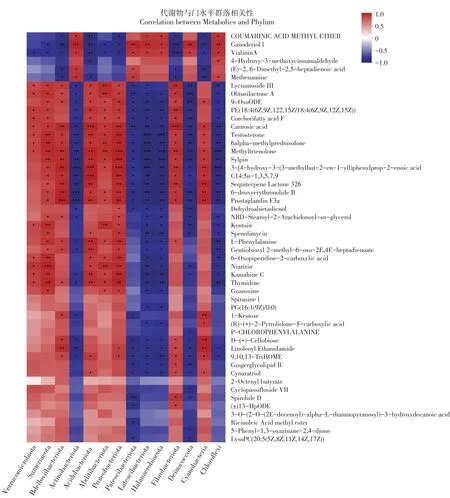
图7 土壤差异代谢物与细菌群落相关性热图Fig.7 Heatmap of the correlation between soil differential metabolitesand bacterial community
3 讨论
有机和常规种植制度在施肥方式、种植强度、除草剂使用和作物种类或基因型方面存在差异。侯宁等研究表明,这些因素是导致土壤理化性质、根际土壤微生物群落结构发生显著变化重要原因,且有机种植可转移和增强有益的微生物类群[21]。本研究表明与常规种植相比,有机种植在盐碱土壤中降低土壤pH,提高土壤中全量养分含量和土壤细菌群落多样性和丰富度。目前研究中,对于长期有机种植和常规种植下土壤微生物多样性和组成的了解仍有限且存在争议,有机种植与常规种植对比分析结果并不一致。部分研究表明,有机农业中使用的粪便可能将含有某些病原菌群微生物引入土壤;与常规种植相比,有机种植微生物多样性无显著差异,甚至更低[22]。
目前关于有机和常规种植根际土壤代谢产物研究较少,通过土壤代谢产物结合组学信息技术分析,可极大提高不同种植方式对农作物不同影响的理解。本研究利用LC-MC非靶向代谢组学检测有机种植和常规种植处理土壤样品,共检测到正负离子7 645种代谢物,其中鉴定并命名483种代谢物,鉴定代谢物比例仅为6.3%,大量色谱峰未被鉴定,因此利用代谢物PCA和差异火山图比较有机和常规处理组成和含量形成,结果表明玉米根际土壤代谢图谱发生明显分离,176种代谢产物在处理中差异显著。
本研究显示,差异代谢产物中脂质及衍生物在根际土壤代谢中含量高,与陈静等研究秸秆还田对温室黄瓜根际土壤代谢结果一致,不同处理之间脂质代谢产物在土壤代谢产物中比重最高[23]。但也有研究显示不同结果,Song等研究辣椒根际土壤代谢物发现,代谢产物中有机酸数量最多,其次是碳水化合物、醇和氨基酸[24];Liu等研究低氮对大豆根际土壤代谢产物发现,代谢产物中有机酸含量最多,其次是糖醇、氨基酸等次生代谢产物[25];Carvalhais等研究不同植物根系分泌物发现大部分由有机酸和糖构成[26]。Hayden等利用LCMS代谢组学方法鉴别谷类作物抑病土壤发现,同抑制性土壤相比非抑制性土壤中脂质和萜类含量更丰富,有机种植土壤因施用大量生物有机肥被认为是抑制性土壤不利于病原菌生存[27]。本研究表现相似结果,在常规处理中脂质和萜类相对含量更高,脂类由植物和微生物合成,是细胞代谢底物和产物,为植物和微生物代谢过程提供能量,并参与信号传导,常规处理中含量较高,可能与化肥中营养元素利于吸收有关,使植物营养物质积累。
有机酸在植物和微生物代谢中具有重要作用,是碳代谢循环中重要参与物,是驱动根际微生物群落变化重要因素。植物通过有机酸积累维持细胞内离子平衡,提高植物对碱胁迫适应能力,有机酸含量上升,有利于盐碱土壤中玉米生长。但有机酸分泌同样对植物具有化学自毒作用[28],影响植物根系正常发育并对植物愈伤组织生长具有抑制作用,有机酸达到一定浓度促进病原菌生长,导致植物病害发生。本研究中有机种植差异代谢产物中有机酸种类和含量较常规种植更低,可为常规种植与有机种植相比病害更严重提供新依据,且有机酸含量和种类提高,对土壤pH影响更为显著,也为长期施用化肥导致土壤pH降低提供依据,此前大量研究表明化肥施用导致土壤酸化原因是尿素经氮素循环产生氢离子,导致土壤pH下降。
本研究结果显示,差异代谢物中仅生物碱及衍生物在有机处理中上升,生物碱既参与多种生理过程,如细胞伸长、根冠信号传导、水分平衡、气孔运动和光合作用,促进植物生长,同时生物碱又是一种天然抗菌物质,具备较大抗菌图谱,通过抑制病原菌细胞壁合成,降低细菌代谢速率,抑制细胞生长和分裂相关蛋白生长,例如白屈菜红碱可通过阻断细胞膜物质生产,抑制变形杆菌生长,并破坏其细胞膜完整性[29],有机种植中生物碱含量上升,此为有机种植较常规种植病害发病率低的原因。
本试验中代谢产物产生差异重要原因是不同种植方式影响植物根际和微生物代谢途径(见图4)。常规种植中苯丙氨酸、酪氨酸和色氨酸生物合成增强,导致玉米植株中莽草酸代谢途径增强,使植物体内抗氧化剂合成含量增加[30],从而表现出玉米植株在常规种植下因化肥农药胁迫适应性特征。常规种植方式同样刺激类固醇激素生物代谢途径和星形孢菌素代谢途径增强,推测在根际代谢中,这些代谢产物具有相似功能特征,既促进植物根系生长又促进植物对营养物质吸收利用。有机种植处理提高苯丙烷生物合成途径中4-羟基-3-甲氧基肉桂醛含量,其参与次生代谢产物生成,或许是有机种植植株产生差异性状的原因之一。硫代葡萄糖苷生物合成在有机种植中代谢强度较常规种植低,这可能与硫代葡萄糖苷作为一种重要的次生代谢产物主要参与植物应对胁迫环境有关[31]。在植物面对纳米粒子、杀虫剂、杀菌剂、抗生素、重金属等胁迫时体内硫代葡萄糖苷含量上升,有机种植方式对植物造成的环境胁迫强度低于常规种植中农药以及多发病害对植物的胁迫,导致其生物合成较低。
土壤微生物群落和功能变化可为土壤代谢组学分析提供证据,土壤性质和细菌群落均可调节土壤代谢库,为确定在有机种植制度下土壤细菌群落与根际土壤代谢物图谱之间可能的联系模式,开展Pearson相关分析。结果表明,根际土壤微生物群落结构和根系分泌物之间具有相关性(见图7),张志英等在大豆研究中也得出同样结论,表明根系分泌物与根际微生物密切相关[32]。本研究中,放线菌门与6-脱氧叶黄素乙、前列腺素F3a、3-[4-羟基-3-(3-甲基-2-烯-1-基)苯基]丙-2-烯酸呈极显著负相关,绿弯菌门与甲基三烯酮、3-[4-羟基-3-(3-甲基-2-烯-1-基)苯基]丙-2-烯酸呈极显著负相关,且大多数差异代谢物与放线菌门和绿弯菌门呈显著负相关,而有机种植土壤中,这些代谢物在根系分泌物中表达量呈下调趋势,结合两者说明有机种植可能有利于放线菌门和绿弯菌门聚集,最终导致其相对丰度显著升高。db-RDA分析显示放线菌门和绿弯菌门与土壤中全量氮磷钾呈正相关(见图5),因此推论有机种植可能通过提高土壤中营养成分,影响土壤中微生物群落结构,影响根际土壤部分代谢产物。
4 结论
本研究通过土壤代谢组学和高通量测序,揭示有机种植和常规种植土壤中代谢产物组成、代谢途径以及土壤细菌群落组成和功能差异。研究发现有机种植土壤细菌群落多样性高于常规种植,pH、OM、TN、TP和TK是导致细菌群落结构变化最重要土壤因子,有机种植促进有机酸及衍生物分泌和生物碱及衍生物代谢,降低一些氨基酸及其前体含量,而苯类、碳氢类和有机氮化合物在常规种植中增加,差异代谢产物之间最重要代谢通路是氮和碳代谢途径,其中通路中尿嘧啶含量在有机处理中显著上升。根际土壤差异代谢物与土壤中细菌群落结构显著相关,部分差异代谢物在根系分泌物中表达量下调导致有机种植根际土壤中放线菌门和绿弯菌门丰度升高。
综上所述,有机种植模式为微生物创造良好生存环境,与常规种植相比改变细菌群落结构和多样性,改变根际部分土壤代谢产物和代谢通路,对土壤生态环境具有积极意义。本研究结果为不同种植方式对根系相关微生物群落的维持机制提供新见解。值得注意是,虽然代谢组学分析特定条件下特定时间代谢物,但土壤代谢物动态变化及其与土壤微生物群落结构关系还需进一步系统研究。
