引种栽培条件下大花黄牡丹根际微生物多样性及群落结构
2022-03-30高丹蕾吴璐瑶孟凡志
高丹蕾,吴璐瑶,孟凡志,袁 涛*
(1.北京林业大学园林学院,花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,园林环境教育部工程研究中心,北京 100083;2.山东农业大学林学院,山东 泰安 271018)
植物生长发育高度依赖养分吸收,根际养分是限制因素之一。这种限制迫使陆地植物进化出各种策略,包括与土壤根际微生物的有益相互作用、植物根和真菌之间共生相互作用等[1]。植物在生长过程中通过调节有机酸、氨基酸、酚类物质、植物生长调节剂等根系分泌物招募微生物,根际微生物种类和数量也影响植物生长发育[2]。根际细菌向宿主植物提供自身合成有益化合物,如节杆菌属(Arthrobacter)通过分泌细胞分裂素等植物生长激素促进植物根系发育[3];许多根际真菌抑制土壤传播的植物病原体,其对病原体的控制机制包括养分竞争、分泌抗生素和诱导抗性等[4];丛枝菌根真菌(Arbuscular mycorrhiza fungus,AMF)渗透到植物根皮层细胞中并形成一种特殊的丛枝状结构,作为真菌和宿主植物之间代谢物的交换媒介,有利于植物吸收更多养分[5],还可通过产生抗生素、诱导抗性和提供物理屏障等方式保护宿主植物免受病原体侵害[4]。
根际微生物促进植物生长发育,对植物引种驯化具有重要意义。Chen等发现接种地表球囊霉(Glomusversiforme)和摩西球囊霉(G.mosseae)可提高南美蟛蜞菊(Sphagneticola trilobata)在进入新生长环境后抗病能力[6];Majewska等调查分布于中欧37种外来植物根部AMF种类及其土壤营养状况,发现其中35种(占94.59%)外来植物均与AMF形成紧密关系,且具有相当丰度[7]。因此,探究植物生长根际微生物因素可为野生植物引种栽培提供新思路。
大花黄牡丹(Paeonia ludlowii)是芍药科芍药属落叶灌木,我国特有种,主要分布于西藏林芝市巴宜区至米林县海拔2 900~3 200 m雅鲁藏布江河谷及林缘、坡麓狭长地带[8],是芍药属濒危等级最高的物种之一[9]。目前,国内西藏以外地区引种大花黄牡丹成功率较低,且关于大花黄牡丹引种栽培研究仅涉及引种至兰州[10]、北京[11]和栾川[12-13]后栽培管理措施及成活情况,以及栾川引种地大花黄牡丹枝条发育特点和繁育系统[14-15],并未涉及土壤理化性质及根际微生物。
因微生物生长受限或培养基适应性差异,传统培养方法无法获得全面微生物种群信息。近年来分子生物学技术高速发展,高通量测序技术打破传统方法局限性,帮助全面深入了解植物根际微生物群落结构并大量开发未知微生物资源,如曹敏等通过高通量测序分析不同产地茅苍术(Atrac⁃tylodeslancea)根际AMF群落结构的地理分布格局差异[16]。本文基于高通量测序技术,分析位于河南省栾川县引种栽培多年大花黄牡丹不同土层深度根际细菌、根际真菌和丛枝菌根真菌多样性和群落结构,为探寻大花黄牡丹引种后优势根际微生物类群提供参考。
1 材料与方法
1.1 研究地概况与样品采集
研究地位于河南省洛阳市栾川县芍药科迁地保护圃,海拔1 240 m,大陆性季风气候,平均年降水量800~1 000 mm,常年最高气温35℃,最低气温-10℃,年均相对湿度达66%[17]。现有大花黄牡丹开花株600余株,系2002年秋播种育成,种子采自西藏林芝市巴宜区野生大花黄牡丹居群,2008年首次开花,开花株采收种子育苗后,仍正常开花结实[13]。自2015年起,每年仅夏季清除一次杂草,未施肥。圃内大花黄牡丹根系主要分布于0~20 cm深土层(见图1),肉质根系粗壮,其上密生吸收根,近地表处吸收根分布密集。至2021年,圃内大花黄牡丹最大株龄为18年,稳定开花。
2020年8月,大花黄牡丹果实成熟期,根据引种圃内地形、大花黄牡丹根系分布范围(见图1)及植株栽植密度设置5 m×25 m样方并确定取样深度(地下0~20 cm)。样方中随机选择5株作为5次重复,每株基部25 cm处设置3个取样点,去除表面枯落物,以地面为基准,向下0~10 cm为上层,10~20 cm为下层,用土钻分层取土,每层3个取样点混合作为1份样品,5次重复在上下两层共取10份土样。从每份土样中取出根系并抖落附着其上的大块土壤,轻轻刷下附着根系表面根际土。70%乙醇冲洗根系2次,无菌水冲洗3次后得到无菌根系样品。根际土与根系保存于-80℃,用于微生物测序试验。根际土外土壤样品为根围土,过30目筛,一部分风干后用于测定AMF孢子密度和土壤理化性质,另一部分4℃保存,测定AMF菌丝密度。

图1 引种地大花黄牡丹根系分布剖面图(A、B)(2021年10月)及根系分布示意图(C)Fig.1 Root distribution profile(A,B)(Oct.2021)and diagrammatic sketch(C)of P.ludlowii in introduction area
1.2 土壤理化性质
各指标测定均参考聂立水和王登芝方法[18],土样自然风干后过筛,pH计(上海三信MP523-01)测定土壤pH,重铬酸钾氧化-外加热法测定土壤总有机质,凯氏定氮法测定土壤总氮,靛酚蓝比色法测定土壤铵态氮,碳酸氢钠浸提法测定土壤有效磷,乙酸铵浸提-火焰光度法测定土壤速效钾。
1.3 根围土AMF孢子密度与菌丝密度
湿筛倾析蔗糖梯度离心法测定孢子数量,计算根围土中AMF孢子密度,以每10 g风干土样中含有孢子数表示;台盼蓝染色-交叉计数法测定菌丝密度,显微镜(奥林巴斯CX33 200倍)下观察25个视野,计数交叉点后计算菌丝密度[19]。
1.4 微生物测序
使用土壤DNA提取试剂盒(Mobio公司Power-Soil®DNA Isolation Kit)提取根际土和根系DNA,Thermo公司NanoDrop 2000检测DNA浓度和纯度,所有样品浓度达10 ng·μL-1,且OD260/OD280为1.8~2.0,保证DNA提取质量合格,可作扩增试验。细菌采用16SrRNA基因扩增通用引物515F(5´GTGC CAGCMGCCGCGGTAA 3´)和806R(5´GGACTACHV GGGTWTCTAAT 3´)扩增。PCR反应体系(50μL):TaqDNA聚合酶(5 U·μL-1)0.5μL,10×PCR缓冲液5μL,核苷酸混合物(2.5 nmol·μL-1)5μL,正、反向引物(10μmol·L-1)各1μL,模板DNA(20~30 ng·μL-1)1μL,超纯水补至50μL。PCR反应条件:94℃1 min;94℃20 s,57℃25 s,68℃45 s,30个循环;68℃10 min。真菌采用ITS基因扩增通用引物gITS7(5´GTGARTCATCGARTCTTTG 3´)和ITS4(5´TCCTCCGCTTTATTGATGC 3´)扩增ITS区。PCR反应体系与16SrRNA基因扩增反应体系相同。PCR反应条件:94℃1 min,95℃20 s,57℃25 s,72℃45 s,循环35次;72℃10 min。AMF采用巢氏扩增,第一轮引物选取NS31(5´TTGG AGGGCAAGTCTGGTGCC 3´)和AML2(5´GAACC CAAACACTTTGGTTTCC 3´)。反应条件:94℃预热3 min;94℃变性45 s,53℃退火45 s,72℃延伸45 s,35个循环;72℃延伸10 min。第1轮PCR产物稀释至1/10作为第2轮PCR模板。AMV4.5NF(5´AAGCTCGTAGTTGAATTTCG 3´)和AMDGR(5´CCCAACTATCCCTATTAATCAT 3´)作为第二轮扩增引物,其中AMDGR 5´端带有由12个碱基组成的barcode,第2轮PCR反应条件与第1轮PCR相同。所得产物经1%琼脂糖凝胶电泳(电压120 V,时间30 min),检测后送至广东美格基因科技有限公司作Illumina MiSeq测序。
1.5 数据处理与分析
测序数据上传至中国科学院生态环境研究中心宏基因组学实验室构建在Galaxy上的分析平台(http://mem.rcees.ac.cn:8080)[20]。序列Reads根据标签被分配到不同样品中并允许一个错配发生,然后去掉标签和引物序列。使用FLASH步骤合并相同序列正向和反向Reads。使用Btrim对Reads过滤,保持平均质量分数大于20,最小长度为140 bp。任何带有简并碱基序列均被删除,仅保留长度为245~260 bp Reads后,使用Greengenes参考数据集作为嵌合体检测的参考,使用UPARSE将序列聚类为可操作分类单元(Operational taxonomic units,OTU),序列相似度阈值为97%[20]。AMF、16S和ITS分别使用Silva、RDP和UNITE数据库对每个OTU进行物种注释。微生物α多样性通过Shannon、Inv Simpson、Pielou evenness、Observed OTUs和Chao1指数表征,不同群落间差异通过非度量多维尺度分析(Non-metric multidimensional scaling,NMDS),微生物群落与土壤理化性质之间相关性使用Mantel test确定,Excel 2016和SPSSStatistics 22分析数据,Thinkcell 10.0作图。
2 结果与分析
2.1 引种地大花黄牡丹根围土理化性质
由表1可知,引种地土壤有机质含量较高,根据《土壤肥力分级表》[26],引种地土壤养分级别为三级(中上),因地表枯枝落叶常年无人清理,上层有机质含量高于下层。但表1也显示引种地土壤N、P、K等养分含量较低,虽然上层高于下层,但各指标在不同深度无显著差异(P>0.05),可能因引种地多年未施肥导致。

表1 引种地大花黄牡丹根系不同深度土壤理化性质Table1 Physical and chemical propertiesof soil at different depths of Peonia ludlowii root in introduction area
2.2 引种地大花黄牡丹根际细菌与真菌多样性与群落结构分析
2.2.1 根际细菌与根际真菌OTU组成与相对丰度
10个根际土样本细菌与真菌分别得到620 079与669 570条优化序列,97%相似水平聚类后得到9 989个细菌OTUs和2 212个真菌OTUs。由图2可知,上下两层共有细菌OTU 2 746个,分别占上层和下层总OTUs54.27%和63.51%,上层根际土特有细菌种类比下层多;上下两层共有真菌OTU 1 108个,分别占上层和下层总OTUs48.09%和48.88%。
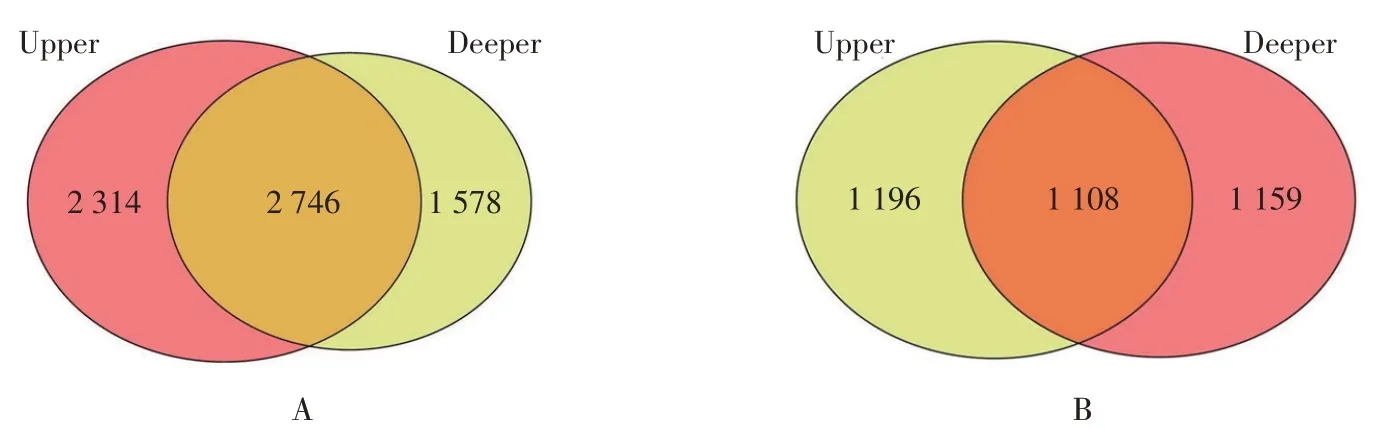
图2 引种地大花黄牡丹不同深度根际土特有和共有细菌(A)和真菌(B)OTUs韦恩图Fig.2 Bacteria(A)and fungi(B)OTUs Venn diagram of rhizosphere soil in different depth of P.ludlowii in introduction area
细菌所有序列经注释后被分类为26门67纲512属,门水平上相对丰度高于1%菌门,如图3(A)所示。不同深度优势菌门相似,其中变形菌门(Proteobacteria)优势最大,上层和下层相对丰度分别为67.80%和71.18%。其他优势菌门中,放线菌门(Actinobacteria)在上层相对丰度(9.19%)与下层(10.10%)接近,酸杆菌门(Acidobacteria)在上层相对丰度(6.29%)高于下层(4.95%),拟杆菌门(Bacteroidetes)在上层相对丰度(6.29%)高于下层(4.95%)。如图3(B)所示,属水平上最有优势类群为假单胞菌属(Pseudomonas),在上层和下层相对丰度分别为47.85%和55.15%。
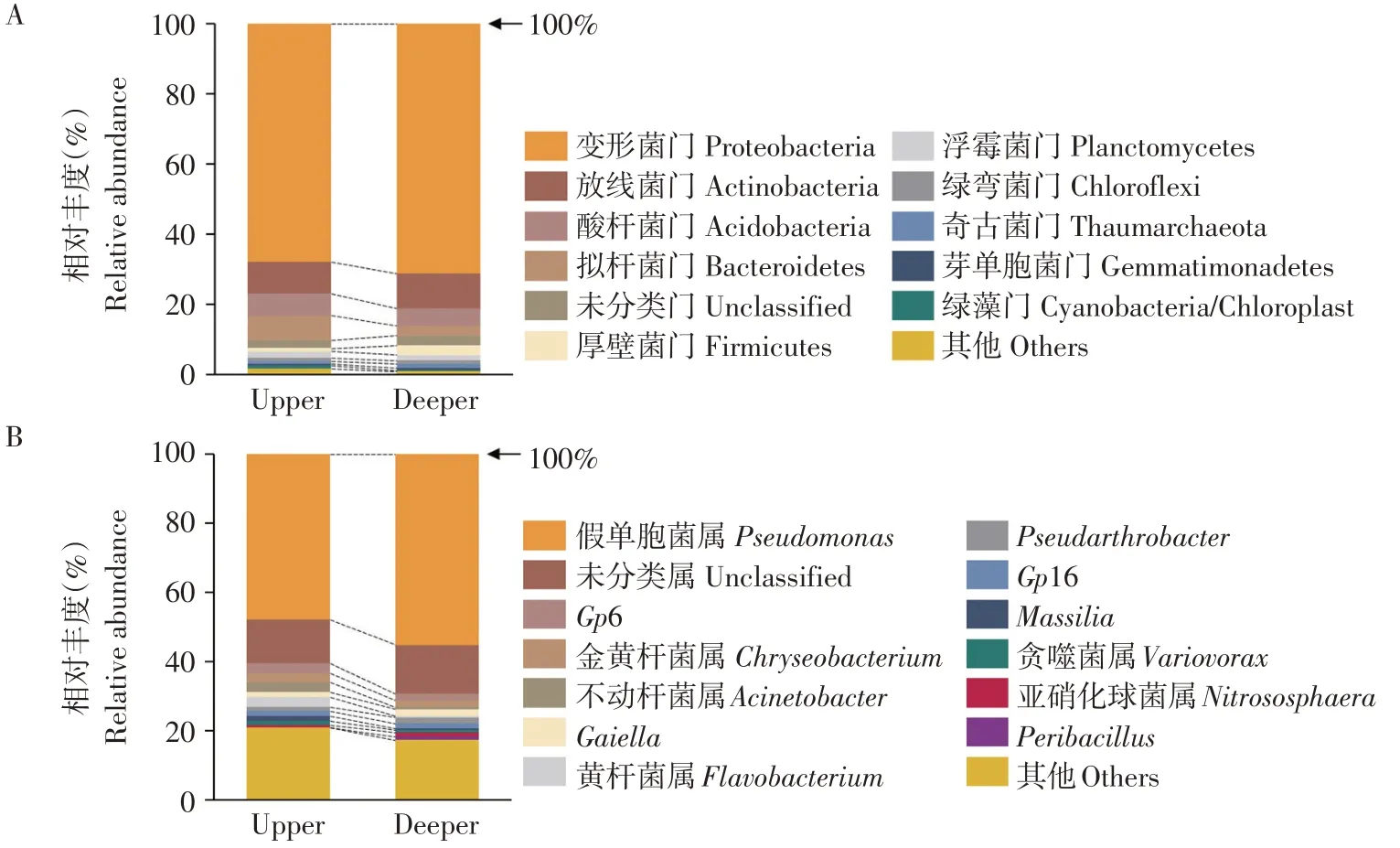
图3 引种地大花黄牡丹不同深度土层根际细菌在门水平(A)和属水平(B)相对丰度Fig.3 Relativeabundanceof rhizospherebacteria community at thephylum level(A)and thegenuslevel(B)in different soil depth of P.ludlowii in introduction area
真菌经注释后分为15门58纲712属,门水平上相对丰度高于1%类群如图4(A)所示。其中子囊菌门(Ascomycota)相对丰度最高,上层和下层分别为42.17%和43.68%,担子菌门(Basidiomycota)在上层相对丰度(19.42%)低于下层(26.99%)。此外,上层根际土中检测到捕虫霉门(Zoopagomycota)、Aphelidiomycota、隐真菌门(Rozellomycota)和蛙粪霉门(Basidiobolomycota)4门,下层未检测到。
如图4(B)所示,属水平上,被孢霉属(Mortier⁃ella)在上层和下层相对丰度相近,分别为8.62%和8.67%。莫氏黑粉菌属(Moesziomyces)在上层相对丰度(3.37%)低于下层(9.73%),但缘刺盘菌属(Cheily⁃menia)相对丰度(7.16%)高于下层(1.56%)。但占比最大是未分类属(Unclassified)。
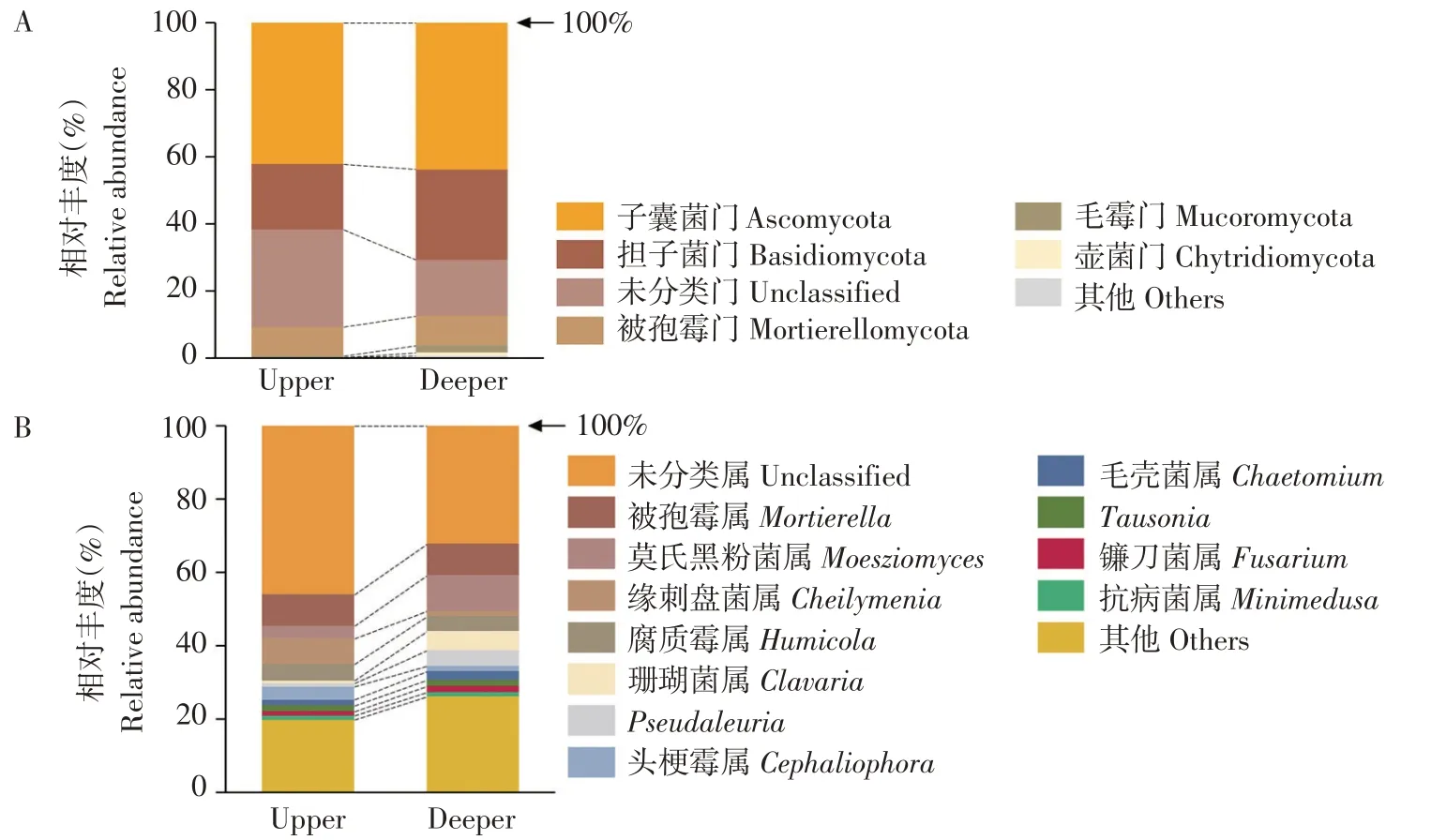
图4 引种地大花黄牡丹不同深度土层根际真菌在门水平(A)和属水平(B)相对丰度Fig.4 Relativeabundanceof rhizospherefungicommunity at thephylum level(A)and thegenuslevel(B)in different soil depth of P.ludlowii in introduction area
2.2.2 根际细菌与真菌α多样性
根际细菌在上层土壤观测丰富度(Observed OTUs)和香农(Shannon)指数高于下层,上层根际细菌丰富度更高,但上下两层无显著差异(P>0.05)。其余多样性指数均为上层低于下层,层间无显著差异(P>0.05)。
2.2.3 根际细菌与真菌β多样性
NMDS分析是群落β多样性常用分析方法,其对样本群落进行降维排序,在二维平面上判断样本之间关系,同组样本点距离远近说明样本重复性强弱,不同组样本远近则反应组间样本差异。基于Bray-Curtis距离NMDS分析结果见图5,不同深度根际细菌与根际真菌群落均有重合,差异较小。

表2 引种地大花黄牡丹不同深度土层根际细菌与真菌多样性Table 2 Diversity of rhizosphere bacteria and fungiin different depth of P.ludlowii in introduction area
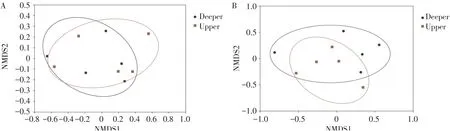
图5 引种地大花黄牡丹不同深度根际细菌(A)和真菌(B)群落结构NMDS分析Fig.5 NMDSanalysisof rhizospherebacteria(A)and fungi(B)community structurein different depth of P.ludlowii in introduction area
2.3 引种地大花黄牡丹根际和根系AMF多样性与群落结构
2.3.1 根围土AMF孢子密度与菌丝密度
大花黄牡丹上、下层根际土中均存在AMF孢子和菌丝,上层土中孢子密度和菌丝密度均高于下层,但二者并无显著差异(P>0.05)。

表3 引种地大花黄牡丹不同深度根际土AMF孢子密度与菌丝密度Table3 AMFSporedensity and hyphal length density of rhizosphere soil in different depth of P.ludlowii in introduction area
2.3.2 根际土和根系AMF的OTU组成与相对丰度
对上、下层根际土和根系AMF高通量测序共得到92 079条优化序列,在97%相似水平将所有序列聚类为116个OTUs。其中,根际土中合计48个,上、下层分别为37个和27个,两层共有OUT为16个;根系中提取到110个OTUs,上、下层分别为88个和101个,两层共有OTU为79个;根际土与根系共有OTU为42个(见图6)。
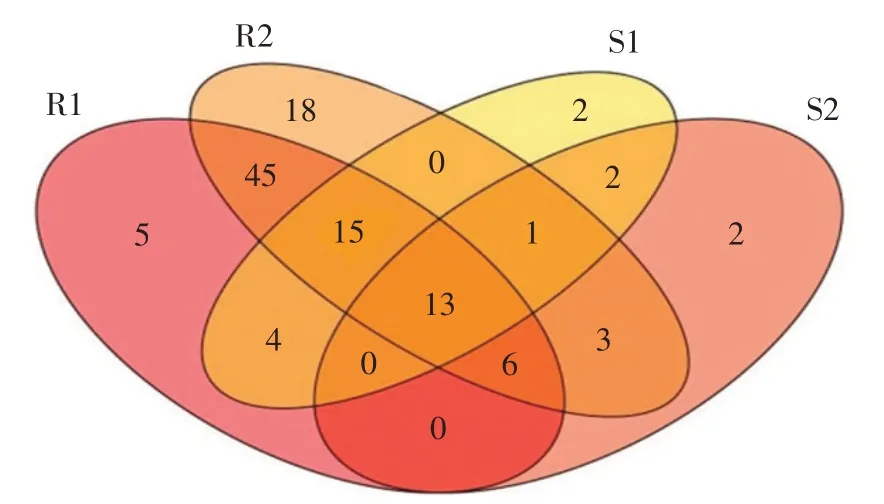
图6 引种地大花黄牡丹不同深度根系与根际土特有和共有AMF OTUs韦恩图Fig.6 Special and common AMF OTUs Venn diagram of root and rhizosphere soil in different depth of P.ludlowii in introduction area
除未确定分类地位OTUs,所有根系和根际土样品AMFOTUs分属于球囊菌门(Glomeromycota)球囊菌纲(Glomeromycetes)4目7科10属。根系与根际土AMFOTUs在属水平相对丰度如图7所示,球囊菌纲未分类属(Glomeromycetes_unclassified)相对丰度最高,在根际土和根系中均达到60%以上;近明球囊霉属(Claroideoglomus)在根际土中相对丰度(22.72%)高于根系中(8.90%),隔球囊霉属(Septoglomus)在根际土(10.66%)和根系(15.41%)中相对丰度相近。球囊霉属(Glomus)在根际土中相对丰度为4.09%,而在根系中并未检测到。

图7 引种地大花黄牡丹属水平根系与根际土AMF相对丰度Fig.7 Relative abundance at the genus level of AMF community in root and rhizosphere soil of P.ludlowii in introduction area
如图8所示,在根系中,近明球囊霉属上层相对丰度(16.43%)高于下层(0.98%),隔球囊霉属则下层(26.14%)高于上层(5.22%),差异明显;根际土中,近明球囊霉属上层相对丰度(16.62%)低于下层(29.71%),而隔球囊霉属上层相对丰度(12.63%)高于下层(8.40%),类球囊霉属(Paraglomus)下层相对丰度为16.02%,远高于上层(2.93%)。
图8 引种地大花黄牡丹不同深度土层根际AMF在属水平相对丰度Fig.8 Relative abundance of AMF community at thegenuslevel in different depth of P.ludlowii in introduction area
2.3.3 根际土与根系AMFα多样性
引种地大花黄牡丹根系中AMF多样性分析(见表4)表明,各项指数均为下层大于或等于上层,根系AMF多样性在下层较高,层间差异却并不显著(P>0.05)。根际土中AMF多样性分析则表明,多样性指数均为上层大于或等于下层,说明接近表层的根际土中AMF多样性更高且可能存在更多稀有种类,但层间差异不显著(P>0.05)。
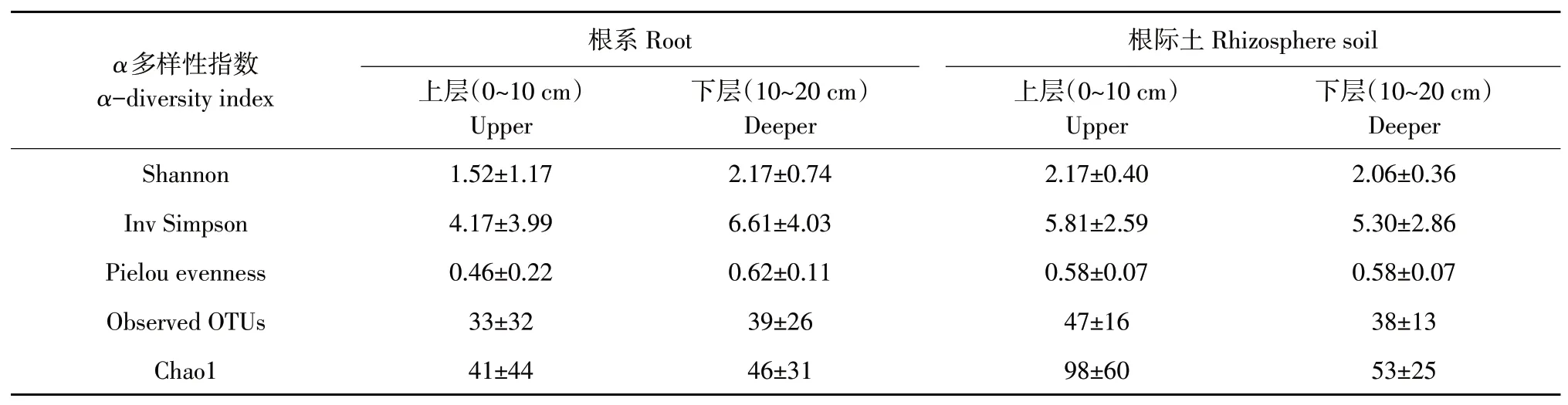
表4 引种地大花黄牡丹不同深度根系与根际土AMF多样性Table4 AMFdiversity of root and rhizospheresoil in different depth of P.ludlowii in introduction area
上层中根系AMF多样性指数均为根际土高于根系;在下层中,除Chao1外,其余多样性指数均为根际土低于根系,但均无显著差异(P>0.05)。
2.3.4 根际土与根系AMFβ多样性
分析引种地大花黄牡丹不同深度根系和根际土AMF群落之间差异性,基于Bray-Curtis距离NMDS分析如图9所示。根系与根际土AMF群落之间并无重合,说明根系与根际土AMF群落结构差异较大,不同深度根系或不同深度根际土群落间差异较小。上下两层根际土AMF群落重合度较高,上下两层根系中AMF群落也有部分重合。
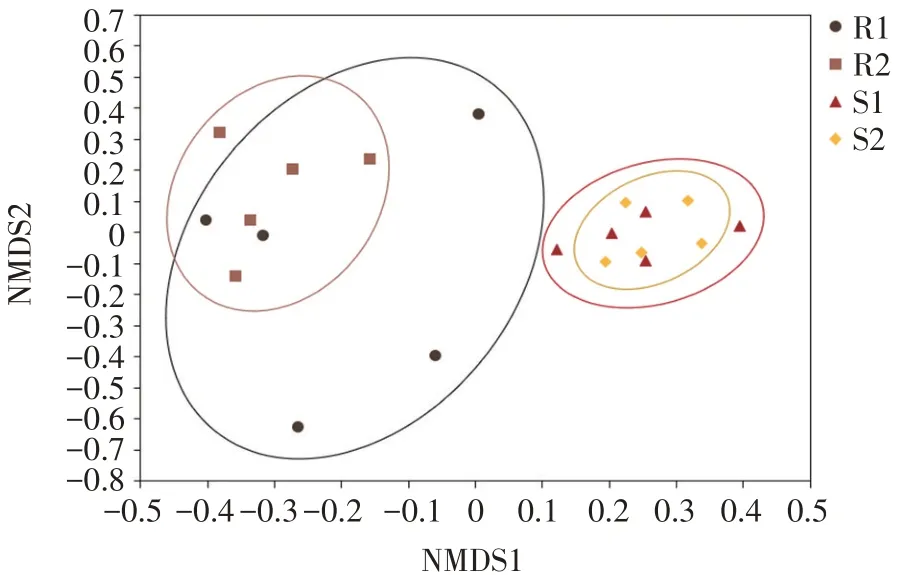
图9 引种地大花黄牡丹不同深度根系与根际土AMF群落结构NMDS分析Fig.9 NMDSanalysis of AMF community structure in root and rhizospheresoil in different depth of P.ludlowii in introduction area
2.4 根际微生物群落与土壤理化性质相关性
基于Bray-Curtis距离Mantel分析结果见表5,土壤pH与根际细菌群落显著相关(P=0.022);土壤有机质含量与AMF群落显著相关(P=0.032),速效钾含量与AMF群落显著相关(P=0.043),铵态氮含量与AMF群落极显著相关(P=0.009)。
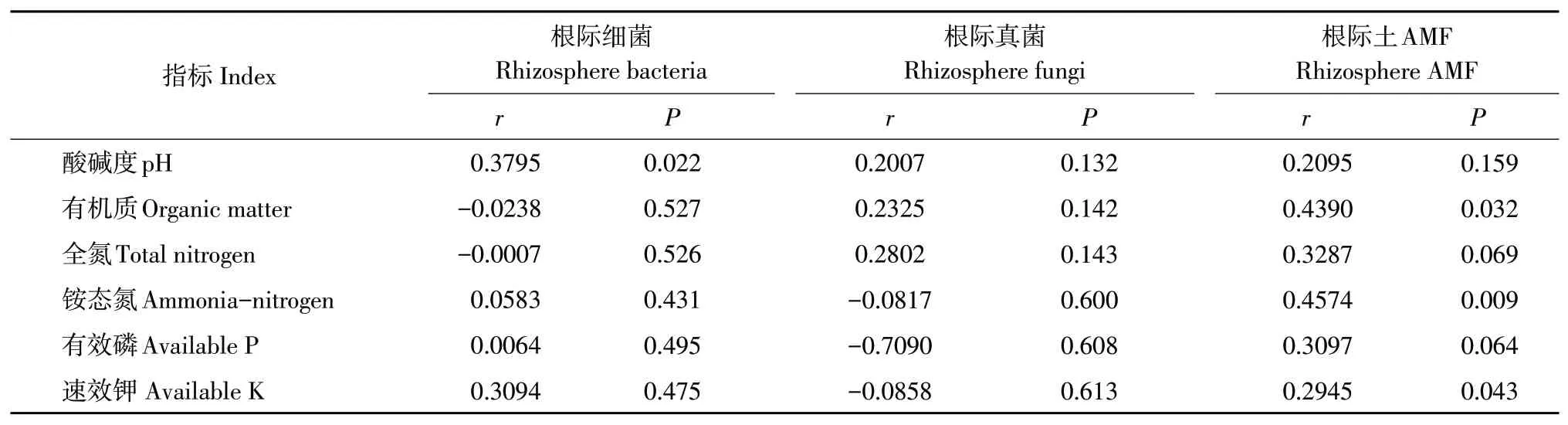
表5 土壤理化性质与根际微生物群落之间Mantel分析结果Table5 Mantel-test resultsbetween rhizosphere microbial community and chemical propertiesof soil
3 讨论与结论
3.1 大花黄牡丹根际细菌群落
Lu等在大花黄牡丹结果期调查其在原产地林芝根际细菌,将本文结果与其对比发现变形菌门、放线菌门和酸杆菌门是原产地和栾川引种地门水平上共有优势根际细菌类群,假单胞菌属是两地属水平上共有优势根际细菌类群[21]。本研究发现,引种栽培大花黄牡丹上层土壤根际细菌丰富度较高,与Lu等结果一致,且根际细菌在上层土壤中比下层具有更多特有种类,这可能与引种地大花黄牡丹吸收根在0~10 cm土层分布较多有关。
引种地根际细菌观测丰富度(1 797~1 937种)低于原产地(2 832~3 065种),两地相对丰度最高类群均为变形菌门,但其在引种地相对丰度(67.80%~71.18%)远高于原产地(21.2%~31.1%)[21],推测引种地根际细菌类群趋向单一化。作物生长发育、抗病性与其根际细菌群落有关,如‘凤丹’牡丹(P.ostii´Fengdan´)连作后,根际细菌群落多样性和部分细菌菌群相对丰度逐年降低,真菌群落多样性随种植年限增加先升后降,且群落结构变化显著[22-23]。而徐红梅等发现芍药(P.lactiflora)种植年限增加时,根际细菌多样性上升,且根际细菌和真菌优势种类变化均较小,并认为这可能是芍药不产生连作障碍的原因[24]。本文大花黄牡丹在引种地连续栽植近20年,且多年未追肥,土壤中N、P、K含量较低,生长已逐渐衰弱,这一趋势与引种地土壤根际微生物群落变化关系有待深入研究。本文发现引种地土壤pH与根际细菌具有显著相关性(P=0.022),今后可探讨调节土壤pH对大花黄牡丹根际细菌群落多样性的影响,以期为改善大花黄牡丹栽培管理措施提供指导。
3.2 大花黄牡丹根际真菌群落
对比禄亚洲等研究发现,栾川引种地与西藏原产地有共同根际土壤真菌优势类群,即子囊菌门和担子菌门,原产地土壤真菌标志性类群丛赤壳科(Nectriaceae)在引种地也有检出[25]。原产地大花黄牡丹根部内生真菌物种丰富,不同深度根际土真菌群落组成相似,且具有相似的丰富度和多样性。本研究也发现引种后大花黄牡丹不同深度根际真菌群落组成和结构相似,多样性指数(Shannon、Inv Simpson、Pielou evenness、Observed OTUs
和Chao1)在不同深度无显著差异。引种地具有与原产地相同的根际真菌类群及相似的真菌群落组成和结构,有助于引种后大花黄牡丹生长发育。从属水平上看,原产地根际真菌优势属为湿伞属(Hygrocybe)和被孢霉属[25],而栾川引种地优势属为被孢霉属和莫氏黑粉菌属,两地共同优势属为被孢霉属,这一结果为分析影响大花黄牡丹引种栽培后生长发育的关键根际微生物类群提供基础,今后需结合两地自然环境和大花黄牡丹不同发育阶段、生长季节等因素深入挖掘相关类群。
本研究发现引种地大花黄牡丹吸收根主要分布在上层,捕虫霉门、Aphelidiomycota、隐真菌门和蛙粪霉门等4门真菌也仅见于上层根际土,是上层根际土中特有真菌类群。引种地因疏于管理,土壤中N、P、K含量低,因此这4门真菌可能促进大花黄牡丹根系对水肥的吸收。
植物生长发育不同时期影响根际微生物群落组成[26],本文与Lu等均在大花黄牡丹果期取样[21],建议今后对比大花黄牡丹在原产地和引种地根际微生物研究中,两地取样时期保持一致。
3.3 大花黄牡丹根际土与根系AMF
我国芍药属根际微生物研究最初集中于AMF。郭绍霞调查栽培牡丹AMF种质资源,发现球囊霉属为中原牡丹品种群优势属[27],且将地表球囊霉(G.versiforme)和摩西球囊霉(G.mosseae)回接侵染‘凤丹’牡丹后,其耐盐性显著提高[28]。四川牡丹(P.decomposita)根际土中球囊菌门微生物相对丰度低于1%[29],但由于该研究对DNA扩增区域为真菌ITS区,对AMF类群可能无法充分扩增,四川牡丹AMF资源丰富程度有待进一步明确。本研究发现引种地大花黄牡丹根际存在广谱菌根真菌无梗囊霉属(Acaulospora),但相对丰度较低。任鸿雁发现卵叶牡丹(P.qiui)实生苗接种蜜色无梗囊霉(A.mellea)可促进其地上和地下部分生长并抑制Cu和Fe吸收[30]。后续可分析野生牡丹与栽培牡丹招募球囊霉属能力差异,分离引种地无梗囊霉属和球囊霉属菌株,回接、侵染引种植株,从中筛选有显著促生作用的AMF菌种。
原产地大花黄牡丹AMF多样性和群落结构尚未见报道。定殖于引种地大花黄牡丹根际土和根系中AMF优势类群相似,OTUs也有重叠,这是由于AMF被宿主植物招募后首先定殖于植物根际,进而进入根系内部,但根际土与根系AMF群落结构存在差异,上层根系内AMF群落更接近根际土AMF群落,可能与土壤环境与根内环境差异有关。本研究中,上层根际土AMF多样性高于下层,同时对AMF镜检结果表现为上层根围土AMF孢子密度和菌丝密度均高于下层。
本研究检测到大花黄牡丹根际土及根系中未分类微生物较多,其中AMF未分类属相对丰度最高,今后可深入分析并明确其分类地位,探索大花黄牡丹特有根际微生物种类,从这一角度阐明其狭窄的地理分布特征及濒危原因。
3.4 非微生物因素对大花黄牡丹引种栽培的影响
河南省洛阳市栾川县芍药科迁地保护圃是我国目前引种栽培大花黄牡丹数量最多的迁地保护圃。气候、土壤等自然环境适宜是其引种栽培较为成功的因素之一[12-13]。土壤理化性质与根际微生物群落相关,冯玮娜和彭培好发现四川牡丹根际土有机碳、氮、磷总质量分数等土壤理化性质影响不同生境四川牡丹根际土壤微生物群落组成和结构[29],与本文研究结果一致。本研究中,引种地土壤N、P、K等养分含量较低,而大花黄牡丹原产地林芝土壤养分丰富,有机质(>40.00 g·kg-1)、全氮(1.31~4.98 g·kg-1)、有效磷(27.82~94.38 mg·kg-1)和速效钾(50.59~311.36 mg·kg-1)含量均高于引种地[25],其中有效磷和速效钾含量远高于引种地。因此,加强大花黄牡丹引种栽植地土壤养分管理,有利于引种后根际土壤微生物群落定殖并形成与原产地相似的群落组成和结构,更好促进引种地大花黄牡丹生长。
本研究对河南栾川引种地大花黄牡丹根际微生物群落分析尚不足以深入阐明其引种前后根际微生物作用及对生长发育的长期影响,今后可关注栾川引种地与原产地共有根际微生物种类,以及其他引种地,特别是屡次引种大花黄牡丹但无法正常生长的种植圃情况,对比其与原产地及大花黄牡丹不同生长发育期根际微生物优势类群和环境影响因子,以期为大花黄牡丹引种、迁地保护和资源利用提供参考和依据。
4 结论
引种栽植地大花黄牡丹根际微生物资源丰富,细菌与真菌分别得到9 989与2 212个OTUs;根际细菌分属于26门67纲512属,变形菌门相对丰度最高;根际真菌分属于15门58纲712属,子囊菌门与担子菌门为优势类群。根系与根际土中共提取到116个AMF OTUs,分属于球囊菌门球囊菌纲的4目7科10属,近明球囊霉属与隔球囊霉属为优势类群;基于Bray-Curtis距离NMDS分析结果表明,根系和根际土AMF群落结构差异较大。根际细菌、真菌和AMF三类根际微生物在引种后不同深度土壤中,群落差异均不显著。土壤有机质含量、铵态氮含量、速效钾含量和pH与根际微生物群落存在显著相关。变形菌门、放线菌门和酸杆菌门是原产地和栾川引种地共有优势根际细菌类群,子囊菌门和担子菌门是两地共有根际土壤真菌优势类群。
