药蜀葵中总黄酮提取工艺优化及其生物活性研究
2022-03-30薛涛涛唐志书孙强胡晓慧阮凯华宋忠兴段金廒许洪波陕西中医药大学陕西中药资源产业化省部共建协同创新中心秦药特色资源研究开发国家重点实验室培育陕西咸阳72083南京中医药大学江苏省中药资源产业化过程协同创新中心江苏省方剂高技术研究重点实验室南京20023
薛涛涛,唐志书,孙强,胡晓慧,阮凯华,宋忠兴,段金廒,许洪波*(. 陕西中医药大学 陕西中药资源产业化省部共建协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西 咸阳 72083;2. 南京中医药大学 江苏省中药资源产业化过程协同创新中心,江苏省方剂高技术研究重点实验室,南京 20023)
药蜀葵(Althaea officinalis
),为锦葵科蜀葵属的多年生草本植物,其根、茎、叶和花均可入药,主要以根为主,收录于欧洲药典,主产于欧洲等地区,我国多为栽培品种,是药食两用植物,根入药有解表散寒、利尿止咳、消炎解毒的功效,作为茶饮可清喉利咽,还可作为观赏性植物栽培。现代药理实验揭示,药蜀葵提取物具有镇咳、抗炎、抗氧化、抗菌、免疫调节和降血糖等作用。国内外化学研究表明,药蜀葵富含黄酮、多糖和酚酸类成分,截至目前,从药蜀葵中共分离得到40余个化合物,其中17个黄酮类,7个酚酸类,3个香豆素类,1个甾体类,1个三萜类。药蜀葵作为民间药用植物,资源分布广泛,但是目前对于其基础研究比较薄弱,功效物质成分不明确,作用机制不清晰。迄今为止,尚未有对总黄酮提取工艺优化及相关生物活性的研究报道。本实验首次采用响应面法对药蜀葵茎叶总黄酮的提取工艺进行优化,首次采用D101大孔树脂对所得总黄酮进行了富集纯化;并进一步考察药蜀葵总黄酮的抗氧化活性及体外抑制α-
葡萄糖苷酶的活性,以期为药蜀葵总黄酮的开发利用提供参考。1 材料
1.1 试药
药蜀葵茎叶收集于永寿县监军镇陕西辉胜现代农业园区,经陕西中医药大学许洪波副教授鉴定为锦葵科蜀葵属植物药蜀葵(Althaea officinalis
)的茎叶。芦丁对照品(纯度≥97%,批号:H24N9Z75966)和维生素C(V,纯度≥99%,批号:J19O10R100374)(上海源叶生物科技有限公司);DPPH、ABTS(美国Sigma公司);阿卡波糖(纯度≥98%,批号:wkq20031707)、对硝基苯基-α
-D
-葡萄糖吡喃苷(纯度≥98%,批号:wkq20071504)(四川省维克奇生物科技有限公司);D-101型大孔吸附树脂(天津允开树脂科技有限公司);其他试剂(分析纯,天津市科密欧化学试剂有限公司)。1.2 仪器
Multiskan GO全波长酶标仪(Thermo Scientific,USA);UV-2600型紫外分光光度计(日本岛津公司);H-2型恒温水浴锅(北京科伟永兴仪器有限公司);TP-A2000型电子天平(福州华志科学仪器有限公司);EYELA N-1100旋转蒸发仪(东京理化器械株式会社);KQ-300 DE型超声波清洗器(昆山市超声仪器有限公司)。
2 方法与结果
2.1 样品前处理
药蜀葵茎叶样品置于通风阴凉处阴干后,将其剪碎后保存备用。
2.2 总黄酮含量测定
2.2.1 标准曲线的绘制 采用NaNO-Al(NO)-NaOH比色法测定总黄酮含量。用60%乙醇溶解芦丁对照品后制得0.2 mg·mL的对照品溶液。精确吸取不同体积对照品溶液(0.0、2.0、3.0、4.0、5.0、6.0、7.0 mL)于25 mL量瓶中,加5% NaNO溶液1.0 mL,摇匀静置6 min,加10% Al(NO)溶液1.0 mL,摇匀静置6 min,加4% NaOH溶液10.0 mL,60%乙醇溶液定容至刻度,摇匀静置15 min,于510 nm处测定吸光度(A
)值。以芦丁质量浓度(C
)为横坐标(X
),A
为纵坐标(Y
),绘制标准曲线并计算回归方程为:Y
=6.455X
+0.0452(r
=0.9990),表明芦丁在0.016~0.056 mg·mL与吸光度线性关系良好。2.2.2 样品溶液中总黄酮含量的测定 将提取液抽滤后滤液合并浓缩至约50 mL,转移至100 mL量瓶中,然后用60%乙醇定容至刻度,摇匀,作为样品溶液。精密吸取2 mL样品溶液于10 mL量瓶中,用60%乙醇定容至刻度,摇匀,即得供试品溶液。精密吸取0.5 mL供试品溶液,先后加入5% NaNO溶 液,10% Al(NO)溶 液 和4%NaOH溶液,用60%乙醇定容至刻度线,15 min后于510 nm处测定吸光度,根据标准曲线计算出测定稀释后样品溶液总黄酮浓度,计算提取率,提取率(%)=[黄酮的质量浓度(mg·mL)×稀释倍数×最初溶液体积(mL)/10]/原料质量(g)×100%。
2.3 单因素实验
准确称取10 g干燥的茎叶碎片,回流提取,分别考察提取次数(1、2、3、4次)、提取温度(50、60、70、80、90℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g/mL)、乙醇浓度(40%、50%、60%、70%、80%)和提取时间(1.0、1.5、2.0、2.5、3.0 h)对总黄酮提取率的影响。将供试品溶液按照总黄酮含量测定方法操作,根据标准曲线计算提取率,结果见图1。综合考虑时间和经济成本,选择提取次数为2次,料液比为1∶25,提取溶剂为50%乙醇,单次提取时间为2 h,提取温度为80℃。

图1 提取次数(A)、料液比(B)、乙醇浓度(C)、提取时间(D)和提取温度(E)对药蜀葵总黄酮提取率的影响Fig 1 Effect of extraction time(A),solid-to-liquid ratio(B),ethanol concentration(C),extraction time(D)and extraction temperature(E)on the yield of total flavonoids of Althaea officinalis
2.4 响应面实验
2.4.1 响应面实验设计 基于单因素实验结果,以总黄酮提取率为响应值,考察料液比(A)、提取时间(B)和乙醇浓度(C)三个因素,利用Design Expert 8.0软件根据Box-Benhnken实验设计原理设计并对相关数据进行分析,最后通过模型验证最佳提取工艺。实验设计因素及水平如表1所示,结果如表2所示,方差分析如表3所示。
表1 响应面分析因素及水平
Tab 1 Factor and level of response surface experiment
水平 因素A.料液比 B.提取时间/h C.乙醇浓度/%-1 1∶20 1.5 40 0 1∶25 2.0 50 1 1∶30 2.5 60
2.4.2 优化结果及分析 根据Box-Benhnken响应面实验结果,利用Design Expert 8.0软件对表2的数据进行多元回归拟合,得到总黄酮提取率Y
的函数:Y
=2.244-0.05875A
-0.0475B
-0.00875C
-0.0525AB
+0.04AC
-0.0425BC
-0.252A
-0.2345B
-0.182C
。表2 响应面实验设计及结果
Tab 2 Response surface design and experimental results
编号 A.料液比 B.乙醇浓度/% C.提取时间/hR.提取率/%1 1∶30 50 2.5 1.80 2 1∶20 60 2.0 1.84 3 1∶25 40 2.5 1.91 4 1∶30 40 2.0 1.78 5 1∶25 50 2.0 2.30 6 1∶20 40 2.0 1.87 7 1∶20 50 2.5 1.76 8 1∶25 40 1.5 1.80 9 1∶30 60 2.0 1.54 10 1∶20 50 1.5 1.90 11 1∶25 50 2.0 2.12 12 1∶25 60 2.5 1.77 13 1∶25 50 2.0 2.20 14 1∶25 60 1.5 1.83 15 1∶25 50 2.0 2.20 16 1∶25 50 2.0 2.40 17 1∶30 50 1.5 1.78
从表3可知模型的F
=9.290、P
<0.01,差异极显著;失拟项P
值为0.6815>0.05,无显著性差异,表明所选因素合理,不存在失拟因素;决定系数R
=0.9227和校正决定系数R
=0.8233表明实验模型拟合程度良好;变异系数为5.02%,说明模型的重现性较好,回归方程能够解释响应值的变异,实验方法可靠,可用于药蜀葵总黄酮提取工艺的条件优化。模型中一次项A
、B
和C
,二次项C
,交互项AB
、AC
和BC
对响应值的影响均不显著;二次项A
、B
(P
<0.01)对响应值的影响极显著,说明实验因素对响应值的影响是非线性关系。表3 方差分析结果
Tab 3 Analysis of variance
方差来源 平方和 自由度 均方和 F值 P值模型 0.780 9 0.087 9.290 0.0039 A 0.028 1 0.028 2.950 0.1296 B 0.018 1 0.018 1.930 0.2076 C 0.001 1 0.001 0.065 0.8055 AB 0.011 1 0.011 1.180 0.3138 AC 0.006 1 0.006 0.680 0.4357 BC 0.007 1 0.007 0.770 0.4089 A2 0.270 1 0.270 28.560 0.0011 B2 0.230 1 0.230 24.730 0.0016 C2 0.140 1 0.140 14.890 0.0062残差 0.066 7 0.009失拟项 0.019 3 0.006 0.540 0.6815纯误差 0.047 4 0.012总和 0.848 16 R2=0.9227 R2 Adj=0.8233
响应曲面图能够直观反映各因素对提取率的影响程度,坡度越陡峭,说明操作条件对响应值的影响越显著。如图2所示,料液比对药蜀葵总黄酮提取率影响最为显著,其次是乙醇浓度和提取时间。

图2 各提取因素之间的交互影响Fig 2 Different factors on the yield of flavonoids
2.4.3 最佳工艺条件及验证 通过对数据进行分析,得到药蜀葵的最佳提取工艺:提取次数2次,提取温度80℃,乙醇浓度49.135%、料液比1∶24.451、提取时间1.987 h,药蜀葵总黄酮提取率理论值为2.25%。由于实际操作的局限性,调整乙醇浓度为49.0%、料液比为1∶25、提取时间为2.0 h,其他条件不变,进行3次验证实验,得到药蜀葵总黄酮的平均提取率为2.15%,RSD
为0.50%,验证结果与模型预测接近,表明所建立模型可靠,最优工艺可行性高。2.5 总黄酮的富集和纯化
将最优工艺下的提取液减压浓缩至无醇味,吸附于预处理的大孔树脂色谱柱(D101,12 cm×85 cm),依次用水、70%乙醇洗脱,收集70%洗脱液浓缩为干浸膏,采用“2.2.2”项下方法进行黄酮含量测定。结果显示经过D101大孔树脂富集纯化后得到的药蜀葵总黄酮纯度达到53.62%。
2.6 体外抗氧化活性测试
2.6.1 DPPH活性测试 参考文献:精密量取100 μL不同浓度的样品溶液于96孔板中,加入0.1 mmol·LDPPH溶液100 μL,避光反应30 min(室温),于517 nm处测定吸光度值(A
),设置样品对照组A
(等量无水乙醇代替DPPH溶液),对照组A
(等量无水乙醇代替样品溶液),空白对照A
组(无水乙醇)和阳性对照组(V)。平行操作3次,计算清除率,清除率(%)=[1-(A
-A
)/(A
-A
)]×100%。2.6.2 ABTS活性测试 将7.4 mmoL·LABTS溶液和2.6 mmoL·L过硫酸钾溶液按1∶1混合,于室温避光放置过夜后得到ABTS母液,稀释母液至(0.7±0.02)(A
),即得ABTS工作液。精确量取不同浓度的样品溶液50 μL于96孔板中,加入150 μL ABTS工作液,摇匀,静置6 min,于734 nm处测定吸光度值。设置样品对照组、对照组、空白对照组和阳性对照组(同DPPH法),平行操作3次,清除率计算同DPPH法。结果如图3A、3C所示,药蜀葵总黄酮在测定的浓度范围内对DPPH、ABTS自由基的清除具有浓度依赖性。其IC
值分别为(8.36±0.06)μg·mL、(8.45±0.14)μg·mL。阳性对照V的测试结果如图3B、3D所示,V在2.0~15.6 μg·mL内对DPPH自由基的清除能力与浓度呈线性关系,其IC
值为(6.40±0.31)μg·mL;在0.5~3.9 μg·mL内对ABTS自由基的清除能力与浓度呈线性关系,其IC
值为(2.77±0.09)μg·mL。
图3 药蜀葵总黄酮和阳性对照VC对DPPH(A,B)和ABTS(C,D)自由基清除能力Fig 3 Scavenging effect of flavonoids and VC to DPPH(A,B)and ABTS(C,D)free radical
2.7 体外抑制α-葡萄糖苷酶活性测试
本研究采用酶标仪微量法作为药蜀葵富集纯化后总黄酮体外抑制α
-葡萄糖苷酶活性的检测手段。实验所用的缓冲溶液、底物溶液和酶液的配制方法参照文献,具体步骤简述如下:精密称取药蜀葵富集纯化后总黄酮适量,用PBS缓冲溶液配制成不同浓度的样品溶液。将50 μL样品溶液,100 μL 0.1 U·mLα-
葡萄糖苷酶溶液(用pH 6.9,0.1 moL·LPBS配制)依次加入到96孔板中,25℃下孵育5 min,立即加入5 mmoL·L底物(对硝基苯基-α
-D
-吡喃葡萄糖溶液)50 μL启动反应,25℃下孵育5 min,孵育前后,记录405 nm处吸光度值。本实验设置样品组A
(加样品、底物和酶液),酶组A
(用PBS代替样品),阳性对照组(阿卡波糖),平行操作3次,计算抑制率,抑制率(%)=[(△A
-△A
)/△A
]×100%。药蜀葵作为传统的药食两用植物,其具有明确的降血糖功效。基于此,作者对药蜀葵总黄酮进行了α-
葡萄糖苷酶抑制活性测试。结果如图4,药蜀葵总黄酮在测试浓度范围(7.8~250.0 μg·mL)对α
-葡萄糖苷酶具有明显的抑制作用且呈现浓度依赖性,其IC
值为(76.63±1.12)μg·mL,抑制作用强于阳性对照阿卡波糖[IC
值为(323.43±7.06) μg·mL]。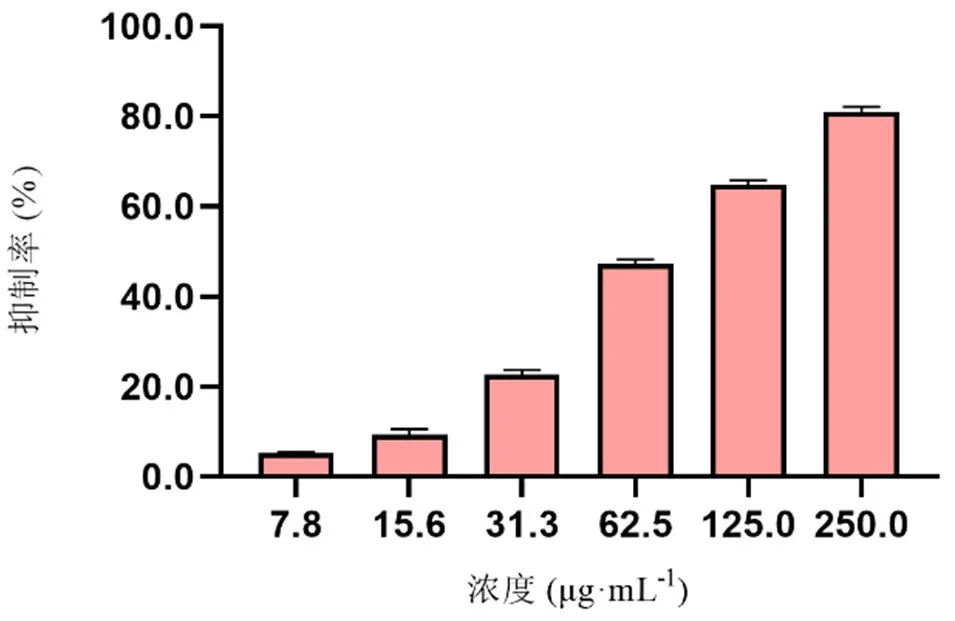
图4 药蜀葵总黄酮抑制α-葡萄糖苷酶量效关系Fig 4 Dose-effect relationship for total flavonoids of Althaea officinalis inhibiting α-glucosidase
3 讨论和结论
本研究首次利用响应面法设计优化得到药蜀葵总黄酮的最佳提取工艺条件:提取次数2次,提取温度80℃,料液比为1∶25,提取时间2.0 h,乙醇浓度49.0%,在该条件下预测提取率为2.25%,实际提取率为2.15%,预测值与测定值相符,表明优化的工艺可靠。由于经过最优提取工艺得到的是含有药蜀葵总黄酮的粗提物,且提取率较低,因此需要对粗提物进一步的富集纯化,以便后续的活性研究。D101大孔树脂是分离纯化总黄酮应用较为广泛的非极性大孔树脂;基于后续药蜀葵总黄酮工业化大生产的考虑,本研究选择D101大孔树脂进行富集纯化,其总黄酮纯度达到53.62%。
许多疾病的发生与氧化有着密切的关系,其中自由基引发的氧化会导致机体衰老。摄入抗氧化物质能够降低自由基对机体的氧化损伤。DPPH自由基和ABTS自由基是表征物质抗氧化活性实验中应用最为经典的模型。本研究结果表明,药蜀葵总黄酮对DPPH自由基和ABTS自由基均具有显著的清除作用,特别是清除DPPH自由基的能力与阳性对照V相当。经过本研究富集纯化所得的总黄酮抗氧化能力显著,可为开发天然高效的抗氧化物质提供思路。
糖尿病是严重威胁人类健康的三大疾病之一。持续性高血糖会引发一系列并发症,如心血管疾病等。有效控制餐后血糖上升是防治疾病发生的必要措施。α
-葡萄糖苷酶作为降低餐后血糖的有效分子靶标,在碳水化合物转变为葡萄糖的过程中至关重要。目前临床常用药物如阿卡波糖等,虽然降血糖作用显著,但长期服用会引起多种不良反应,甚至产生耐药性。因此,亟待寻找和开发新的α-
葡萄糖苷酶抑制剂。相较于阿卡波糖,本研究首次发现富集纯化得到的药蜀葵总黄酮抗α-
葡萄糖苷酶活性显著,其IC
值为(76.63±1.12) μg·mL。本研究结果可为药蜀葵中总黄酮的开发利用提供参考。