基于混合电位的锌冶炼除钴过程动力学建模方法
2022-03-29梁壹厅阳春华朱红求孙备
梁壹厅,阳春华,朱红求,孙备
(中南大学自动化学院,湖南长沙,410083)
世界上80%的锌由焙烧—浸出—净化—电解工艺生产[1]。浸出工艺产生的中性上清液中含有钴、镍、锑、镉、铜等杂质元素,这些杂质在电解过程中与锌共沉积,造成产品纯度下降,严重时会出现阴极“烧板”现象,因此,必须通过净化把这些杂质浓度降低至合理范围。为了不引入新的杂质,通常采用锌粉置换的方法净化除杂,在使用较少锌粉和较低的温度下,铜、镉、砷、锑等离子可以迅速沉积,但由于锌粉“钝化”和超电压现象存在,单独添加锌粉置换除钴十分困难[2-3]。铜锑、铜砷等正电性金属盐类添加剂常被用于净化除钴过程,以抑制钝化和超电压现象,加速钴的沉积[4]。
除钴过程受pH、铜锑添加量等多种因素影响,且离子浓度在线采样困难,数据少,较难构建过程机理模型,给除钴过程的优化控制造成了较大困难。为实现除钴过程优化控制,必须研究除钴过程的机理与反应动力学模型[5]。VAN DER PAS等[6]研究了铜锑联合催化除钴的机理,认为铜和锑在钴沉积之前就已经在锌粉表面沉积完全,为除钴反应提供了电化学反应所需的电极基质。POLCARO 等[7]针对扩散控制的锑盐除钴过程,建立了描述锌粉面积和反应速率关系的除钴反应动力学模型。曾桂生[8]从电化学角度探讨了除钴反应速率,并通过实验研究了锑盐添加量、pH 等对除钴速率的影响,提出了除钴过程的一阶动力学模型。MINDOWIZC 等[9]认为高pH 下氢氧化锌生成并吸附在锌粉表面阻碍离子扩散,是造成含锌离子溶液中锌粉置换除钴过程终止的主要原因。谢刚等[10]则通过热力学分析认为锌离子的水解沉积是锌粉钝化的主要原因,锑的催化作用来自钴在锑表面上更大的电动势和平衡常数。KARLSSON等[11]对铜锑催化除钴过程钝化产物进行了分析,认为钝化产物可能是Zn(OH)2和ZnSO4。郭忠诚等[12]认为除钴过程动力学属于化学反应步骤控制的过程,同时pH也对除钴速率有较大影响,合适的净化除钴反应pH为3.8~4.5。温度也是影响除钴过程的重要因素[13],研究显示部分除钴反应过程被化学反应步骤控制,温度越高,反应速度越快。LEW等[14]对铜锑联合催化除钴过程进行了大量实验,研究了铜锑浓度、pH、温度、锌粉添加量和锌粉粒径等因素对除钴速率的影响,获取了大量动力学数据。KRAUSE 等[15]对砷盐除钴过程中锌粉用量、晶种和温度等因素的影响进行了研究,提出了关联温度的除钴速率一阶反应动力学模型。RAO等[16]研究了锌粉粒径对混合了Cu,Cd,Ni和Co离子的硫酸锌溶液净化除杂的影响,发现锌粉粒径较小可显著提高除钴速率,同时还发现在较低温度条件下,可以完全除去Cu,Cd和Ni离子,但是只有14%的Co被沉积。LU等[17]同样对硫酸锌溶液中添加锌粉净化Cu,Cd,Ni 和Co 离子的过程进行了研究,发现氢离子消耗了超过61%的锌粉,在pH较低或锌粉初始添加量较小时,氢离子消耗锌粉导致混合电位下降,进而造成钴返溶。
SUN 等[18]将砷盐除钴过程归纳为发生在Zn-MeAs(Me=Co,Cu,Ni)微电池上的电化学置换过程,并认为阴极反应和阳极反应是在微电池混合电位控制下相互独立的反应,提出了基于混合电位、晶种浓度的钴离子置换反应一阶电化学动力学模型。LI等[19]给出了基于锌粉面积共享的除钴过程竞争反应动力学模型,并基于生产数据辨识了模型参数,提出了基于动态模型的除钴过程最优控制策略。
锌粉置换除钴是发生在微电池上的电化学过程,各反应物通过影响微电池电极面积、电极活性以及电极电位影响除钴速率和除钴深度,然而,当前模型对这一电化学反应机制的描述仍不够深入。如SUN 等[18]建立的模型只考虑了混合电位对除钴速率的影响,而未考虑pH的影响,该模型无法模拟低pH对除钴速率的影响。另外,现有模型也没有考虑pH 过高条件下锌粉发生钝化的情形。同时,铜、锑2种催化剂的添加量、比例对除钴速率的影响,也未有定量模型描述。在实际生产过程中,净化环节中的pH和铜添加量随上一生产工序的生产波动往往存在较大起伏,而现有除钴过程动力学模型无法反映pH和铜锑添加量对除钴效果的影响,这制约了除钴过程生产优化控制水平的进一步提升。
本文的主要目的是基于混合电位建立一套完整地描述除钴过程的机理动力学模型。本文作者基于电化学动力学原理构建立钴、铜、锑和氢离子的反应速率方程,引入饱和函数描述铜锑浓度对除钴反应速率的影响,基于微电池等电位假设建立混合电位方程,并引入水解方程和吸附方程剖析pH 的演化机制;在反应动力学模型的基础上,基于物质守恒原理建立批式实验条件下的状态空间方程;最后,基于现有铜锑除钴实验数据辨识模型参数,并通过仿真分析对模型与实验结果进行定量和定性比较,以验证模型的有效性。
1 铜锑催化除钴过程机理分析
在湿法炼锌过程中,锌矿焙烧并溶解后形成硫酸锌溶液,经净化后进入电解工序,电解得到纯锌产品。但焙烧溶解后的硫酸锌溶液中通常含有铜、钴、镍等杂质离子,其中钴离子最难去除,且对锌电解过程影响最大,过多的钴离子会造成锌电解过程电流效率急剧下降。因此,除钴过程是湿法炼锌净化工序中的核心环节。
除钴过程由于超电压现象的存在,在不加任何催化剂的情况下,析氢反应会干扰钴离子与锌粉之间的电子传递,使杂质钴离子难以被去除。为此,一般会向钴溶液中加入具有正电性的金属盐类作为催化剂,铜离子是湿法炼锌中的主要杂质离子之一,也是除钴过程的天然催化剂,但是单独的铜离子催化作用有限,还需要与锑、砷盐等配合使用。在铜锑联合催化除钴中,铜和锑在钴沉积之前已经完全沉积并附着在锌粉表面,提供除钴电化学反应所需的电极基质,配合加速钴的沉积[6-7]。另外,在无铜离子的情况下,锑也可以单独与钴发生共沉积,加速钴的沉积,但其效果没有与铜联合使用的效果明显[14]。一般认为,在铜锑催化除钴中,除钴反应是发生在由锌-铜-锑构成的微电池表面的原电池反应,其原理如图1所示[14]。

图1 除钴过程微电池反应原理Fig.1 Micro-battery reaction mechanism of cobalt removal process
铜、锑先在锌粉颗粒表面沉积,形成一层锑活化的电极反应表面,然后,钴离子在这个表面上获得电子,发生置换沉积,而同时锌粉失去电子溶解。但这个过程会受到氢离子析出反应的干扰,氢也同样在电极反应表面上析出,降低了钴的沉积速率,这在低pH条件下(pH≤3)尤为明显[14]。不仅如此,过高的pH会造成锌离子水解沉积吸附在锌粉表面,阻碍锌、钴离子的扩散,从而抑制锌置换除钴的过程,也就是所谓的锌粉“钝化”现象[3,9]。
本文作者认为在铜锑催化除钴过程中,影响除钴速率的主要有2类反应:1)电化学反应;2)锌离子的水解和Zn(OH)2吸附反应。
1.1 电化学反应
电化学反应发生在如图1 所示的以锌为基质、铜锑快速置换沉积覆盖在锌颗粒表面所形成的反应微电池上,包含以下4个电化学反应:
Cu2++Zn→Cu+Zn2+
2Sb3++3Zn→2Sb+3Zn2+
Co2++Zn→Co+Zn2+
2H++Zn→H2+Zn2+
这4个反应实际上以5个可逆半电池反应的形式进行。
(R1):Zn2++2e-↔Zn
(R2):Sb3++3e-↔Sb
(R3):Cu2++2e-↔Cu
(R4):Co2++2e-↔Co
(R5):2H++2e-↔H2
反应(R1)~(R5)均与除钴反应速率高度相关。在实际除钴过程中,锌半电池反应(R1)的实际方向是从右至左,负责提供铜锑和钴离子置换所需的电子;铜和锑离子通过置换半电池反应((R2)与(R3))快速沉积在锌粉颗粒表面,形成微电池,铜提供除钴所需的电极基质,而锑则提供了钴沉积的活化点位,增大除钴反应速率;钴离子通过钴置换半电池反应(R4)置换沉积;而氢离子通过氢析出反应(R5),一方面与钴竞争电子,降低了除钴速率,另一方面,若反应(R5)过快,溶液pH 过高,则锌离子会形成Zn(OH)2吸附在锌粉表面,造成锌粉钝化失效,除钴终止。
1.2 锌离子的水解和Zn(OH)2吸附反应
在氢被锌粉置换析出的过程中,锌离子的水解产生的氢离子补充了被置换的氢离子,起到了缓冲作用,减缓了pH上升的趋势,从而影响除钴速率。锌离子水解反应表达式为
(R6):Zn2++2H2O→Zn(OH)2+2H+
锌水解生成的氢氧化锌吸附在锌粉上造成锌粉“钝化”,进而导致除钴反应终止。然而,目前还无法最终确定氢氧化锌吸附造成锌粉钝化的过程中生成的最终产物,故无法确定氢离子参与钝化过程反应的阶次,进而无法确定pH对吸附钝化过程的影响机制。因此,本文假设氢离子参与吸附锌离子水解和吸附钝化的总化学计量系数为n,并用一个虚拟的锌吸附结合体ZnwZn(OH)n(2-n)来模拟锌粉钝化后的产物,吸附反应表达式为

式中:w为化学计量系数。1 mol Zn(OH)2可覆盖wmol锌粉,形成锌吸附结合体ZnwZn(OH)n(2-n),造成锌粉“钝化”。n越大,pH 对该反应的影响越大。
2 铜锑催化除钴过程动力学建模
本文建模所用数据来自文献[14]中铜锑除钴批式实验,其实验装置为批式搅拌反应器,如图2所示,反应器体积为4 L,搅拌转速为700 r/min,反应温度为73 ℃。反应溶液中主要成分为ZnSO4,同时按照各实验设计一次性加入定量的铜、锑和钴离子。锌粉在反应初始阶段一次性加入。在实验过程中,每隔5~15 min取样1次,测量钴离子浓度和pH。
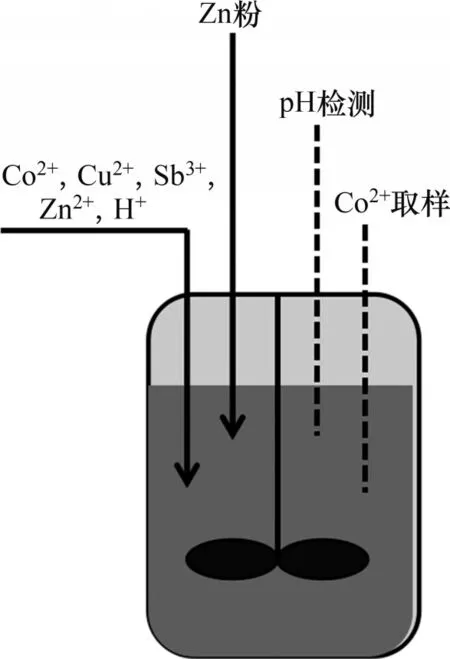
图2 批式除钴反应装置[14]Fig.2 Batch stirred reactor for cobalt removal experiment[14]
首先建立除钴过程各反应的反应方程和动力学方程,然后基于物质守恒原理,联立反应动力学方程,建立实验所用批式反应器的状态空间模型。
2.1 除钴反应动力学
基于电化学原理、铜锑催化除钴机制、水解和吸附反应原理对除钴过程中涉及的反应进行建模。
2.1.1 除钴过程电化学反应动力学
基于半电池反应(R1)~(R5),结合对微电池电势分布的分析,建立除钴过程中电化学反应动力学方程以及混合电位方程。
1)锌、铜、锑置换反应动力学。
根据原电池反应原理,假设微电池反应总面积与单质锌浓度成正比,则锌溶解半电池反应(R1)的反应速率r1为
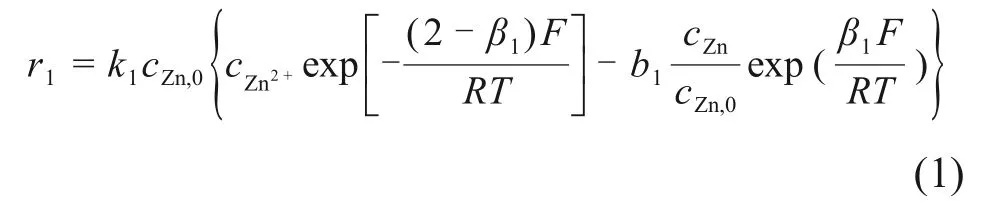
式中:cZn,0为单质锌初始浓度,mol/L;cZn2+为锌离子浓度,mol/L;cZn为锌单质浓度,mol/L;k1为反应(R1)的速率常数;b1为反应(R1)的平衡常数;β1为反应(R1)的阳极传递系数;F为法拉第常数,96 485 C/mol;R为气体常数,R= 8.314;T为反应温度,本文中T= 346 K。
假设铜锑置换沉积过程为扩散控制的反应过程,除钴过程中锑置换反应(R2)的反应速率r2为
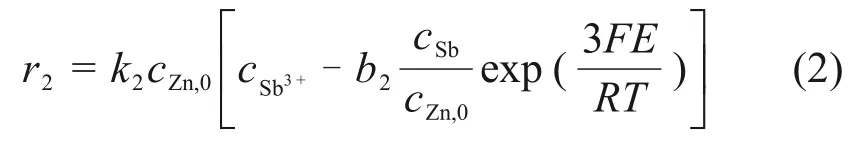
式中:cSb3+为锑离子浓度,mol/L;cSb为锑单质浓度,mol/L;k2为反应(R2)的速率常数;b2为反应(R2)的平衡常数;E为电池表面与溶液间的混合电位。同样,铜置换半电池反应(R3)的反应速率r3为

式中:cCu2+为铜离子浓度,mol/L;cCu为铜单质浓度,mol/L;k3为反应(R3)的速率常数;b3为反应(R3)的平衡常数。
2)基于饱和函数的铜锑催化除钴速率方程。
假设钴的置换过程为化学反应步骤控制的电化学过程,且参与反应的电子数均为2,则钴置换反应(R4)的反应速率r4为

式中:cCo2+为钴离子浓度,mol/L;cCo为钴单质浓度,mol/L;k4为反应(R4)的速率常数;b4为反应(R4)的平衡常数;α4为反应(R4)的阴极传递系数。置换反应发生在锑活化的铜电极表面上,其反应速率与铜锑浓度有关,一般认为铜提供了除钴反应的电极基质,而锑则作为活化因子发挥作用[14]。本文作者认为微电池上铜的催化效应仅与铜锌浓度比有关,而锑的活化作用仅与锑锌浓度比、锑铜浓度比有关。另外,铜或锑单独使用时均可提高钴置换沉积速率,但效果不明显,只有当铜锑联合使用时,除钴速率才会显著上升,同时,过量添加铜或锑对除钴速率没有影响,因此,这里以铜锌浓度比、锑铜浓度比为输入变量,采用饱和函数分别建模钴沉积反应(4)的速率常数和铜锑浓度的关系:
式中:k4为除钴反应速率常数;cCu,csb和cZn,0分别为溶液中的铜浓度、锑浓度和锌浓度,mol/L;sCuSb,1,sCuSb,2,sSb和sCu为饱和函数的饱和参数;k4,CuSb,k4,Sb,k4,Cu和k4,0为饱和函数的比例参数;kCo,0为钴一阶反应速率标准值;k4,0为不添加铜锑催化剂时的除钴速率;和sCu)-1分别代表铜锑联合催化、锑单独催化、铜单独催化时的除钴速率增益。
3)氢析出反应动力学。
假设氢析出反应为发生在微电池表面,2电子参与的电化学过程,其反应速率r5为
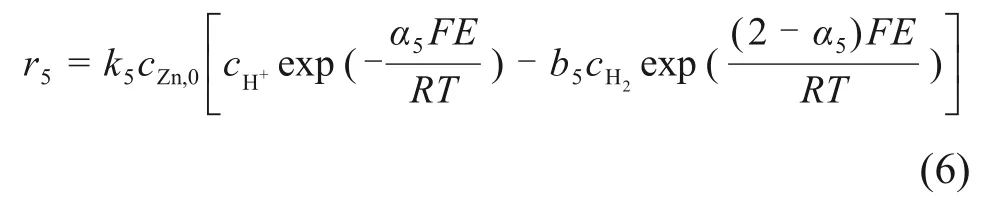
式中:cH+为氢离子浓度,mol/L;cH2为氢单质浓度,mol/L;k5为反应(R5)的速率常数;b5为反应(R5)的平衡常数;α5为反应(R5)的阴极传递系数。
4)混合电位方程。
除钴反应发生在锌-铜-锑组成的微电池表面,电池表面与溶液之间的电势差(电位)是电化学反应的主要推动力。为模拟微电池电化学反应过程,需要对微电池上的电势分布进行简化,为此,引入微电池等电位假设:由于反应微电池的直径非常小(一般除钴所用锌粉颗粒粒径小于150 μm),而锌、铜、锑等又具有良好的导电性,因此,假设微电池上表面不同区域间不存在对反应有影响的电势差的区别,可以统一用一个混合电位E来描述。根据原电池双电层原理,混合电位变化率与电化学反应电流之间的关系为

式中:C为原电池双电层电容常数。当C足够小时,充放电过程可以忽略,式(7)可近似为

式(8)意味着此时氧化电流(失去电子)和还原电流(得到电子)的绝对值相等,即反应体系中的电子总数时刻保持恒定。由式(1)~(6)可知,式(8)是关于混合电位E的非线性等式方程,据式(8)即可在已知参与电化学反应的各反应物浓度的情况下获得混合电位。结合式(1)~(6)可定量计算pH,铜、锑等离子浓度对微电池混合电位E的影响,而混合电位E可通过式(4)得出除钴置换反应速率,进而得出除钴速率和最终除钴深度。
2.1.2 锌离子水解反应动力学
根据水解反应动力学,将锌离子的水解反应(R6)的反应速率描述为
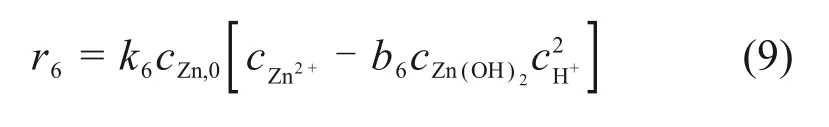
式中:cZn(OH)2为Zn(OH)2的浓度,mol/L;k6为反应(R6)的速率常数;b6为反应(R6)的平衡常数。
2.1.3 Zn(OH)2吸附反应动力学
基于吸附反应方程(R7),将Zn(OH)2的吸附反应速率描述为

式中:cZnwZn(OH)2为锌吸附结合体的浓度,mol/L;k7为反应(R7)的速率常数;b7为反应(R7)的平衡常数。
2.2 批式反应器状态空间模型
与一般的化学反应过程建模中将离子浓度取为状态量[16]的方式不同,本文将每个反应的累积量取为状态量,可得状态空间方程:

式中:ri为反应(Ri)的反应速率;xi(t)为反应(Ri)的累积反应浓度,mol/L。将反应动力学方程代入式(11)及式(8),可得

由物质守恒原理,式中各反应物或生成物的浓度可由各反应的累积反应浓度xi(t)计算:
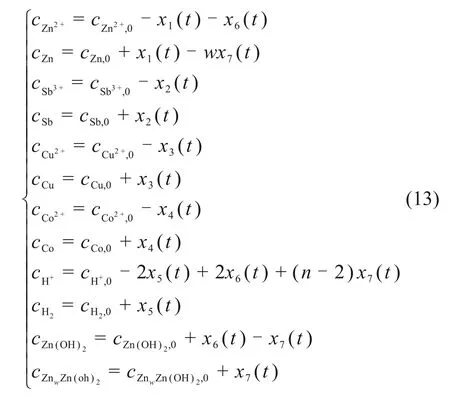
式中:cM,0,M = Zn2+,Zn,Sb3+,Sb,Cu2+,Cu,Co2+,Co,H+,H2,Zn(OH)2,ZnwZn(OH)2为反应物M的初始浓度。
式(12)和式(13)构成了图2 所示批式实验过程的状态空间模型。注意到这里面有等式约束混合电位方程,因此,该动力学模型为微分代数方程组(DDE)。另外,式(12)将每个反应的累积量取为状态量,然后结合式(13),只需要7 个状态量(xi,i= 1,…,7)即可表征除钴反应涉及的所有反应物的浓度,减少了模型求解所需的计算量。
3 除钴机理模型参数辨识
3.1 参数辨识
基于文献[14]中16组不同初始条件下的批式锑盐除钴t-cCo2+和t- pH 关系,构造最小二乘参数辨识优化目标,辨识模型参数,验证模型的有效性。通过数值实验发现,以下参数在一定范围内波动对模型钴离子、氢离子浓度输出影响不大,给定参数值如下:

理想气体常数、温度和法拉第常数则为已知参数:R= 8.314,T= 346 K,F= 96 485C/mol。
重要且待辨识的参数向量为
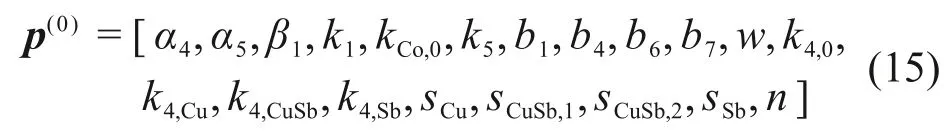
由于反应速率参数以及水解平衡常数的数量级波动极大,因此,本文将p(0)中部分反应速率参数和水解平衡参数对数化,得实际辨识的参数向量为
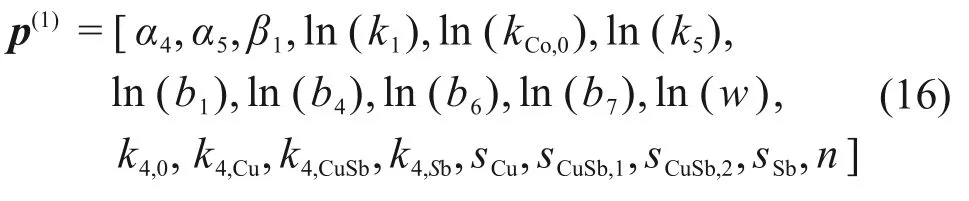
由于式(12)与式(13)中混合电位方程和水解、吸附方程具有高度非线性,且各化学反应特征反应时间相差较大,极易由于参数不合理取值造成动力系统刚性过强而无法数值求解,为此,本文经过大量预先仿真实验,确定参数寻优的取值范围为

优化采用PSO算法,种群数取500,迭代次数取200,取值范围为[]。对于正整数变量n,其优化取值范围设为[8,12],并在求解状态空间方程过程中四舍五入取整。由于系统在参数寻优区间内具有强刚性,本文在动力学模型积分求解计算的过程中使用了Matlab 中的刚性微分代数方程组求解器ode15 s,并限制单次求解微分代数方程组的最小时间步长为1× 10-8min,以防止算法在刚性过强的参数上消耗太多时间。经过53 h迭代计算,得到的模型参数取值为

钴离子浓度模型拟合值与实验值对比见图3。模型拟合钴离子对数比浓度(ln(cCo2+,0/cCo2+))与实验动态曲线对比见图4。由图3 和图4 可见:模型对钴离子浓度的拟合效果较好,平均相对误差为9.73%。

图3 钴离子浓度模型拟合值与实验值对比Fig.3 Comparing of model-fitted and experimental cobalt concentration values

图4 模型拟合钴离子对数比浓度[ln(cco2+,0/cco2+)]与实验动态曲线对比Fig.4 Comparing of model-fitted and experimental dynamical cobalt concentration curves
对文献[14]的pH输出值的拟合结果见图5,部分实验的模型拟合pH 动态曲线和实验pH 动态曲线的对比如图6 所示。由图5 和图6 可见:模型对pH 的拟合效果远不如对钴离子浓度的拟合效果好(平均相对误差为18.7%)。pH的演化过程具有高度不确定性,因此,建模误差较大。但本文所提模型依然对t-pH 曲线的规律进行了较准确定性,即初始段pH快速上升,后半段因为锌离子基于反应(R6)~(R7)不断补充氢离子,氢离子的表观反应速率常数远比实际氢置换反应常数小,因此,20 min后,t-pH曲线的斜率远比初始段的斜率小。
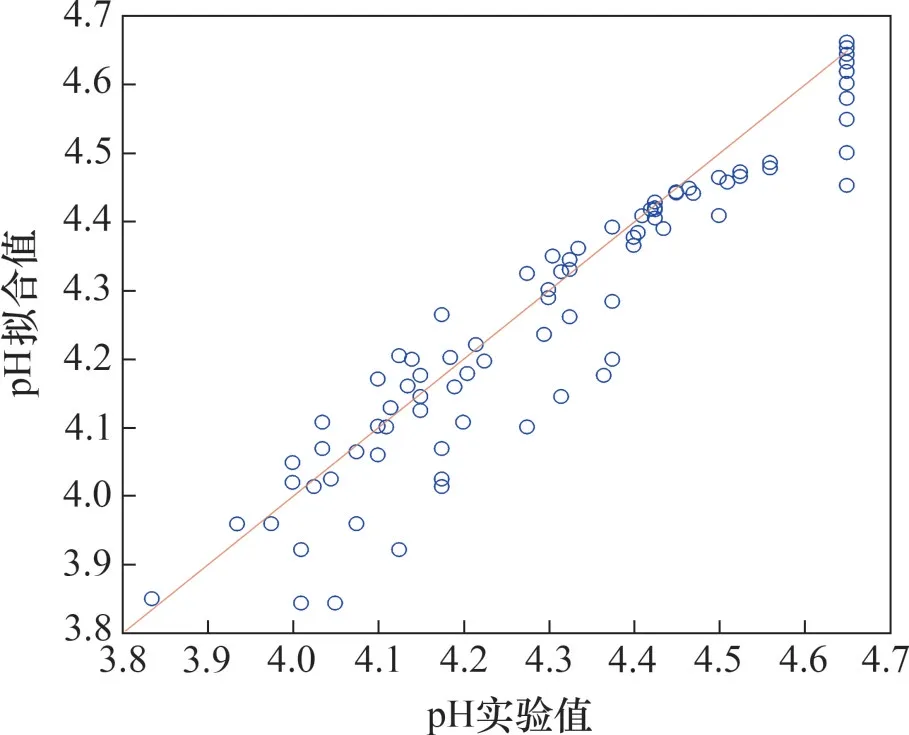
图5 模型拟合pH和实验值对比Fig.5 Comparing of model-fitted and experimental pH values

图6 模型拟合pH和实验值[14]动态曲线对比Fig.6 Comparing of the model-fitted and experimental dynamical pH curves
3.2 仿真和分析
首先进行标准初始反应条件下的仿真实验。在标准仿真实验中,Cu,Sb,Co,H2,Zn(OH)2,ZnwZn(OH)n(2-n)的初始浓度均为0 mol/L,初始pH为3.8,其余离子初始浓度为cZn2+,0=2.23 mol/L,cCu2+,0=7.19×10-4mol/L,cSb3+,0=1.23×10-5mol/L,cCo2+,0=4.41×10-4mol/L,cZn,0=0.061 5 mg/L。标准仿真实验中混合电位和部分离子浓度变化轨迹见图7。由图7可见:初始段电位随Cu2+,Sb2+的快速置换沉积而下降(0~10 min),然后进入平稳阶段(10~90 min);在电位平稳阶段,钴离子浓度不断置换沉积,与此同时,单质锌浓度变化很小,因为锌粉过量,反应消耗掉的锌粉只占总锌粉的一小部分。
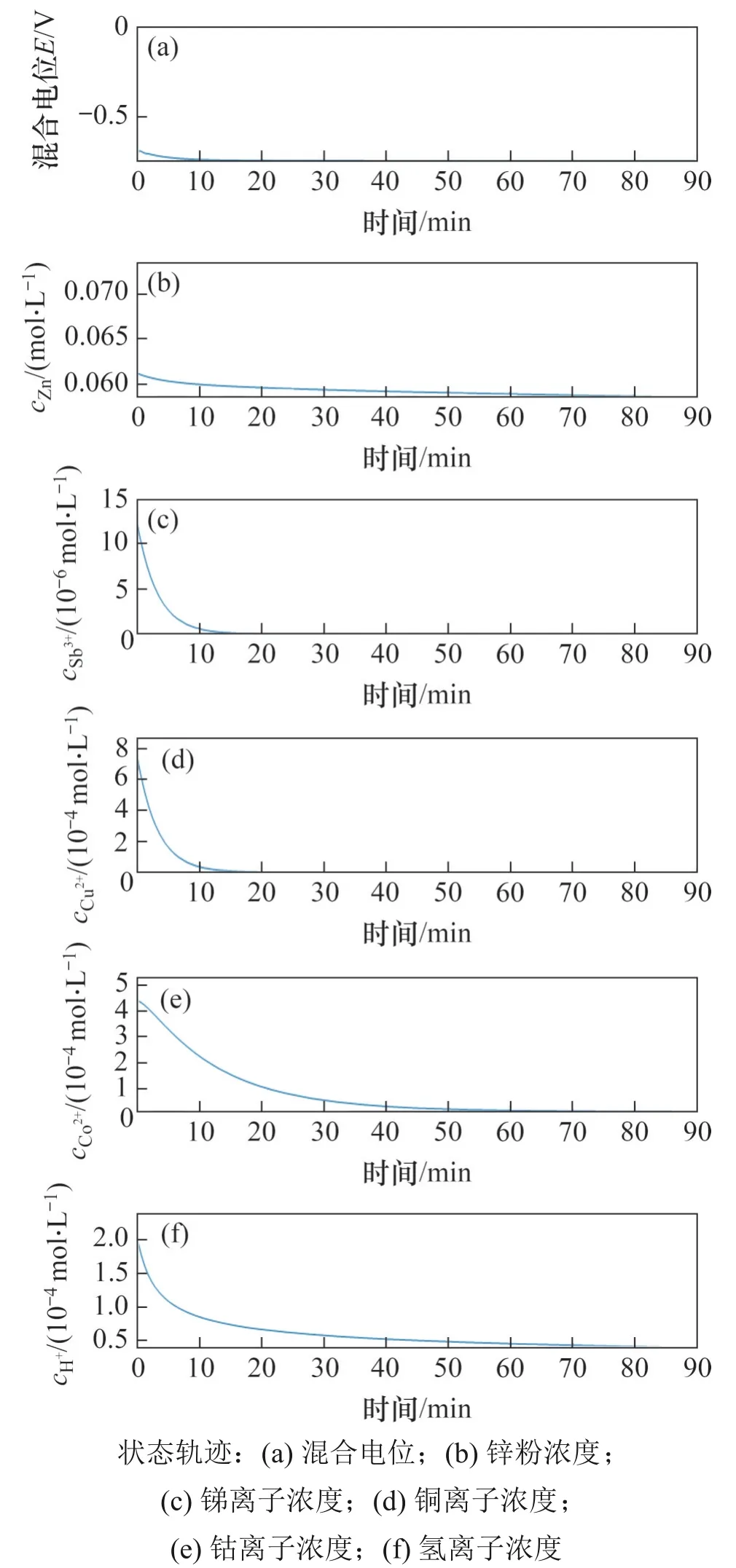
图7 标准试验条件下除钴过程离子浓度变化Fig.7 Variations of ion concentrations of cobalt removal process simulated at standard condition
图8 所示为pH 受控条件下的除钴过程动态模拟仿真结果,并与自然pH(pH 不受控)条件下的除钴动态曲线进行了比较。在恒定pH实验中,氢离子浓度在仿真过程中始终保持不变。由图8 可见:在低pH 条件下,氢离子会与钴离子发生竞争反应,导致除钴速率和除钴深度下降;当pH高于一定程度时,再提高pH对提高出钴效率的作用不明显,这与文献[14]的实验结果一致。同时,自然pH时的钴离子浓度比大多数受控pH实验的终点钴离子浓度低,这也与文献[14]的结果一致。
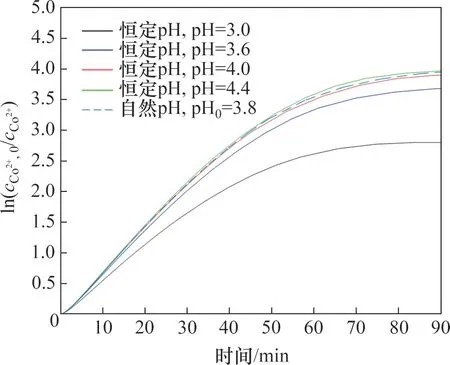
图8 pH对除钴速率的影响Fig.8 Influence of pH on cobalt removal rates
锑浓度对除钴速率的影响见图9,仿真的初始二价锑浓度为cSb3+,0=0~2.46×10-5mol/L,铜离子浓度对除钴速率的影响见图10,其中,仿真模拟初始铜离子浓度cCu2+,0=0~1.44×10-3mol/L,其他离子初始浓度与标准仿真实验相同;其他离子浓度也与标准仿真实验的浓度相同。由图9和图10可见:单独的铜催化或者锑催化对除钴速率的提升很小,这与LEW 等[14]所得结论一致。联合使用铜锑可以大幅度提高除钴速率,但当铜或锑达到一定浓度之后,再增加铜、锑浓度对除钴速率影响较小。

图9 锑浓度对除钴速率的影响Fig.9 Influence of Sb2+concentration on cobalt removal rates

图10 铜浓度对除钴速率的影响Fig.10 Influence of initial copper concentration on cobalt removal rate
本文对初始锌粉浓度对除钴的影响进行了仿真,仿真初始单质锌浓度为cZn,0=3.08×10-2~6.15×10-2mol/L,其他离子初始浓度与标准仿真实验的浓度相同,仿真结果见图11,由图11 可见:除钴速率和初始锌粉浓度近似成正比例关系,终点钴离子浓度随锌粉浓度增加而下降。

图11 锌粉浓度对除钴速率的影响Fig.11 Influence of zinc concentration on cobalt removal rates
图12所示为初始无锌离子条件下(cZn2+,0=0 mol/L)的仿真结果。从图12 可见:初始阶段(0~5 min)氢离子浓度下降速率远比标准状态下的下降速率快,这是因为在锌离子缺乏的情况下,水解和吸附反应((R6)和(R7))难以发生,电化学置换析出的氢得不到补充,导致氢离子浓度快速下降,溶液pH偏高。而在大约5 min时,伴随着锌离子浓度快速上升(铜、锑、氢离子与锌粉的置换反应产生了锌离子),在高pH 环境下,水解和吸附反应大量发生,导致锌与氢氧化锌的复合沉积物浓度cZnZn(OH)2快速上升,单质锌浓度呈成断崖式下降,从0.06 mol/L快速下降到接近0 mol/L,表明此时发生了锌粉“钝化”现象。锌粉“钝化”造成混合电位快速上升,使钴离子置换反应的反应速率变负,平衡左移,钴离子返溶,这与文献[14]所得结论一致。

图12 初始无锌离子条件下除钴过程离子浓度变化Fig.12 Variations of ion concentrations of cobalt removal process at initial condition without zinc ions
4 结论
1)提出了基于混合电位的除钴过程反应动力学模型。基于质量守恒原理,建立了批式除钴反应器的状态空间模型,并通过实验结果辨识了模型参数,验证了模型的准确性。
2) 本文所建机理模型能够准确地描述锌粉、铜锑、pH 对钴置换沉积速率的影响,可为研究除钴过程锌粉、铜锑添加量、pH 的协调优化控制策略提供参考。
(编辑 刘锦伟)
