外来入侵物种紫茎泽兰的抗氧化活性研究
2022-03-26张朝志袁彩莲程依婷
张朝志,袁彩莲,程依婷,佘 容*,肖 文,3,4
(1.大理大学 天然抗氧化剂和氧化炎症研究院,云南 大理 671003;2.大理大学 东喜玛拉雅研究院,云南 大理 671003;3.中国三江并流区域生物多样性协同创新中心,云南 大理 671003;4.大理大学 三江并流区域生物多样性保护与利用云南省创新团队,云南 大理 671003)
氧化应激是人体内致氧化与抗氧化作用失衡,即机体内活性氧(reactive oxygen species,ROS)的产生和抗氧化防御系统失衡所致[1-2]。研究[3]表明,人体多种疾病的发生都与氧化应激损伤有关。因此,医学上常添加能够有效抑制或清除自由基的抗氧化剂以协助维持体内氧化与抗氧化系统的平衡,防止相关疾病的发生和保持机体的健康。目前,常用的抗氧化剂主要是VC和VE,但随着大健康时代的到来,人们更偏好使用天然抗氧化剂。因此,充分开发利用自然界已存在的天然抗氧化剂具有重要意义。
紫茎泽兰(EupatoriumadenophorumSpreng),为菊目菊科泽兰属植物。其生命力强、适应性广,能释放多种化感物质以抑制周围其它植物的生长,是一种侵占性极强的恶性有毒入侵植物[4]。目前,紫茎泽兰在我国的入侵规模日益扩增,尤其在云南、四川、广西、贵州等省份已呈蔓延趋势,对农林牧业造成了巨大损失,并严重影响了生态环境[5-6]。近年来,为了变害为宝,研究者对紫茎泽兰的化学成分进行了研究[7-9],已有关于紫茎泽兰的毒理研究[10]和抗氧化活性研究,尤其是对致病菌抑制作用[11-14]的相关报道。胡楚娇等[15]利用DPPH法对紫茎泽兰醇提物的抗氧化活性进行了研究,发现紫茎泽兰具有较强的抗氧化活性。但是,众多关于植物活性物质的研究表明,利用不同极性溶剂萃取所得萃取物的活性成分是不同的,其功效也存在很大差异。因此,作者利用不同极性溶剂萃取紫茎泽兰叶的有效成分,并通过DPPH法、ABTS法、FRAP法评价萃取物的体外抗氧化活性,为紫茎泽兰的开发应用提供依据。
1 实验
1.1 材料、试剂与仪器
紫茎泽兰鲜活植株,于2021年1月中旬采自大理苍山洱海国家级自然保护区。
石油醚、乙酸乙酯、甲醇、无水乙醇、95%乙醇、VC,分析纯,国药集团化学试剂有限公司;DPPH (1,1-二苯基-2-苦肼基),分析纯,梯希爱化成工业发展有限公司;ABTS[2,2′-联氮-双(3-乙基-苯并噻唑-6-磺酸)二铵盐]、 TPTZ(2,4,6-三吡啶基三嗪),分析纯,上海麦克林生化科技有限公司。
AKDL-Ⅱ-24型艾柯实验室超纯水机,成都艾柯水处理设备有限公司;SB25-12DTD型超声波清洗机、SCIENTZ-10N型冷冻干燥机,宁波新芝生物科技股份有限公司;PX224ZH型电子天平,奥豪斯仪器有限公司;RE-2000A型旋转蒸发仪,上海亚荣生化仪器厂;HWS-26型电热恒温水浴锅,上海一恒科学仪器有限公司;722N型可见分光光度计,上海菁华科技仪器有限公司。
1.2 紫茎泽兰活性成分的提取
取新鲜的紫茎泽兰叶片,用蒸馏水漂洗3次后置于实验台上自然晾干,并于40 ℃下烘干至恒重后粉碎,过40目筛,装袋中,置于4 ℃冰箱中保存,备用。
准确称取紫茎泽兰叶干粉50 g,置于1 000 mL锥形瓶中,加入500 mL石油醚,封口膜封口,置于超声波清洗机中,于20 ℃、40 Hz、60%功率条件下超声萃取60 min,抽滤,滤液于40 ℃旋转蒸发浓缩后得到萃取物浸膏,再用少量蒸馏水溶解,冻干后置于4 ℃冰箱中避光保存,备用。剩余滤渣于40 ℃烘干后,依次用乙酸乙酯和70%乙醇萃取抽滤,浓缩,冻干后置于4 ℃冰箱中避光保存,备用。
1.3 DPPH自由基清除能力的测定[16]
1.3.1 DPPH自由基工作液的配制
准确称取1.00 g DPPH粉末于棕色容量瓶中,加入无水乙醇溶解,定容至1 000 mL,摇匀,得1.00 g·L-1的DPPH自由基母液,置于4 ℃避光保存。使用时,用无水乙醇将其浓度稀释至50 mg·L-1,即为DPPH自由基工作液。
1.3.2 DPPH自由基标准曲线的绘制
避光称取DPPH粉末1.25 g,用无水乙醇溶解并定容至50 mL,得25 g·L-1DPPH自由基母液;用无水乙醇将其稀释成梯度浓度20 g·L-1、15 g·L-1、10 g·L-1、5 g·L-1,测定517 nm处吸光度;以DPPH自由基浓度为横坐标、吸光度为纵坐标,绘制DPPH自由基标准曲线[17]。
1.3.3 紫茎泽兰萃取物DPPH自由基清除能力的测定
取萃取物干粉适量,加入甲醇将其稀释至浓度(g·L-1)分别为1.00 、0.50 、0.25、0.125、0.062 5、0.031 25的样品溶液;取2 mL样品溶液,加入2 mL 50 mg·L-1DPPH自由基工作液,混匀,37 ℃水浴避光反应30 min,测定517 nm处吸光度。以VC为阳性对照,同时设置样品对照和试剂空白,每个样品重复测定6次。按式(1)计算DPPH自由基清除率:
(1)
式中:A0为2 mL甲醇+2 mL DPPH自由基工作液的吸光度;A1为2 mL样品溶液+2 mL甲醇的吸光度;A2为2 mL样品溶液+2 mL DPPH自由基工作液的吸光度。
1.4 ABTS自由基清除能力的测定[18]
1.4.1 ABTS自由基工作液的配制
用蒸馏水分别配制7 mmol·L-1ABTS自由基溶液和4.9 mmol·L-1K2S2O8溶液,将两种溶液按1∶1体积比混合,避光保存12~16 h后,用无水乙醇稀释至一定比例,静置5 min后,测定734 nm处吸光度为0.70±0.02时即作为ABTS自由基工作液。
1.4.2 紫茎泽兰萃取物ABTS自由基清除能力的测定
取萃取物干粉适量,加入甲醇将其稀释至浓度(g·L-1)分别为0.25、0.125、0.062 5、0.031 25、0.015 625、0.007 812 5 的样品溶液。取样品溶液与ABTS自由基工作液等体积混匀,避光反应6 min后,测定734 nm处吸光度。同时,取不同浓度样品溶液与等体积无水乙醇混合后作为对照管,取2 mL无水乙醇与等体积ABTS工作液混合后作为空白管,避光反应6 min后测定734 nm处吸光度。同时设置样品对照和试剂空白,每个样品重复测定6次。按式(2)计算ABTS自由基清除率:
(2)
式中:A0为无水乙醇+ABTS自由基工作液的吸光度;A1为样品溶液+无水乙醇的吸光度;A2为样品溶液+ABTS自由基工作液的吸光度。
1.5 总抗氧化能力的测定[19]
1.5.1 FRAP工作液的配制
0.30 mol·L-1醋酸缓冲液:取0.80 g无水醋酸钠,加入8.40 mL冰醋酸,定容至500 mL,用1.00 mol·L-1盐酸溶液调节pH值至3.6。10 mmol·L-1TPTZ溶液:取TPTZ 0.078 g,用40 mmol·L-1盐酸溶液溶解并定容至25 mL。20.00 mmol·L-1FeCl3溶液:取FeCl30.27 g,用蒸馏水溶解并定容至50 mL。
将上述溶液按10∶1∶1体积比混合后,即为FRAP工作液(现配现用)。
1.5.2 FeSO4标准曲线的绘制
准确称取FeSO4·7H2O 0.471 7 g,加入1 mL浓硫酸,用蒸馏水溶解并定容至250 mL,配制成6 mmol·L-1的FeSO4溶液;用蒸馏水稀释成梯度浓度(mmol·L-1)为1.6、0.8、0.4、0.2、0.1的FeSO4溶液。取不同浓度FeSO4溶液各150 μL,加入FRAP工作液3.6 mL,37 ℃水浴避光反应10 min,测定593 nm处吸光度;以FeSO4溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线[17]。
1.5.3 紫茎泽兰萃取物总抗氧化能力的测定
取萃取物干粉适量,加入蒸馏水将其稀释至浓度(g·L-1)分别为10.00、8.00、6.00、4.00、2.00、1.00、0.50、0.25的样品溶液。取150 μL样品溶液,加入FRAP工作液3.6 mL,37 ℃水浴避光反应10 min,测定593 nm处吸光度。同时以去离子水为空白对照,1.0 mmol·L-1FeSO4标准溶液为阳性对照,每个样品重复测定6次。按式(3)计算总抗氧化能力:
(3)
式中:A1为样品管的吸光度;A2为空白对照管的吸光度;A0为阳性对照管的吸光度。
1.6 数据处理
比活性=IC50(VC)/IC50(样品),比活性越大,表明抗氧化剂清除自由基的能力越强。
实验数据表示为平均值±标准偏差,使用Excel软件绘图,并采用SPSS26.0软件进行统计分析。
2 结果与讨论
2.1 DPPH自由基清除能力
2.1.1 DPPH自由基标准曲线(图1)

图1 DPPH自由基标准曲线Fig.1 Standard curve of DPPH free radicals
由图1可知,DPPH自由基标准曲线的线性回归方程为y=0.0085x+0.0014,R2=0.9997。
2.1.2 紫茎泽兰萃取物对DPPH自由基的清除能力(图2)
由图2可知,紫茎泽兰不同溶剂萃取物均具有清除DPPH自由基的能力,且对DPPH自由基的清除率随着萃取物浓度的增加逐渐升高。当浓度为1.00 g·L-1时,70%乙醇萃取物的清除率达95.4%,乙酸乙酯萃取物次之,石油醚萃取物最低,IC50值分别为0.074 g·L-1、0.123 g·L-1、0.232 g·L-1;与VC的比活性分别为2.03%、1.22%、0.65%(VC的IC50值为0.001 5 g·L-1)。统计分析显示,70%乙醇萃取物的IC50值与石油醚和乙酸乙酯萃取物的有显著差异(P<0.05),而石油醚和乙酸乙酯萃取物的IC50值无显著差异。
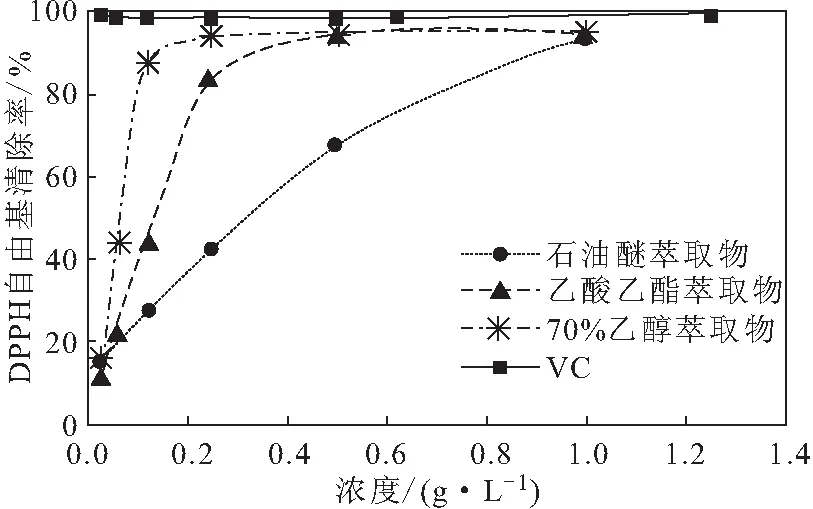
图2 紫茎泽兰不同溶剂萃取物对DPPH自由基的清除能力Fig.2 DPPH free radical scavenging ability of different solvent extracts of Eupatorium adenophorum Spreng
2.2 ABTS自由基清除能力
紫茎泽兰不同溶剂萃取物对ABTS自由基的清除能力如图3所示。

图3 紫茎泽兰不同溶剂萃取物对ABTS自由基的清除能力Fig.3 ABTS free radical scavenging ability of different solvent extracts of Eupatorium adenophorum Spreng
由图3可知,紫茎泽兰不同溶剂萃取物均具有清除ABTS自由基的能力,且对ABTS自由基的清除率随着萃取物浓度的增加逐渐升高,呈正相关的剂量效应。当浓度为0.25 g·L-1时,ABTS自由基清除率可达100%。70%乙醇萃取物的ABTS自由基清除率最高,石油醚萃取物次之,乙酸乙酯萃取物最低,IC50值分别为0.024 g·L-1、0.029 g·L-1、0.032 g·L-1,与VC的比活性分别为12.08%、10.00%、9.06%(VC的IC50值为0.002 9 g·L-1)。统计分析显示,石油醚萃取物、乙酸乙酯萃取物、70%乙醇萃取物的IC50值无显著差异。
2.3 FRAP总抗氧化能力(图4、图5)

图5 紫茎泽兰不同溶剂萃取物的总抗氧化能力Fig.5 Total antioxidant ability of different solvent extracts of Eupatorium adenophorum Spreng
FeSO4标准曲线(图4)的线性回归方程为y=0.6012x+0.0429,R2=0.9937。
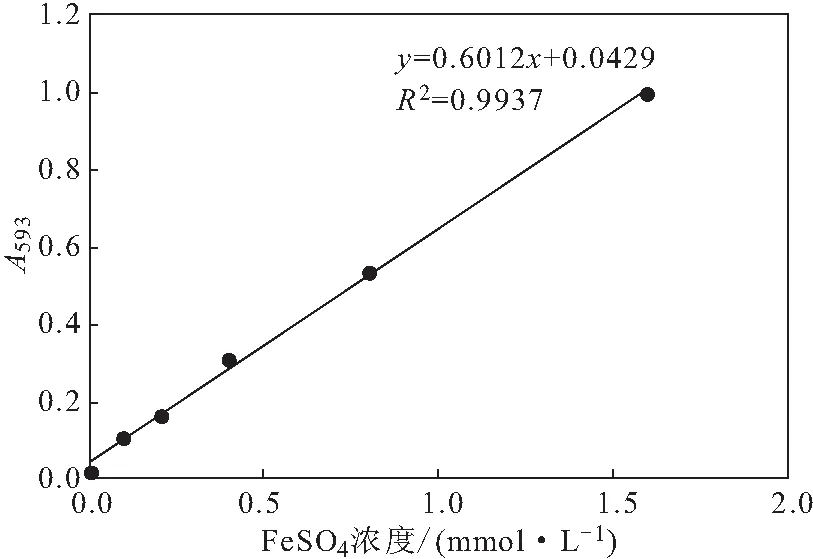
图4 FeSO4标准曲线Fig.4 Standard curve of FeSO4
由图5可知,紫茎泽兰不同溶剂萃取物的总抗氧化能力存在差异。当浓度为2.00 g·L-1时,70%乙醇萃取物的总抗氧化能力最强(FRAP值3.47 ± 0.01),其次为乙酸乙酯萃取物(FRAP值1.65 ± 0.07),石油醚萃取物最弱(FRAP值0.11 ± 0.01)。统计分析显示,70%乙醇萃取物的FRAP值与石油醚和乙酸乙酯萃取物的有显著差异(P<0.05),而石油醚和乙酸乙酯萃取物的FRAP值无显著差异。
2.4 讨论
已有关于外来入侵物种水葫芦的抗氧化性研究[20-21],其具有药用价值和经济价值,可制成家畜饲料[22]、造纸原料[23]等,现在水葫芦在中国的危害已经通过变害为宝得到了根治。
胡楚娇等[15]研究发现,紫茎泽兰70%乙醇萃取物的DPPH自由基清除能力的IC50值为0.3 g·L-1,与之相比,本实验中紫茎泽兰70%乙醇萃取物的DPPH自由基清除能力更好,IC50值为0.074 g·L-1。究其原因,一方面是活性成分的提取方法不同:本实验采用20 ℃超声萃取后再于40 ℃旋蒸浓缩得到活性成分,而胡楚娇等[15]采用的是冷浸超声2次后于70~85 ℃高温回流的方法,高温处理可能会破坏活性成分,不利于提取。另一方面,也有可能是所选取的DPPH自由基工作液浓度不同:本实验选用了50 mg·L-1DPPH自由基工作液,而胡楚娇等选用的是20 mg·L-1。根据DPPH自由基清除实验原理及IC50值的计算方法可知,DPPH自由基工作液浓度设定的不同会导致测定结果IC50值的不一致,而是否可以通过DPPH自由基工作液浓度进行IC50值的换算后进行横向比较,还有待验证。迄今为止,通过比较DPPH、ABTS、超氧阴离子等自由基的清除效果来评估抗氧化活性的方法被广泛应用,但所用自由基工作液浓度却不尽相同,由此导致研究得出的结果难以进行横向比较。因此,应建立一套标准的体外抗氧化实验的评估方法,以便于天然抗氧化产物的筛选[24]。
3 结论
分别使用石油醚、乙酸乙酯、70%乙醇等3种不同极性溶剂萃取紫茎泽兰叶的有效成分,通过DPPH法、ABTS法、FRAP法评价萃取物的体外抗氧化活性。结果表明,紫茎泽兰3种萃取物均有一定的抗氧化活性,其中70%乙醇萃取物对DPPH自由基和ABTS自由基的清除能力及总抗氧化能力最强,IC50值分别为0.074 g·L-1、0.024 g·L-1, FRAP值为3.47±0.01。3种萃取物均具有抗氧化活性,说明紫茎泽兰具有良好的抗氧化活性,可作为天然抗氧化剂的开发原料。今后将进一步探究紫茎泽兰抗氧化的有效化学成分、体内抗氧化应激和抗氧化炎症能力及其安全性。
