佛甲草的质量标准研究
2022-03-24李翔宇赵彩云
黄 玮 李翔宇 赵彩云
1.江苏省徐州市食品药品监督检验中心,江苏 徐州 221006;2.徐州医科大学,江苏 徐州 221000
佛甲草为景天科植物佛甲草SedumlineaeThunb.的干燥全草 。主要分布于中南及江苏、浙江、安徽、福建、江西、四川、贵州、云南、陕西、甘肃、台湾等地[1]。有清热解毒、消肿止血等功效。用于咽喉肿痛、目赤、痢疾、丹毒、带状疱疹、痈肿、烫、火伤和外伤出血[2]。现收载于《江苏省中药饮片炮制规范》2002年版,原标准只有性状鉴别,目前尚无有关佛甲草质量控制方面的文献报道,为了更好地控制该饮片的质量和安全性,结合参考文献[3-5],本研究通过增加显微鉴别、薄层鉴别、常规检查、浸出物测定及以槲皮素、山奈素和异鼠李素作为指标成分进行含量测定,以期建立完善的质量标准,以便控制佛甲草饮片的质量。
1 仪器与试药
1.1 仪器 FW177高速万能粉碎机(北京市永光明医疗仪器有限公司);LEICA DM 2500透射光显微成像系统(德国莱卡公司);XSR205电子天平(瑞士Metter公司,精度十万分之一);101A-1E型电热鼓风干燥箱(上海实验仪器厂有限公司);SX2-5-12型箱式电阻炉(天津市华北实验仪器有限公司);HH-6数显恒温水浴锅(常州国华电器有限公司);Waters e2695高效液相色谱仪(包括Empower3工作站,四元梯度泵,2998PDA检测器,自动进样器和柱温箱),均购自于美国Waters公司。
1.2 样品与试药 槲皮素对照品(批号:100081-200907,纯度为97.4%),山奈素对照品(批号:110861-201611,纯度为95.5%),异鼠李素对照品(批号:110860-201611,纯度为99.8%),均购于中国食品药品检定研究院;佛甲草对照药材(自制);甲醇为色谱纯(Fish公司),水为超纯水,其他试剂均为分析纯(国药集团化学试剂有限公司)。7批佛甲草饮片由企业提供,经徐州市食品药品监督检验中心赵彩云主任中药师鉴定为佛甲草SedumlineaeThunb.的干燥全草。详细信息见表1。

表1 样品来源信息
2 方法与结果
2.1 显微鉴别 本品粉末棕色。取本品粉末加水合氯醛试液加热透化装片,置显微镜下观察:叶上表皮细胞壁较平直,下表皮细胞壁常波状弯曲,气孔不定式。非腺毛单细胞,直径约20 μm。花粉粒近球形,表面可见颗粒状纹饰。纤维狭长而笔直,大多成束。草酸钙簇晶30~75 μm。导管多为螺纹导管 。如图1所示。

1. 叶上表皮细胞;2.叶下表皮细胞(气孔);3.非腺毛;4.花粉粒;5.纤维;6.簇晶;7.导管
2.2 薄层鉴别 取供试品粉末1 g,加甲醇20 mL,超声处理20 min,滤过,滤液蒸干,残渣加甲醇2 mL溶解,作为供试品溶液。另取佛甲草对照药材1 g,同法制成对照药材溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)[6]57试验,吸取上述两种溶液各2 μL,分别点于同一硅胶G薄层板上,以甲苯-三氯甲烷(1∶1)为展开剂,展开,取出,晾干,喷以5%磷钼酸乙醇溶液,在105 ℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。如图2所示。

1.对照药材; 2~8.供试品
2.3 水分、总灰分、酸不溶性灰分测定 取佛甲草饮片粉末(过二号筛)2 g,精密称定,分别照《中国药典》2015年版四部通则0832项下水分测定法(第二法 烘干法)、通则2302项下总灰分和酸不溶性灰分测定法测定水分[6]103、总灰分和酸不溶性灰分[6]204。各批次饮片均平行操作3次,取平均值。结果显示,7批佛甲草的水分含量为8.04%~9.73%,平均值为9.07%,以平均值的120%设限,为10.88%,故暂定本品水分不得过11.0%。总灰分含量为15.07%~20.53%,平均值为17.87%,以平均值的120%设限,为21.44%,数值较高故暂定不收入正文。酸不溶性灰分含量为5.12%~8.99%,平均值为7.14%,以平均值的120%设限,为8.56%,故暂定本品酸不溶性灰分不得过9.0%。详见表2。
2.4 浸出物测定 取佛甲草饮片粉末(过二号筛)2 g,精密称定,照《中国药典》2015年版四部通则2201水溶性浸出物测定法项下的热浸法测定浸出物含量[6]202。 以干燥品计算供试品中水溶性浸出物的含量(%),结果7批佛甲草饮片水溶性浸出物含量为25.42%~40.12%,平均值为30.30%,以平均值的80%设限,为24.24%,故暂定本品水溶性浸出物不得少于24.0%。详见表2。

表2 样品水分、总灰分、酸不溶性灰分、浸出物测定结果 (RSD<2.0%,n=3)
2.5 含量测定
2.5.1 色谱条件与系统适应性试验 色谱柱:C18(ZORBAX,XDB,250 mm×4.6 mm,5 μm),流动相:甲醇-0.4%磷酸溶液(45∶55),流速:1.0 mL/min,柱温:32 ℃,检测波长:360 nm,进样量10 μL。槲皮素、山柰素和异鼠李素峰与各自相邻峰的分离度均大于2.0,理论板数均大于5000。
2.5.2 对照品溶液 取槲皮素、山柰素和异鼠李素对照品适量,精密称定,分别100 mL量瓶中,加甲醇溶解并定容至刻度,制备各单一对照品母液。分别精密量取一定量的各对照品母液,置同一50 mL量瓶中,用甲醇稀释制成每1毫升含槲皮素40.87 μg、山柰素5.75 μg和异鼠李素5.92 μg的混合对照溶液。
2.5.3 供试品溶液 取本品2.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇-30%盐酸溶液(4∶1)25 mL,称定重量,置水浴中加热回流 30 min,迅速冷却至室温,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.5.4 阴性样品溶液 取制备供试品溶液的溶剂,按照供试品溶液制备方法制备阴性样品溶液。
2.5.5 系统适应性试验 分别吸取对照品溶液、供试品溶液和阴性样品溶液各10 μL,按“2.5.1”项下色谱条件进行测定,记录色谱图,结果显示,供试品色谱中槲皮素、山柰素和异鼠李素与各自相邻峰的分离度均大于2.0,理论板数均大于5000,阴性样品无干扰。色谱图如图3所示。
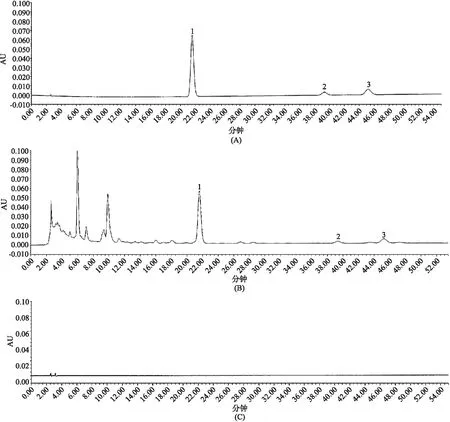
A. 对照品溶液;B.供试品溶液;C.阴性对照溶液;1.槲皮素; 2.山柰素;3.异鼠李素
2.5.6 定量限与检测限考察 分别精密量取“2.5.2”项下对照品溶液适量,以甲醇倍比稀释,并按“2.5.1”项下色谱条件进样测定,以信噪比为10∶1和3∶1分别计算3种待测成分的定量限和检测限。结果显示槲皮素、山奈素和异鼠李素的定量限分别为0.0163 μg/mL、0.0230 μg/mL、0.0237 μg/mL,检测限分别为0.006 μg/mL、0.0078 μg/mL、0.0079 μg/mL。
2.5.7 线性关系考察 分别精密量取“2.5.2”项下对照品溶液2、5、10、15、20、25 μL, 按“2.5.1”项下色谱条件进行测定,记录峰面积,以峰面积(Y)为纵坐标,进样量(X, μg)为横坐标进行直线回归,得回归方程:Y(槲皮素)=4.0684×106X-2.1006×103(r=0.9999,n=6);Y(山奈素)=4.6136×106X+7.6703×103(r=0.9993,n=6);Y(异鼠李素)=4.3187×106X+6.9922×103(r=0.9990,n=6),槲皮素进样量在0.08173~1.2260 μg,山柰素进样量在0.01151~0.1726 μg,异鼠李素进样量在0.01184~0.1776 μg的范围内线性关系良好。
2.5.8 精密度考察 取“2.5.2”项下对照品溶液,按“2.5.1”项下色谱条连续进样6次,测定面积,结果槲皮素平均峰面积为1655646,RSD为0.28%(n=6),山奈素峰平均峰面积为266269,RSD为1.01%(n=6),异鼠李素平均峰面积为259635,RSD为1.68 %(n=6),表明仪器精密度良好。
2.5.9稳定性试验 取同一批供试品溶液(批号:20151210),按“2.5.1”项下色谱条件进行测定,分别在0,2,4,8,12,24 h进样,测定峰面积,结果槲皮素平均峰面积为1664001,RSD为0.41%(n=6),山柰素平均峰面积为114870,RSD为1.67%(n=6),异鼠李素平均峰面积为261482,RSD为1.61%(n=6),表明供试品溶液在24 h内稳定。
2.5.10 重现性试验 取同一批号(批号:20151210)样品6份,按“2.5.3”项下供试品溶液制备方法制备供试液,再按“2.5.1”项下色谱条件进样测定,结果槲皮素、山柰素和异鼠李素的平均含量分别为0.4057 mg/g、0.0229 mg/g和0.0577 mg/g,RSD分别为1.77%、1.97%和1.86%(n=6),表明方法的重现性良好。
2.5.11 加样回收试验 精密量取已知含量的样品(批号:20151210,槲皮素的平均含量为0.4053 mg/g,山柰素的平均含量为0.0230 mg/g, 异鼠李素的平均含量为0.0583 mg/g)约1.25 g,共6份,精密称定,置具塞锥形瓶中,分别精密加入槲皮素对照品溶液(0.1022 mg/mL)5 mL、山柰素对照品溶液(0.01471 mg/mL)2mL和异鼠李素对照品溶液(0.02396 mg/mL)3 mL,按“2.5.3” 项下供试品溶液制备方法制备供试品溶液,再按“2.5.1”项下色谱条件进行测定,分别测定峰面积并计算加样回收率。结果见表3。

表3 加样回收率试验结果 (n=6)
2.5.12 样品测定 分别取各批次饮片细粉适量,按“2.5.3”项下供试品溶液制备方法制备供试液,再按“2.5.1”项下色谱条件进样测定,记录色谱图,并根据标准曲线计算3种成分含量,结果按干燥品计算。见表4。
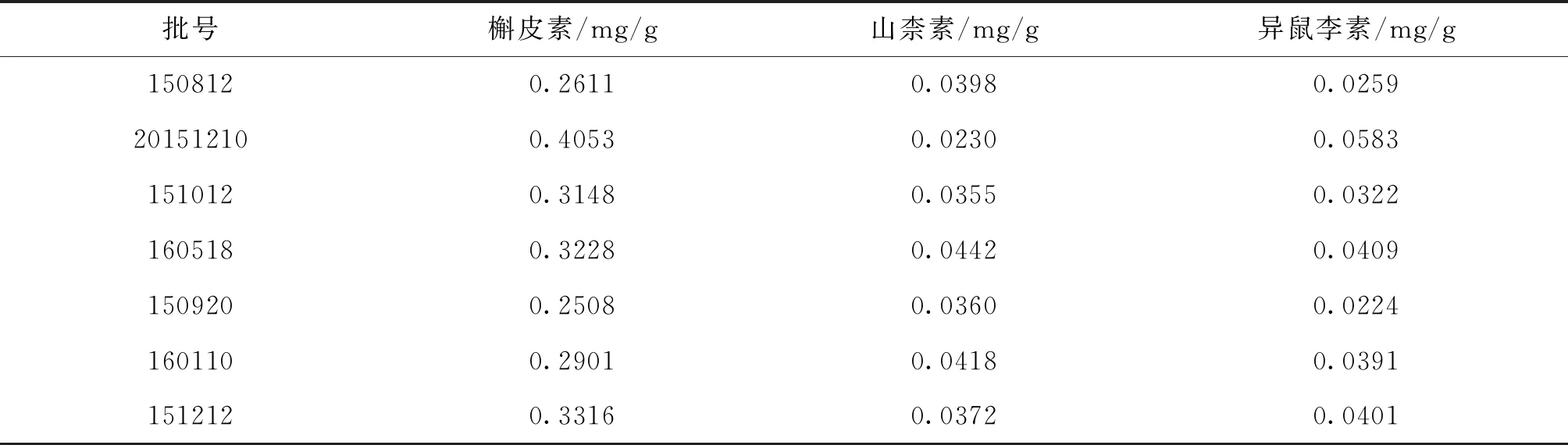
表4 样品含量测定结果表
3 讨论
在薄层色谱鉴别研究中考察了甲苯-三氯甲烷(1∶1)、环己烷-乙酸乙酯(40∶1)为展开剂进行薄层层析,结果甲苯-三氯甲烷(1∶1)为展开剂,层析的结果较好,斑点清晰;不同薄层板(Merck硅胶G板、青岛海洋硅胶G 板、自制硅胶G层板)进行比较,结果不同薄层板,薄层色谱分离效果均好,斑点清晰;不同温、湿度条件(t:5 ℃,RH:30%;t:18 ℃,RH:40%;t:23 ℃,RH:50%))及稳定性(0、2、8、24 h)试验,结果在三种温湿度条件下薄层色谱结果均稳定,斑点清晰,供试品溶液经放置24 h后,层析结果依然稳定,斑点清晰。结果表明该方法可行。
浸出物含量测定中,分别采用不同浸出方法(热浸法、冷浸法),不同溶剂(乙醇、稀乙醇、 70%乙醇、30%乙醇、水)进行了比较,结果表明,采用热浸法,以水为溶剂,测得浸出物量最高。故选择水为溶剂,热浸法进行浸出物测定。
含量测定中,流动相的选择根据有关参考文献[7]报道槲皮素、山柰素与异鼠李素的HPLC测定方法,流动相为甲醇-0.4%磷酸溶液(50∶50)进行试验,发现供试品溶液中异鼠李素峰与前后峰没完全分开,故提高流动相中水相的比例,结果各峰分离度较好,所以最终确定流动相为甲醇-0.4%磷酸溶液(45∶55)。供试品制备方法的选择,对供试品回流温度、时间及加入盐酸浓度等影响因素进行了考察,结果加入甲醇-30%盐酸(4∶1)25 mL沸水浴回流30 min可酸解完全,样品重复性高。本研究建立的含量测定方法能同时测定佛甲草中槲皮素、山柰素和异鼠李素的含量,其中槲皮素含量最高,占测定的3种成分总含量的70%左右。据文献[8]报道,槲皮素具有抗氧化、抗病毒和抗炎的作用,与佛甲草具有清热解毒、消肿止血等功效一致。因此,选择槲皮素作为该饮片含量限定的指标成分,7批样品槲皮素的平均含量为0.031%, 以平均值的80%设限,为0.025%, 故暂定本品含槲皮素不得低于0.025%。
