异槲皮素的制备及研究进展
2020-06-02房仙颖章祎唯赵林果
房仙颖,章祎唯,萧 伟,赵林果,3*
1南京林业大学化学工程学院,南京 210037;2江苏康缘药业股份有限公司,连云港 222001;3南京林业大学 江苏省南方现代林业协同创新中心,南京 210037
异槲皮素(槲皮素-3-O-β-D-吡喃葡萄糖苷)和芦丁(槲皮素-3-O-芸香糖苷)都是天然黄酮醇(3,5,7,3′,4′-五羟基黄酮)的主要糖苷形式(图1)。异槲皮素不仅生物活性广泛,在安全性、生物利用度和某些活性上较槲皮素和芦丁有一定的优势[1-3]。“酶法修饰(α-葡萄糖基化)的异槲皮素”(enzymatically modified isoquercitrin,EMIQ)是利用环糊精葡糖转移酶对异槲皮素进行转糖基化获得的异槲皮素衍生物(图2)。EMIQ不仅着色效果好、天然无毒,而且水溶性较好,并具有广泛的生物活性,已获得FDA的批准,可用于食品添加[4,5]。所以异槲皮素具有很好的研究和开发利用价值。

图1 芦丁、异槲皮素和槲皮素的结构
近几十年来,关于芦丁和槲皮素的研究报道非常多,而对异槲皮素的研究则相对较少。一方面,异槲皮素虽然在天然界中分布广泛,但含量很低,通过提取分离手段制备难度大、产率低、成本高,从而限制了异槲皮素的活性及其应用的研究;另一方面,芦丁在天然界中不仅分布广泛而且含量远高于其他黄酮类化合物[6],应用生物催化方法由芦丁制备异槲皮素引起了食品和医药行业的兴趣。其关键技术就是需要筛选、制备特异性催化芦丁转化为异槲皮素的高效α-L-鼠李糖苷酶。本文在实验室的研究基础上,对PubMed等数据库进行了文献检索,综述了与异槲皮素的分布、生产、理化性质、药理学活性、安全性和应用等方面相关的内容。
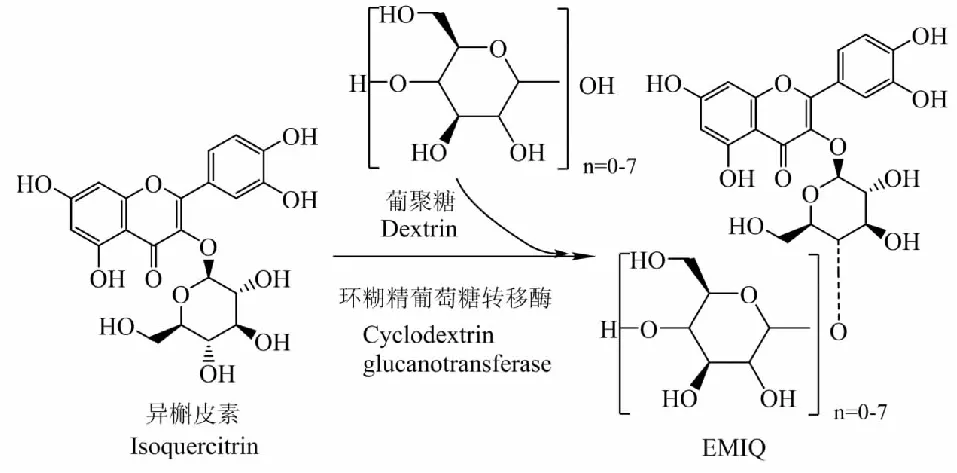
图2 EMIQ的结构及制备方法
1 分布
异槲皮素,作为最丰富的天然黄酮化合物槲皮素的单葡萄糖苷,广泛存在于水果、蔬菜、谷物和多种植物源的饮料。异槲皮素最早是从加拿大紫荆的种子荚中分离出来的,近年来已被报道存在于罗莎黄柏花、杨梅的叶片、多种葱属、苋菜、开心果、杜仲叶、木芙蓉叶、三叶崖爬藤、矮桃、莲子外果皮、杭菊、椴树属、金叶子、芙蓉玫瑰茄、佛甲草、苹果叶、南非红叶茶树、蛇莓、桑叶等植物中。大量研究显示,许多植物的生物活性与其中所含的异槲皮素相关。例如,杜仲抗氧化[7],罗布麻治疗肝损伤和抗血小板凝集[8,9],金丝桃属抗炎[10],青钱柳治疗高血脂[11],鱼腥草抗病毒和抑制NF-κB活化[12],黄槟榔青的抗焦虑抗抑郁作用[13]等。第一个有关食物中多酚类物质的数据库Phenol-Explorer列出了36项含量介于0.000 067‰(猕猴桃汁)和0.419 5‰(金樱子的果实)(平均0.023 8‰,中值0.005 9‰)的品种。基于这些数据,按照每日建议果蔬食用量500 g计算,异槲皮素的平均每日摄入量估计为3~12 mg[14]。
2 异槲皮素的生产/制备
虽然异槲皮素分布很广,由于其在植物原料中的含量极低,很难利用提取方法得到足够多的纯品用于食品和制药工业[15]。而且,由于工艺相对复杂,目前尚无通过化学合成法制备异槲皮素的研究报道。另一方面,芦丁在天然植物中含量很高,可以从荞麦、槐米、红豆等植物中获取。比色法和液相色谱法测得,苦荞麸皮乙醇粗提物的主要成分为苦荞黄酮,黄酮含量为74.0%,其中86.5%为芦丁,槲皮素和异槲皮素微量;乙醇粗提物经高压水解后,总黄酮含量为76.2%,其中,芦丁、槲皮素和异槲皮素分别占60.6%、25.2%和13.5%[16]。化学法水解芦丁不仅选择性差,无法控制糖苷键断裂的位置,水解得到的异槲皮素会进一步被水解为槲皮素(苷元形式),而且反应条件剧烈,环境污染大。相比之下,生物法可以在温和条件下催化水解反应,具有较高的立体和区域选择性。因此,通过选择性去除芦丁分子中的鼠李糖制备异槲皮素将是更好的方法(图3)。
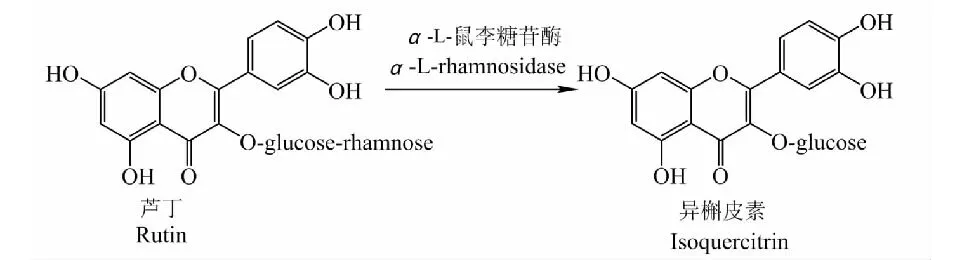
图3 芦丁制备异槲皮素转化图
2.1 提取法制备异槲皮素
通过提取法制备异槲皮素的研究较少。据报道,Li等[17]采用蜗牛酶水解法提取罗布麻花中异槲皮素,最佳提取工艺为酶解温度60 ℃、酶用量0.2 mg/mL、酶解时间1 h、pH 5.0,该法提取测得异槲皮素含量为4.06%;Zhao等[18]采用高速逆流色谱法,对棉花花提取物进行一步分离纯化,经波谱法结构鉴定、薄层色谱、高效液相色谱法测定产品的纯度,获得质量分数为99%的异槲皮素对照品。虽然提取法制备异槲皮素的原料来源多,但因含量普遍很低,存在提取效率低、成本高、分离纯化困难、不具备扩大生产条件等问题,一定程度上限制了异槲皮素的开发利用。
2.2 柚皮苷酶/橙皮苷酶制备异槲皮素
Hasumura等[19]使用柚皮苷酶/橙皮苷酶水解芦丁,随后进行纯化得到了以异槲皮素为主的“酶解的芦丁”;Gong等[20]建立了一个利用橙皮苷酶同步反应和分离制备异槲皮素的系统;Wang等[21]建立了一个有效提高橙皮苷酶催化芦丁转化生成异槲皮素反应的双向体系。但柚皮苷酶/橙皮苷酶中通常既含有α-L-鼠李糖苷酶活性又含有β-D-葡萄糖苷酶活性,水解时容易产生槲皮素,从而影响异槲皮素的纯度和得率。Jo等[22]发现枣汁提取物中可能存在β-D-葡糖糖苷酶抑制剂,提示可以将这类抑制剂用于柚皮苷酶/橙皮苷酶中β-D-葡糖糖苷酶的活性,从而提高异槲皮素的制备得率。上述酶制剂虽然能够用于异槲皮素的制备,但酶的专一性不强,导致产物纯度不高、酶解条件难以调控或反应体系复杂等问题。
2.3 专一性鼠李糖苷酶的开发
Zhang等[23]利用双歧杆菌来源的鼠李糖苷酶将芦丁生物转化为异槲皮素;Wu等[24]筛选得到一株可以产α-L-鼠李糖苷酶的黑曲霉,所产酶最适温度为55 ℃,最适pH为5.5,利用该酶转化芦丁制备异槲皮素,在最适条件下反应45 min,芦丁转化率高达95%;Yadav等[25]从灰青霉PenicilliumgreoroseumMTCC-9224中分离得到一种α-L-鼠李糖苷酶,能特异性地催化芦丁生成异槲皮素,最适pH 6.5,最适反应温度57 ℃。但利用传统菌株制备的鼠李糖苷酶活性低,于是人们把研究重点转向了基因工程菌。Lv等[26]从岸滨芽孢杆菌(Bacilluslitoralis)中克隆并表达了一个能特异性转化芦丁生成异槲皮素的α-L-鼠李糖苷酶,重组酶最适温度为60 ℃,于20~55 ℃使用时稳定,最适pH值是6.0,且仅在pH 6.0附近保持稳定。Gerstorferová等[27,28]使用在巴斯德毕赤酵母中异源表达的耐碱性的土曲霉α-鼠李糖苷酶,开发了一种生物催化法由芦丁生产高纯度异槲皮素(约99.5%)的有效方法。但是,上述基因工程菌生产的α-L-鼠李糖苷酶普遍存在表达量不高、酶活低等问题,且至今为止还没有用于商业化的纯鼠李糖苷酶产品。
为获得能高效转化含有鼠李糖基的天然黄酮类化合物,本实验室克隆表达了一系列α-L-鼠李糖苷酶[29,30]。其中,来源于AspergillusterreusCCF 3059的α-L-鼠李糖苷酶(AtRha)具有优异的热稳定性、良好的pH稳定性和较广的适宜反应 pH,最高酶活可达1 000 U/ml。目前发现的糖苷酶多数只能在水相体系中进行催化反应,有机溶剂耐受度低,黄酮类化合物在水溶液中溶解度低的问题也限制了其大规模制备。通过多次电转筛选到了高拷贝的PichiapastorisKM71H基因工程菌,通过添加山梨醇,显著提高了AtRha的热稳定性,添加适量的山梨醇能使AtRha在65、70和75 ℃的半衰期分别提高4.5、17.2和30.3倍,在相同条件的酶解过程下,添加1.5 mol/L的山梨醇后,异槲皮素的得率由60.01%提高到96.43%[29]。采用B-factor饱和突变策略对AtRha进行了改造,获得了两个热稳定性更好的突变体D594Q和G827K-D594Q,成功提高了AtRha的热稳定性以及芦丁催化转化制备异槲皮素的产量,在相同条件下,与突变前AtRha相比,异槲皮素的产量分别提高了13.5%和11.0%[31]。目前,该酶正在进行高密度发酵研究,有望用于异槲皮素的工业化生产。
3 理化性质及生物利用度
3.1 化学结构
黄酮是酚类和吡喃环组成的苯并-γ-吡喃酮衍生物,并根据其基本骨架上取代基的不同进行分类。在自然界中,黄酮类化合物主要以3-O-糖苷和聚合物形式存在。在异槲皮素分子中,葡萄糖连接到槲皮素C-3位;芦丁,L-α-吡喃鼠李糖-(1,6)-β-吡喃葡萄糖(芸香糖)取代基位于相同的位置(图1)。以下结构元件对于黄酮清除自由基活性起着重要作用:B环中的O-二羟基(儿茶酚)结构具有显著的抗自由基活性;C环中2,3-双键与4-O基团的共轭可促使π-电子离域并稳定H-abstraction后的黄酮基团;C-3(C环),C-5和C-7(A环)位的羟基对自由基的清除具有重要意义[32]。
3.2 亲水/亲脂性
黄酮是弱酸,因此它们的溶解度随pH上升而增加[28]。黄酮醇在水中溶解性通常较差,黄酮醇的糖基化能增加它们在水中的溶解度。与EMIQ的“自由”溶解度相比,槲皮素、异槲皮素和芦丁的溶解度分别为50、206和196 μmol/L(分别相当于15、95和120 mg/L)[3]。相比之下,异槲皮素和芦丁在极性有机溶剂中的溶解性比槲皮素差。对于在水溶液中开展的实验,通常用DMSO助溶将其配制成高浓度储备液(1 000倍浓度)后再使用;体内则将其配制成水悬浮液使用[3]。
化合物在体内的生物利用度和生物学活性,不仅取决于单纯的溶解度,还跟相间分配有关。亲脂性和亲水性控制着蛋白质和膜的相互作用、转运和结合活性,影响化合物的吸收和排泄。异槲皮素的辛醇-水(缓冲液)分配系数(logP值)为0.76~0.77,与之相比,槲皮素为1.82,EMIQ为-0.25,芦丁为-0.45 ~-0.64,糖苷配基比任何缀合物都更具亲脂性[33]。近期一项研究通过对大鼠连续8天灌胃给予槲皮素(12 mg/kg/d)和异槲皮素(18 mg/kg/d),比较二者的生物利用度。与槲皮素相比,喂食了异槲皮素大鼠的肝、肺、心脏、肾、脑和血浆中的代谢产物含量一致高出槲皮素2~5倍[34]。
3.3 光谱性质
植物黄酮的主要生理功能之一是着色,联同其防止褪色的功能,这个特性也被用于食品生产。黄酮的吸收光谱由介于240~400 nm间两个不同的频段组成。带I出现在300和380 nm之间,归功于B环(kmax约在350~370 nm附近),而带II覆盖了240~280 nm的范围(kmax约在260~270 nm),归功于A-C苯甲酰体系。最大吸收在300 nm左右有一个很弱的带,归功于单独的C环。对于甲醇溶的异槲皮素,kmax在257和352或353 nm发现吸收带[35]。
4 异槲皮素的药理活性
4.1 抗氧化
抗氧化是黄酮类化合物普遍具备的活性之一,目前已有大量研究从多个角度阐明了异槲皮素的抗氧化作用机制[14]。例如,异槲皮素可以清除黄嘌呤/黄嘌呤氧化酶系统产生的超氧自由基并且抑制黄嘌呤氧化酶的活性;在酵母多糖活化的巨噬细胞RAW264.7中,异槲皮素能够抑制p47phox蛋白的磷酸化,进而抑制超氧化物的产生;异槲皮素也被认为是髓过氧化物酶的抑制剂,该酶在呼吸链中利用过氧化氢和Cl产生次氯酸;在分离得到的人淋巴细胞中,异槲皮素减少了H2O2诱导的DNA损伤;在H2O2处理的大鼠视网膜神经节RGC-5细胞中,异槲皮素降低了胞内ROS水平、谷胱甘肽耗竭和脂质过氧化;对CdCl2处理的小鼠进行研究发现,异槲皮素能够螯合Cd2+并减弱其毒性作用(超氧化物歧化酶和过氧化氢酶活力降低,脂质过氧化水平升高,产生NO,蛋白质羰基和DNA-蛋白质的交联),因此对镉引起的脂质过氧化和蛋白质氧化损伤有保护作用。
4.2 免疫调节
在大鼠体内局部给予异槲皮素(10 mg/kg)可以预防角叉菜胶诱导的炎症反应[36]。异槲皮素还可以通过抑制MAPK信号通路抑制LPS诱导的大鼠腹腔巨噬细胞NO的释放,从而发挥抗炎活性[37]。一项Balb/c小鼠过敏性哮喘模型实验表明,异槲皮素降低了卵清蛋白诱导的支气管肺泡灌洗液中嗜酸性粒细胞的数目,并且能够降低肺匀浆中IL-5的水平,表现为有效的抗炎试剂,具备用于治疗过敏症的潜力[38]。另一方面,异槲皮素能增加免疫动物后B淋巴细胞的体外增殖,为免疫系统发挥特异性体液免疫应答、分泌抗体做准备[39]。
4.3 抑菌和抗病毒
异槲皮素能够通过破坏细胞膜发挥抗病原真菌(白色念珠菌)的作用,并且几乎没有溶血现象发生[40]。在另一项研究中,异槲皮素对病原细菌粪肠球菌和病原真菌烟曲霉、白色念珠菌和新型隐球菌表现出抑制活性[41]。异槲皮素对革兰氏阳性菌的药物作用靶标Sortase A具有轻微的抑制作用[42]。Gaudry等研究表明异槲皮素可以抑制ZikA病毒对人细胞的感染[43]。此外,异槲皮素还可以通过抑制NF-κB活化抑制单纯孢疹病毒感染导致的炎症[12]。
4.4 抗肿瘤
异槲皮素可以减少人骨肉瘤MG-63细胞中TNF-α刺激产生的IL-6的表达;抑制人纤维肉瘤HT1080细胞中PMA诱导的AP-1的转录活性,并上调MMP-9[14]。异槲皮素通过调控鸦片受体和MAPK途径抑制前列腺癌和肝癌细胞的体内外增殖[44];通过抑制Wnt/β-catenin信号通路抑制结肠癌细胞体外生长[45]。异槲皮素体外抑制结肠癌细胞增殖能力较槲皮素弱,体内抑制结肠癌增长能力相当,在消化道被水解为槲皮素,可作为药物前体[46]。异槲皮素作为半枝莲中的主要成分,能够抑制HGF/SF诱导的肿瘤细胞迁移和侵袭[47]。异槲皮素还可以通过激活AMPK活化蛋白激酶途径诱导膀胱癌细胞凋亡[48]。
4.5 对脂代谢及相关疾病的调节
异槲皮素具备的抗氧化能力有利于降低肝细胞脂肪量;其脂肪酸酰基化衍生物能够增强异槲皮素抗脂质过氧化的活性[49]。通过活化AMPK途径,异槲皮素可预防脂代谢紊乱和非酒精性脂肪肝[50]。此外,异槲皮素还可以诱导肝脏载脂蛋白A-I的表达,具备用于治疗低α-脂蛋白血症的可能性[51]。异槲皮素在小鼠3T3-L1前脂肪细胞中,能活化Wnt/β-catenin途径,抑制3T3-L1细胞的分化[14];还可以增强对脂肪生成的抑制作用,有望用于肥胖及相关疾病的防治[52]。
4.6 神经保护作用
在小鼠/大鼠神经胶质瘤杂交NG108-15细胞中,异槲皮素通过调节Rho GTP酶的表达、活性和细胞定位促进突起的延伸,可用于防治神经系统紊乱;异槲皮素能诱导人神经母细胞瘤SH-SY5Y细胞中固醇调节元件结合蛋白-2(SREBP-2)的表达和活性,促进SREBP-2介导的甾醇合成和对过氧化氢诱导的氧化应激的细胞保护,保护脂质过氧化造成的细胞损伤;从贯叶连翘中分离出的异槲皮素(0.6 mg/kg,口服)纯化合物在大鼠被动游泳实验中表现出抗抑郁活性;通过测量小鼠孔板测试实验中的镇静行为,异槲皮素(30 mg/kg,腹腔注射)显著减少后脚站起次数[14]。异槲皮素对6-OHDA诱导的PC12神经细胞毒性具有保护作用,具有治疗帕金森的潜质[53]。帕金森疾病中,参与泛素化途径和多巴胺合成的基因编码的转录因子的表达水平会发生改变,异槲皮素通过改变这类基因的表达起到神经保护作用[54]。在自然界中,异槲皮素存在于许多安神植物,可能与其它黄酮类物质一起表现出神经药理学活性。
4.7 治疗糖尿病
异槲皮素(15 mg/kg/d,口服给药10天)抑制四氧嘧啶Aloxan诱导的高血糖,肝和肾的脂质过氧化和肝葡萄糖-6-磷酸酶的活性,同时提高过氧化氢酶和SOD的活性和谷胱甘肽的含量;在口服葡萄糖耐受试验中,异槲皮素(单剂量100 mg/kg,口服)使血糖峰值延迟了30 min,从而表现出时间依赖性抗高血糖活性;然而,50和200 mg/kg剂量组在该模型中则无效;连续11天给予异槲皮素(3或9 mg/kg,口服)对大鼠空腹血糖水平没有显著影响[14]。Jayachandran等[55]的研究表明异槲皮素可以通过胰岛素信号通路改善糖尿病大鼠高血糖及调节糖代谢关键酶(己糖激酶、丙酮酸激酶等),作用方式与临床用药格列本脲类似,揭示异槲皮素有望成为糖尿病的治疗药物。临床数据显示,糖尿病患者除了病症本身,还应注意因长期血糖增高带来的血管受损和心、肝、脑、肾等器官损伤。异槲皮素对II型糖尿病造成的大鼠肝损伤有保护作用,在10和30 mg/kg的剂量下能够剂量依赖性地改善临床症状,如FBG和葡萄糖耐受,降低血清ALT、AST、IR的水平,增加TP、Alb、SOD等[56]。
4.8 心肌保护
异槲皮素对H2O2诱导的H9C2心肌损伤大鼠具有保护作用,可能的作用机制是保护细胞免受氧化损伤,该研究系首次发现异槲皮素的心肌保护功能[57]。异槲皮素通过抗炎、抗凋亡因子和调节TLR4-NF-κB信号通路改善心肌梗塞[58]。Huang等[59]研究表明,异槲皮素可以通过激活AMPKα通路,减轻LPS诱导的促炎作用,减轻LPS诱导的小鼠心脏功能紊乱。
4.9 治疗心血管疾病
异槲皮素能够抑制血管紧张素转换酶活性,具有与标准利尿药螺内酯相当的利尿作用,可以增加缓激肽、前列环素和NO的生物利用度,抑制Na(+)/K(+)-ATP酶活性,因此表现出降压作用[14]。Gasparotto等[60]随后的一项研究表明,异槲皮素诱导的内皮依赖型和非依赖型的动脉血管扩张与内皮NO释放和Kir6.1钾通道开放有关。Dai等[61]揭示异槲皮素通过Nrf2介导的NOX4/ROS/NF-κB途径抑制缺血再灌注损伤后氧化应激和神经元凋亡。
4.10 阿尔茨海默症防治
Carmona等[62]的一项研究表明,异槲皮素具有抑制β-和γ-分泌酶的活性以及抑制Aβ聚集和促进其分解的能力。
4.11 其他活性
除了上述活性,还有研究表明异槲皮素对体内外骨髓间充质干细胞的成骨分化都起积极作用,提示异槲皮素可能是预防腭裂缝线术后复发的潜在候选药物[63]。异槲皮素可以抑制细胞膜上肾上腺素刺激的腺苷酸环化酶活性[64]。大鼠被给予霍乱弧菌毒素后,异槲皮素(ID5019.2 μmol/kg)适度地减少了肠液分泌;此外异槲皮素还具有抗阿米巴原虫作用(IC5014.7 μg/mL)和抗Giargia鞭毛虫的作用(IC5047.5 μg/mL)[14]。Zhang等[65]研究表明,异槲皮素通过抑制PASMC增殖、阻断PDGF-Rβ信号通路改善MCT诱导的肺血管重塑,防治肺动脉高压。值得注意的是,异槲皮素在细胞水平的有效浓度通常为10 μM及以上的浓度。在实验动物的血浆中并没有检测到如此高的异槲皮素浓度,但不能排除在肠道内或在肝脏等部位可以达到这个浓度[14]。
除了相对非特异性的抗氧化作用,目前已有许多特定的黄酮分子靶标得到确定。黄酮可以与其它生物分子相互作用,尤其是与蛋白类物质,因此它们可调节酶、细胞受体或转录因子的功能。异槲皮素被报道能在体外抑制多种酶的活性,例如大鼠肝脏微粒体的3-羟基-3-甲基戊二酰辅酶A还原酶,大鼠肠道α-葡糖苷酶,酿酒酵母来源的α-葡糖苷酶和人α-淀粉酶[14]。异槲皮素抑制糖转运功能被证明是由葡萄糖转运GLUT2介导的[66]。随着新药理活性的发现,异槲皮素在细胞内将有更多的分子靶点被揭示。
作为获得FDA批准的异槲皮素衍生物,EMIQ也有许多生物活性。EMIQ可以显著抑制卵清蛋白诱导的鼠耳被动皮肤过敏反应[3]。在人类受试者中,通过预防性或治疗性地服用的EMIQ(100 mg/d,连续8周),能够有效缓解日本柳杉花粉造成的眼部症状;EMIQ通过依赖于内皮NO合成酶的机制,抑制病理性的血管生成,也可以刺激生理性的血管生成;经22天口服给药(3和26 mg/kg)后,EMIQ剂量依赖性抑制了自发性高血压大鼠的平均血压和心率的增加;动脉粥样硬化apoE缺陷小鼠给予高脂饮食,若在高脂饲料中添加EMIQ(0.026%),连续喂食14周后能显著抑制主动脉粥样硬化病变区以及在脉斑中的巨噬细胞和4-羟基-2-壬烯醛的含量[14]。Kangawa等[67]的研究表明,EMIQ具有抗炎作用,能减轻DSS诱导的小鼠肌肉损伤,可能对IBD的治疗有帮助。多项研究表明,异槲皮素和EMIQ能够预防或抑制肝癌病变[68,69]。减小接种了小鼠源结肠癌细胞的小鼠体内肿瘤大小,改善氮氧基甲烷/葡聚糖硫酸钠诱导的结直肠癌和花青素的预后[70]。
5 安全性
作为一类天然物质,少量异槲皮素是人类日常饮食的常见组分。基于异槲皮素的有益属性,将它作为食品添加剂引起了越来越多的关注。将异槲皮素用于食品/药品添加之前,其安全性需要得到确定。此外,槲皮素的安全性问题与异槲皮素是息息相关的,因为它可能是异槲皮素的一个代谢产物或者不想要的掺入成分[5]。大量研究表明,高纯度的槲皮素通常被认为是安全的,不存在遗传毒性或致癌性等方面的问题[71]。
5.1 遗传毒性
近期一项研究发现,纯异槲皮素可以保护DNA不受氧化损伤的破坏,并且具有显著的抗突变作用[39]。Hasumura和Tamura等[19,72]引用了日本卫生部、劳工及福利局未公布的数据,在使用鼠伤寒沙门氏菌TA98和TA1537进行Ames试验时,异槲皮素表现出很弱的致突变作用;但在使用培养的哺乳动物细胞进行染色体畸变试验或用小鼠进行微核试验时,则没有表现出遗传毒性。异槲皮素增强了2-乙酰氨基芴对鼠伤寒沙门氏菌的诱变效应,但也对黄曲霉毒素B1[73]、叔丁基过氧化氢[74]的诱变起到保护作用。异槲皮素在体外哺乳动物微核和染色体畸变试验、雄性和雌性B6C3F1小鼠和Sprague Dawley大鼠的微核和彗星试验、以及评价多个潜在靶组织的MutaTM小鼠突变试验中均表现为阴性,进一步支持了异槲皮素在食品和饮料产品中的安全使用[75]。
5.2 动物临床表现
在Wistar大鼠的日常饮食中分别添加0.2%、1%和5%的异槲皮素(芦丁水解所得,含量95%),连续喂食13周后考察其毒性。接受5%异槲皮素添加饮食的雄性大鼠组表现出轻微的体重下降,甘油三酯、总胆红素、无机磷、血红蛋白和红细胞比容明显下降,肺和睾丸的相对重量略有增加。接受同样饮食的雌性大鼠组单核细胞比率增加。对Wistar大鼠而言,该类异槲皮素的无可见不良反应水平(no observable adverse effect levels,NOAEL)在雄性中估值为1%(相当于539 mg/kg/d),在雌性中估值为5%(相当于3 227 mg/kg/d)[19]。另外一项研究针对同样的产品开展了为期52周的慢性毒性研究。Wistar大鼠在接受0.04%,0.2%,1%和5%的上述产品作为日常饮食添加后,通过观察死亡率、临床生化和器官重量指标,并未发现有毒性作用。在高剂量组,雌雄性大鼠出现了色尿症和尿钙排泄增加的现象,雄性大鼠的肾骨盆还出现了矿化、炎性细胞碎片、炎性细胞浸润和移行细胞增生的情况。NOAEL值估计为1%,相当于542.4 mg/kg/d[72]。若要求达到100倍的安全系数,那么NOAEL将转变为一个可以接受的ADI值5.4 mg/kg/d(相当于70 kg的个体每日食入379 mg)。
值得注意的是,异槲皮素的衍生物EMIQ是高度可吸收,FDA已确认其为公认的安全化合物。Nyska A在一项为期90天的研究中,给予Sprague-Dawley大鼠高达5%EMIQ的饮食剂量,对EMIQ进行安全性和毒性动力学测试。所有动物都存活到计划的安乐死,没有任何动物的临床毒性迹象。在所有剂量水平下,EMIQ均被吸收并伴有代谢产物槲皮素和槲皮素葡萄糖醛酸。在一些组织重量和临床化验物中观察到了显著变化,但未发现系统毒性。最显著的发现是受试动物全身剂量依赖性的发黄,显微镜下没有观察到任何变化,这一现象在毒理学上是微不足道的。服用EMIQ的动物总体上未表现出不良临床症状、体重变化、饲料消耗、临床病理参数和组织病理学终点,表明NOAEL值为5%(相当于在雄性和雌性大鼠饮食中EMIQ添加量分别为3 461和3 867 mg/kg/d)[76]。
6 结语
异槲皮素广泛分布于天然产物中,与芦丁和槲皮素相比,具有较好的生物利用度和安全性,也是合成EMIQ的重要前体。EMIQ的潜在活性包括抗氧化、抗炎(过敏)、肿瘤防治和心脑血管疾病防治等,已经获得FDA的批准可用于食品添加。异槲皮素的生物活性包括抗氧化、免疫调节、抗病菌、抗肿瘤、调节脂代谢、神经保护、改善糖尿病、心肌保护、对抗心血管疾病和防治老年痴呆等。根据目前研究结果看,异槲皮素不会导致突变、生殖毒性等安全性问题,但在高剂量下可能会引发色尿症等不良反应。高纯度的异槲皮素可以用于食品或药品,但其安全剂量有待进一步研究确定。
虽然异槲皮素在植物原料中的含量极低,但在结构上比其多一个鼠李糖基的芦丁不仅分布广泛而且可以从廉价的豆科植物槐米中大量获取。近年来,随着生物酶技术的发展,包括本课题组在内的一系列研究表明,可以利用α-L-鼠李糖苷酶将芦丁定向转化为异槲皮素。为了满足实现工业化生产需求,鼠李糖苷酶的酶活仍需进一步提高,酶的生产成本仍需进一步降低。国内外一些课题组正在深入开展针对鼠李糖苷酶的基因改造、固定化、工程菌的高密度发酵、酶法转化工艺体系和产物分离提取工艺等方面的研究。相信通过生物催化与转化的技术创新和集成,可以实现异槲皮素纯品的高效制备,为推进异槲皮素在食品、药品、保健品中的研究和应用提供技术支撑。
