泽泻对MSG大鼠IL-6、TNF-α含量和基因表达的影响
2022-03-24黄春丽冯光维余跃生
黄春丽 冯光维 余跃生 邓 莹
黔南民族医学高等专科学校,贵州 都匀 558013
泽泻为泽泻科植物泽泻Alismaorientale(Sam)Juzep 的干燥块茎,始载于《神农本草经》,列为上品,性寒,味甘,味淡,归膀胱经、肾经,具有利水渗湿泻热、化浊降脂的功效,临床常用于治疗小便不利、水肿涨满、痰饮眩晕、热淋涩痛等病症[1]。现代研究[2-3]发现,泽泻中含有多种化学成分,主要以三萜类和倍半萜类为主,有利尿、降血脂、降血糖、抗炎、抗肿瘤等多种药理作用。目前对泽泻的研究更多集中在利尿及调血脂方向,近年来也有学者[4-5]研究了对泽泻的抗炎及免疫调节作用,但针对泽泻干预糖尿病相关炎症的研究较少,为此本实验拟通过高糖高脂饮食配合腹腔注射谷氨酸钠复制MSG 肥胖大鼠模型,给予泽泻醇提物治疗后,观察MSG肥胖大鼠血清及肝脏中炎症相关因子表达,为泽泻治疗糖尿病提供更多理论依据。
1 材料与仪器
1.1 动物 SD孕鼠,体重(300~400 g),由长沙市天勤生物技术有限公司提供,动物合格证编号:SCXK(湘 )2014—0011。实验前 1周饲养于黔南民族医学高等专科学校实验动物中心,自由饮食,温度 18~22 ℃。
1.2 药品 泽泻(黔南州鼎鑫生物科技有限公司,批号:180431);非诺贝特(江苏瑞年前进制药有限公司,批号:1803241);罗格列酮(成都瑞恒有限公司,批号:190512)。
1.3 试剂与仪器 白介素-6(IL-6)试剂盒(批号:L141118510),肿瘤坏死因子-α(TNF-α)试剂盒(批号:L141118514),均由Uscn Life science Inc公司提供。Trizol试剂(Servicebio公司,批号:G3013);HyPure TMMolecular Biology Grade Water(HyClone公司,批号:SH30538.02);Servicebio®RT First Strand cDNA Synthesis Kit(Servicebio公司,批号:G3330);2×SYBR Green qPCR Master Mix(High ROX)(Servicebio公司,批号:G3322);引物合成(上海生工生物工程股份有限公司合成);D3024R台式高速冷冻型微量离心机(DragonLab公司);PC-1000 PCR逆转录仪(PERKIN ELMER公司);CFX96型Real-Time PCR仪(Bio-Red公司);SW-CJ-1FD超净工作台(苏净安泰公司);Epoch酶标检测仪(BioTeK公司)。见表1。

表1 PCR引物序列
2 方法
2.1 泽泻醇提物的制备 先将泽泻药材粉粹成粗粉,取粗粉1 kg加80%乙醇回流提取3次,每次2 h,减压回收溶剂得泽泻醇提取物。
2.2 模型建立及分组 SD大鼠新生乳鼠从第2天开始皮下注射L-谷氨酸钠,剂量为4 g·kg-1·d-1连续注射7 d,正常对照组给予等量生理盐水。MSG组给予高脂饲料喂养,正常对照组普通饲料,8周后眼眶采血检测空腹血糖及血脂变化,以空腹血糖及血脂水平显著高于正常组为造模成功标准。将符合模型标准的48只大鼠,按随机数字表法分为6组,分别为模型组、罗格列酮5 mg/kg组、非洛贝特100 mg/kg组、泽泻4 g生药/kg组、泽泻2 g生药/kg组及泽泻1 g生药/kg组,另取8只空白大鼠作为正常对照组。各组每日灌胃相应药物,连续 8周,给药期间自由进食,饮水。
2.3 标本采集 给药8周后,末次给药前禁食12 h,给药1 h后,3.5%水合氯醛腹腔注射麻醉,腹主动脉采血,3500 r·min-1,离心15 min,分离血清,分装冻存备用;迅速摘除肝脏、脾脏与胰腺组织剥离周围脂肪组织,称重后液氮冻存。
2.4 指标检测
2.4.1 脏器系数的计算 将剖取的脾脏、胰腺组织,用生理盐水冲洗,滤纸吸干水分后,称重,计算脏器系数。脏器系数=脏器重量(mg)/大鼠体重(g)×100%
2.4.2 血清中IL-6、TNF-α含量检测 采用免疫荧光法检测血清中IL-2,TNF-α含量,具体步骤严格按照试剂盒要求进行。
2.4.3 肝脏组织IL-6 mRNA,TNF-α mRNA的检测 取肝脏研磨后,加入TRIzol按说明提取RNA,按照试剂盒说明书进行反转录,进行PR-PCR实验。
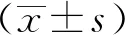
3 结果
3.1 泽泻对MSG大鼠脾脏及胰腺系数的影响 给药8周后,与正常对照组相比,模型对照组脾脏系数显著降低(P<0.01),胰腺系数显著升高(P<0.01);与模型对照组相比,罗格利酮组胰腺系数显著降低(P<0.01),非诺贝特组脾脏系数显著升高(P<0.01);泽泻高、中剂量组脾脏系数显著升高(P<0.01,P<0.05),泽泻高、中剂量组胰腺系数显著降低(P<0.01,P<0.05)。泽泻低剂量组对脾脏及胰腺系数没有明显影响。见表2。

表2 泽泻对MSG大鼠脾脏及胰腺系数的影响
3.2 泽泻对MSG大鼠血清中IL-6、TNF-α含量的影响 给药8周后,与正常对照组相比,模型对照组血清IL-6和TNF-α含量显著升高(P<0.01);与模型对照组相比,罗格利酮、非诺贝特组血清IL-6和TNF-α含量显著降低(P<0.01,P<0.05);泽泻高、中剂量组肝脏血清IL-6和TNF-α含量显著降低(P<0.01,P<0.05)。泽泻低剂量组对血清IL-6和TNF-α含量没有明显影响。见表3。

表3 泽泻对MSG大鼠血清IL-6和TNF-α含量的影响
3.3 泽泻对MSG大鼠肝脏中IL-6 mRNA,TNF-α mRNA表达的影响 给药8周后,与正常对照组相比,模型对照组肝脏IL-6 mRNA和TNF-αmRNA相对含量显著升高(P<0.01);与模型对照组相比,罗格利酮、非诺贝特组肝脏IL-6 mRNA和TNF-αmRNA相对含量显著降低(P<0.01,P<0.05);泽泻高、中剂量组肝脏IL-6 mRNA和TNF-αmRNA相对含量显著降低(P<0.01,P<0.05);泽泻低剂量组肝脏IL-6 mRNA和TNF-αmRNA相对含量没有明显变化。见表4。

表4 泽泻对MSG大鼠肝脏IL-6 mRNA和TNF-αmRNA表达的影响
4 讨论
2型糖尿病是一种受环境和遗传因素影响的慢性代谢性疾病,前期患者出现高血糖、高血脂等症状,近年来大量的实验及临床研究[6]发现炎症因子紊乱也是糖尿病特征之一,因此抑制2型糖尿病患者前期体内炎症反应有重要的临床意义。IL-6是一种由脂肪分泌的具有免疫活性的细胞,不仅参与能量代谢与机体炎性反应也密切相关[7],作为研究糖尿病最突出的炎症因子之一,研究[8]表明IL-6能使胰岛β细胞受损进而引起胰岛素抵抗,最终使血糖水平升高,故IL-6的水平可作为判断糖尿病的重要指标。TNF-α也是一种由脂肪分泌的促炎因子,TNF-α能作用于脂肪及周围组引起胰岛素抵抗,还可以刺激其他炎症因子如IL-6的分泌加重胰岛素抵抗。本实验结果显示采用MSG加高脂饲料复制的MSG肥胖大鼠血清及肝脏中IL-6和TNF-α含量及基因表达都显著升高,经过泽泻醇提物干预后各组大鼠血清中IL-6和TNF-α含量下降,肝脏中IL-6和TNF-αmRNA相对表达下降,说明泽泻具有一定抗炎作用,其作用机制与抑制炎症相关因子IL-6和TNF-α的含量及基因表达密切相关。
