直肠癌组织中BRG1的表达及其与病理特征和预后的关系
2022-03-23高春芳
赵 楠 魏 东 高春芳
(中国人民解放军联勤保障部队第989医院结直肠乳腺疝外科 洛阳 471000)
直肠癌是我国常见的消化道恶性肿瘤之一,发病率呈逐年升高趋势和年轻化趋势。直肠癌的病理进程是一个涉及多因素、多阶段、多基因的过程,遗传因素、饮食因素与疾病的转归有关,原癌基因激活、抑癌基因失活也与疾病的发展有关。迄今为止,在直肠癌病理进程中发挥关键作用的基因仍未阐明。BRG1(Brahma-related gene1)是近年来新发现的具有肿瘤抑制作用的基因,其编码产物参与哺乳动物细胞内SWI/SNF复合物的组成,SWI/SNF复合物能够通过表观遗传学调控、染色质重构、基因转录活性改变等途径来调节基因表达,进而发挥抑癌活性[1~2]。已有多项研究报道,BRG1在结直肠癌、宫颈癌、胃癌组织中呈低表达趋势[3~5],但关于BRG1与直肠癌病理特征及预后的关系尚未明确。本研究具体分析了直肠癌组织中BRG1表达情况及其与病理特征、预后的相关关系。
1 材料与方法
1.1 材料
选择2015年8月~2019年6月期间我院手术切除的直肠癌标本,均经术后病理确诊,共62例,TNM II期30例、III期32例,高分化28例、中低分化34例,合并淋巴结转移24例。所有患者术前均未接受放化疗。即用型免疫组化超敏UltraSensitiveTMSP检测试剂盒购买于福建迈新生物公司,BRG1免疫组化抗体购买于Santa Cruz公司,超纯RNA提取试剂盒、SuperRT cDNA第一链合成试剂盒、UltraSYBR Mixture试剂购买于北京康为世纪公司。
1.2 方法
1.2.1BRG1表达情况的测定
取石蜡包埋的直肠癌组织,制作病理切片后采用即用型免疫组化超敏检测试剂盒对BRG1进行染色,在高倍镜选取多个视野进行观察,细胞核呈棕黄色颗粒为BRG1阳性。0%~25%细胞阳性为1分、26%~50%细胞阳性为2分、51%~75%细胞阳性为3分、76%~100%细胞阳性为4分;细胞无着色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分。两项乘积0~4分为低表达、6~16分为高表达。
1.2.2增殖基因表达的测定
取液氮冷冻的直肠癌组织,采用超纯RNA提取试剂盒提取组织中的RNA后采用SuperRT cDNA第一链合成试剂盒将其合成为cDNA;取cDNA 1μL与UltraSYBR Mixture试剂10μL、引物混合物0.8μL、去离子水8.2μL混合后进行PCR反应,反应程序如下:95℃ 20s、特异性退火温度 15s、72℃ 25s,重复40个循环。基因引物序列、退火温度如表1所示。根据扩增曲线得到循环阈值,以β-actin为内参,计算CyclinB1、CyclinE、p21、p27的mRNA表达量。

表1 基因引物序列及退火温度
1.2.3随访
术后每3个月进行1次随访,随访方式包括电话随访、门诊随访、住院复查等,随访内容包括是否复发、复发时间、生存时间等,随访截止日期为2021年1月、随访时间19~65个月。
1.3 统计学方法
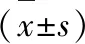
2 结果
2.1 不同病理特征的直肠癌组织中BRG1的表达情况
TNM III期直肠癌组织中BRG1的高表达率低于TNM II期直肠癌组织,中低分化直肠癌组织中BRG1的高表达率低于高分化直肠癌组织,有淋巴结转移的直肠癌组织中BRG1的高表达率低于无淋巴结转移的直肠癌组织,见表2。

表2 不同病理特征的直肠癌组织中BRG1的表达情况
2.2 不同BRG1表达情况的直肠癌组织中增殖基因的表达量
BRG1高表达的直肠癌组织中CyclinB1、CyclinE的mRNA表达量明显低于BRG1低表达的直肠癌组织,p21、p27的mRNA表达量明显高于BRG1低表达的直肠癌组织,见表3。

表3 不同BRG1表达情况的直肠癌组织中增殖基因的比较
2.3 不同BRG1表达情况的直肠癌患者的预后情况
直肠癌组织中BRG1高表达的患者的无病生存时间、总生存时间均长于BRG1低表达的患者,见表4;BRG1高表达的患者5年总体生存曲线高于BRG1低表达的患者,见图1。

表4 不同BRG1表达情况的直肠癌患者的生存时间比较

图1 不同BRG1表达情况的直肠癌患者的生存曲线
3 讨论
直肠癌的发生及发展过程涉及多因素、多阶段、多基因,探明在该过程中起到关键作用的基因有助于发现疾病治疗的新靶点。SWI/SNF复合物所介导的染色质重塑过程在基因转录调控中起到重要作用,越来越多的研究表明恶性肿瘤进程中伴有SWI/SNF复合物功能的减弱[6~7]。BRG1、BRM、SNF5、BAF155等是参与SWI/SNF复合物组成的分子,其中BRG1具有DNA依赖的具有ATP酶活性的类解旋酶亚基,在细胞增殖、迁移、侵袭等过程中均起到调控作用[8]。国内外多项研究证实,BRG1具有抑癌基因活性且在多种恶性肿瘤病灶内呈低表达趋势[3~5]。在国内外其他学者研究的基础上,本研究分析了不同病理特征的直肠癌组织中BRG1表达量的差异,TNM III期、中低分化、有淋巴结转移的直肠癌组织中BRG1的高表达率明显降低。这一结果提示BRG1的低表达不仅与直肠癌的发生有关,还参与直肠癌的病理进程,与肿瘤分期的进展、分化程度的降低、淋巴结的转移均存在密切关系。
BRG1主要通过阻碍细胞增殖来发挥抑癌基因活性,细胞内多种增殖基因的表达过程受到BRG1的调控。CyclinB1和CyclinE是细胞周期的正性调控分子,通过与各自的激酶形成复合体来促进细胞跨过细胞周期检查点,进而加速细胞周期进程、促进细胞增殖[9];p21和p27是细胞周期的负性调控分子,能够抑制多种细胞周期蛋白激酶与Cyclin形成复合体,进而使细胞周期发生停滞、细胞增殖受到抑制[10]。为了进一步明确BRG1低表达在直肠癌病理进程中的作用,本研究分析了不同BRG1表达量的直肠癌组织中上述增殖基因表达的差异,在BRG1高表达的直肠癌组织中,具有促增殖作用的CyclinB1、CyclinE呈低表达趋势,而具有增殖抑制作用的p21、p27呈高表达趋势。这一结果表明BRG1能够减少促增殖基因的表达、增加增殖抑制基因的表达,直肠癌病灶内低表达的BRG1能够使促增殖基因的表达上调、增殖抑制基因的表达下调,进而促进直肠癌病理进程的发展。
直肠癌患者手术后的病情转归及预后直接受到肿瘤病理特征的影响。在肿瘤分期越高、分化程度越低的直肠癌病灶内,癌细胞的增殖和侵袭活力越旺盛,更加容易发生远处微转移[11];而在已经发生局部淋巴结转移的直肠癌病灶内,癌细胞已经发生了邻近组织结构的浸润,容易在手术后残留微小病灶[12]。直肠癌手术后微小转移病灶的残留是远期复发和转移的病理基础。前一部分的结果已经阐明病灶内BRG1的低表达与直肠癌的病理进程密切相关,为了进一步阐明BRG1异常表达与直肠癌预后的关系,本研究在手术后对患者的生存期进行了随访,直肠癌组织中BRG1高表达的患者的无病生存时间、总生存时间较长且5年总体生存曲线明显高于BRG1低表达的患者。这一结果提示直肠癌组织中BRG1的异常表达与直肠癌患者的预后直接相关,BRG1低表达患者的生存时间较短、预后较差。
综上所述,直肠癌组织中BRG1的低表达与病理进程发展、增殖活力加剧、生存时间缩短有关。