髓系特异性Abro1基因敲除小鼠构建和表型初步分析①
2022-03-23李亚婷尹荣华杨晓明任广明葛志强天津大学化工学院制药工程系天津300072
李亚婷 张 洁 尹荣华 杨晓明 任广明 葛志强(天津大学化工学院制药工程系,天津 300072)
ABRO1(Abraxas brother 1)也称为FAM175B,由415 个氨基酸构成,分子量约为55 kD[1-3]。ABRO1作为一种支架蛋白,主要分布于细胞质,通过与其他蛋白相互作用参与机体多种生理过程调节[4]。ABRO1 与MERIT40、BRE、BRCC36 相结合组装成BRISC 复合体,可特异性去除K63 位链接的多聚泛素链[5-8]。同时,ABRO1 与去泛素化酶USP7 相互作用,可特异性去除p53 的K48 位链接的多聚泛素链[9]。此外,ABRO1还可作为转录辅因子与AP-1等转录因子结合进而调控细胞氧化应激反应[10]。
ABRO1 在机体免疫调节中发挥关键作用。ABRO1 与SHMT 蛋白结合,一方面介导BRISC 复合体对IFNAR1 的K63 位去泛素化,进而启动干扰素通路[7];另一方面,介导BRISC 复合体对病毒转录因子HIV-1 Tat 的K63 位去泛素化,调节病毒在T 细胞内的复制[11]。此外,课题组前期研究发现,ABRO1介导BRISC 复合体对NLRP3 激活阶段的K63 位去泛素化,进而促进NLRP3 炎症小体活化,Abro1全基因敲除小鼠显著抵抗LPS诱导的败血症以及尿酸钠(sodium urate,MSU)导致的腹膜炎[12]。为进一步揭示ABRO1在免疫调节中的潜在机制,课题组构建了髓系特异性Abro1基因敲除小鼠。
本研究采用CRISPR/Cas9 基因编辑技术和Cre/LoxP 重组系统成功构建了髓系特异性Abro1基因敲除小鼠[13-15]。同时在基因组和蛋白水平对其进行鉴定,并初步分析其表型,为后期研究ABRO1 在髓系细胞中的调控机制奠定良好基础。
1 材料与方法
1.1 材料
1.1.1 实验动物Abro1flox/+小鼠由上海南方模式生物科技股份有限公司采用CRISPR/Cas9基因编辑技术构建;Lyz2-Cre+小鼠由上海南方模式生物科技股份有限公司赠送(The Jackson Laboratory;# 004781;B6.129P2-Lyz2tm1(cre)Ifo/J);实验动物在军事科学院军事医学研究院动物实验中心SPF 级动物房饲养繁殖,军事科学院军事医学研究院实验动物使用和管理委员会审查通过(伦理号:IACUC-DWZX-2020-568)。
1.1.2 实验试剂 1640 培养基(#C11875500BT)、澳洲胎牛血清(#10270)购自Gibco;Gelred 核酸染料(#EL108-01)、2×Taq PCR MasterMix(#MT201-01)购自博迈德生物技术有限公司;Red Cell Lysis Buffer(#LSB03)购自杭州联科生物技术股份有限公司;Mouse Inflammation Kit(#552364)购自BD;蛋白酶K(#539480)购自EMD Millipore corporation;LPS(#L7011)购自Sigma;IL-1β ELSIA(#ab197742)检测试剂盒购自Abcam;Western blot抗体:anti-ABRO1(#NBP1-90282)购自NOVUS;anti-GAPDH(#AC002)、HRP Goat Anti-Rabbit IgG(#WH157306)购自ABclonal;流式抗体:anti-CD45-PE(#12-0451-82)、anti-CD11b-efluor450(#48-0112-82)、anti-Ly6C-PE-Cy7(#25-5931-82)、anti-Ly6G-APC(#17-5931-82)、anti-B220-APC(#17-0452-81)、anti-CD3-FITC(#14-0031-82)购自eBioscience。
1.2 方法
1.2.1Abro1flox/+小鼠构建Abro1flox/+小鼠采用CRISPR/Cas9 基因编辑技术将LoxP位点放置于Abro1基因2 号外显子(exon2)区域两侧:通过体外转录方式得到Cas9 mRNA 和gRNA;采用In-Fusion cloning 方法构建同源重组载体(targeting vector),随后将Cas9 mRNA、gRNA和targeting vector显微注射至C57BL/6J小鼠受精卵,将长片段PCR 鉴定结果为正确同源重组的小鼠与C57BL/6J小鼠交配,得到Abro1flox/+小鼠。
1.2.2Abro1flox/flox/Lyz2-Cre+小鼠繁殖Abro1flox/+小鼠构建完成后进行雌雄自交,子代筛选出Abro1flox/flox纯合子小鼠。Abro1flox/flox与Lyz2-Cre+小鼠交配,子代得到Abro1flox/+/Lyz2-Cre+小鼠,将其与Abro1flox/flox交配,最终得到Abro1flox/flox/Lyz2-Cre+小鼠为髓系特异性Abro1基因敲除小鼠(myeloid-specificAbro1knockout mice,MKO 小鼠);Abro1flox/flox/Lyz2-Cre-小鼠作为野生型小鼠(wild type mice,WT小鼠)。
1.2.3 鼠尾DNA 提取 剪取适龄小鼠鼠尾3 mm,置于无DNA 污染的1.5 ml EP 管,每支EP 管加入250 µl 鼠尾裂解液[100 mmol/L Tris-HCl(pH=8),200 mmol/L NaCl,5 mmol/L EDTA,0.2%SDS,100µg/ml蛋白酶K],58℃水浴孵育2~12 h。12 000 r/min 离心10 min,取100 µl 上清转移至新的EP 管。加入2.5 倍体积的无水乙醇,-20℃沉淀DNA 30 min,12 000 r/min 离心10 min,弃上清,室温静置数分钟使乙醇充分挥发,加入66µl 去离子水,涡旋振荡充分溶解DNA。
1.2.4 PCR 反应体系:DNA 模板1~2 µl、正反向引物各1µl(10µmol/L)、2×Taq PCR MasterMix 10µl,去离子水补齐至20µl。其中LoxP基因型鉴定正向引物:5'-ATCCTGCCATTGTCTGTATT-3',反向引物:5'-CAAGCTGGTGTCATCTATTA-3';Lyz2-Cre 基因型鉴定正向引物:5'-ATCGGTAGGAACTTCCTGTTTTGCACAC-3',反向引物:5'-ATCCATCCATCCACACACACATCACTCT-3'。PCR 扩增程序:LoxP基因型鉴定PCR 扩增程序为94℃5 min;94℃30 s,58℃30 s,72℃1 min,35个循环;72℃5 min;12℃10 min。Lyz2-Cre 基因型鉴定PCR 扩增程序为94℃5 min;94℃30 s,55℃30 s,72℃1 min,34 个循环;72℃5 min;12℃10 min。
1.2.5 小鼠免疫细胞分离与培养
1.2.5.1 骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDMs)分离和培养 选取8~10周龄WT 和MKO 小鼠,无菌环境中分离股骨和胫骨,6 ml生理盐水冲出骨髓细胞,细胞筛过滤除去残存肉沫,800 g 离心5 min,弃上清,1640 培养基重悬并计数,计数完成后转至含1640培养基+30%L929上清+10%胎牛血清的培养皿,调整细胞密度为1×106个/ml,共培养7 d,细胞分离完成后72 h、120 h 换液,培养完成后离心弃上清,加入适量上样缓冲液并搅拌细胞沉淀使其充分裂解,煮样,-20℃存储备用。
1.2.5.2 中性粒细胞(neutrophils,NEU)分离 首先采用上述相同方法将小鼠骨髓细胞冲出,800 g 室温离心5 min 后弃上清,加入红细胞裂解液(0.2%NaCl)重悬并裂解20 s,裂解完成后加入等体积红细胞裂解终止液(1.6%NaCl)颠倒混匀,细胞筛过滤,800 g 室温离心5 min,弃上清,生理盐水重悬,逐滴滴加于倾斜的66%percoll 溶液,按照升速为9,降速为1,1 000 g 离心30 min,离心完成后可看到离心管液体明显分层,NEU 位于离心管底部,将离心管上层液体小心吸出丢弃,将细胞沉淀重悬,加入生理盐水800 g 离心5 min,弃上清,除去残存percoll溶液,细胞沉淀中加入适量上样缓冲液裂解细胞,煮样,-20℃存储备用。
1.2.5.3 腹腔原位巨噬细胞(peritoneal macrophage,PM)分离 选取8~10 周龄WT 和MKO 小鼠,吸取适量提前预冷的1640 培养基(含5 mmol/L EDTA)注入小鼠腹腔,轻揉小鼠腹部,用5 ml 注射器将小鼠腹腔中的液体吸出,置于离心管,4℃、800 g离心5 min,弃上清,用适量的1640 培养基(不含血清)重悬细胞沉淀,接种至6 孔板,置于细胞孵化箱静置2 h 后倒掉旧培养基并更换为1640+双抗+10%血清培养过夜,观察细胞形态,胰酶消化,培养基停止消化,离心,弃上清,加入适量上样缓冲液,煮样,-20℃存储备用。
1.2.5.4 胸腺T 细胞分离 选取8~10 周龄WT 和MKO 小鼠,取出胸腺并于预冷的生理盐水中剪碎研磨,细胞筛过滤,离心,弃上清,重悬计数,计数完成后加入上样缓冲液并煮样,-20℃保存备用。
1.2.6 Western blot 将制备完成的BMDMs、NEU、PM、胸腺T 细胞蛋白样本进行聚丙烯酰胺凝胶电泳,转膜,封闭,置于封闭液稀释的ABRO1(1∶1 000)及内参GAPDH(1∶20 000)抗体中4℃旋转孵育过夜,洗膜除去残留的一抗,置于封闭液稀释的HRP Goat Anti-Rabbit IgG二抗(1∶5 000)室温孵育1~1.5 h,洗膜除去残留的二抗,暗室显影。
到了许都之后,曹操对关羽三日一小宴,五日一大宴,还送给他许多金银财宝和美女。关羽就让美女去服侍嫂嫂,又把财物都交给她们。后来,曹操又把吕布的赤兔马送给关羽,关羽收下了,并再三拜谢。曹操十分奇怪,便问关羽为何以前的赏赐从不感激,今天却要再三拜谢呢?关羽答道,因为有了这匹赤兔千里马,一旦得知刘备的下落,就可以早一点到他身边了。曹操一听,心中越发敬重关羽的为人。
1.2.7 流式细胞术分析小鼠造血分化 取小鼠外周血和骨髓细胞,800 g 离心5 min,弃上清,加入3 ml Red Cell Lysis Buffer 固定裂红10 min,加入3 ml PBS 终止裂红,800 g 离心5 min,弃上清,加入200µl PBS 吹打混匀并分成两份,一份加入CD45-PE、CD11b-efluor450、Ly6C-PE-Cy7、Ly6G-APC 流式抗体,一份加入CD45-PE、CD11b-efluor450、B220-APC、CD3-FITC 流式抗体,4℃避光孵育30 min,800 g 离心5 min,加入500 µl PBS 重悬作为检测样本,BD LSR Fortessa流式细胞仪检测。
1.2.8 LPS 诱导败血症 选取3 对适龄WT 小鼠和MKO 小鼠,每只小鼠腹腔注射10 mg/kg LPS,3 h 后眼球取血500µl,静置30 min,3 000 r/min离心20 min,吸取上清,检测相关生化指标和炎症因子水平。
1.3 统计学处理 采用GraphPad Prism 8 软件进行数据分析,采用非配对双尾t检验,P<0.05为差异有统计学意义。
2 结果
2.1Abro1flox/flox/Lyz2-Cre+小鼠获得及鉴定
2.1.1Abro1flox/flox小鼠获得及鉴定 采用CRISPR/Cas9基因编辑技术将Abro1flox/+小鼠LoxP位点放置于Abro1基因2 号外显子(exon2)区域两侧,构建策略如图1A。Abro1flox/flox基因型小鼠由Abro1flox/+基因型小鼠雄雌自交获得,仅扩增出338 bp 条带的小鼠基因型为Abro1flox/flox纯合子,仅扩增出284 bp 条带的小鼠基因型为Abro1+/+纯合子,同时扩增出338 bp和284 bp条带的小鼠基因型为Abro1flox/+杂合子(图1B)。结果表明Abro1flox/flox小鼠构建成功。
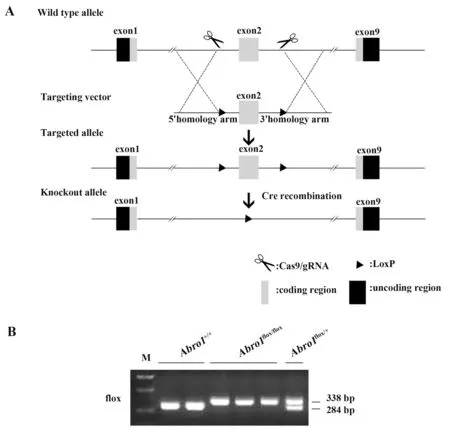
图1 Abro1flox/flox小鼠获得及鉴定Fig.1 Obtainment and identification of Abro1flox/flox mice
2.1.2Abro1flox/flox/Lyz2-Cre+小鼠获得及鉴定 为获得Abro1flox/flox/Lyz2-Cre+基因型小鼠,首先将Abro1flox/flox与Lyz2-Cre+小鼠交配获得Abro1flox/+/Lyz2-Cre+小鼠,再将其与Abro1flox/flox交配,最终获得Abro1flox/flox/Lyz2-Cre+基因型小鼠。PCR 鉴定结果显示,采用flox引物鉴定时仅扩增出338 bp 条带的小鼠基因型为Abro1flox/flox纯合子,采用Lyz2-Cre 引物鉴定时可扩增出721 bp 的小鼠基因型为Lyz2-Cre+,无条带的小鼠基因型为Lyz2-Cre-(图2A)。Abro1flox/flox/Lyz2-Cre+小鼠即为ABRO1 MKO 小鼠,Abro1flox/flox/Lyz2-Cre-小鼠在后续实验中作为WT小鼠。
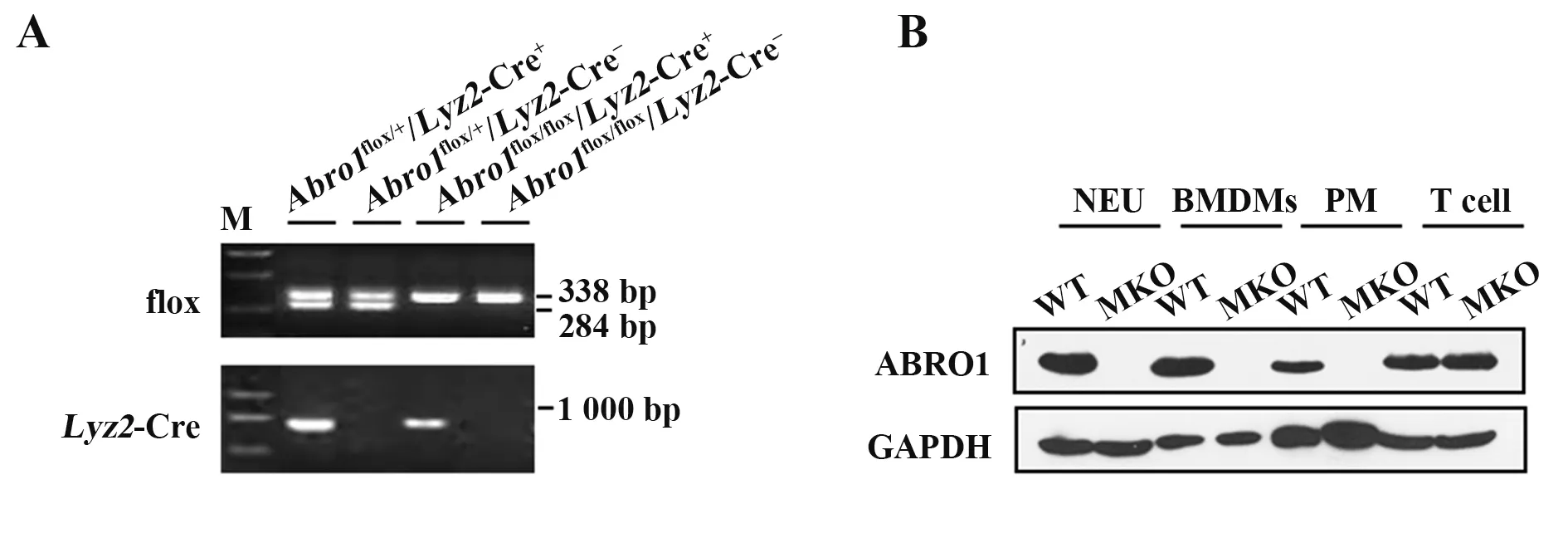
图2 髓系特异性Abro1基因敲除小鼠获得及鉴定Fig.2 Obtainment and identification of myeloid-specific Abro1 knockout mice
2.2 ABRO1 MKO 小鼠骨髓和外周血髓系细胞分化正常 由于ABRO1 MKO 小鼠在髓系细胞中特异性敲除ABRO1,因此探究其是否影响髓系细胞分化能力。流式细胞术检测WT和MKO小鼠骨髓和外周血中髓系细胞(CD11b+、CD11b+Ly6G+、CD11b+Ly6C+)和淋巴细胞(CD3+、B220+)组成,结果显示,WT 和MKO 小鼠骨髓和外周血中髓系细胞(CD11b+、CD11b+Ly6G+、CD11b+Ly6C+)和淋巴 细胞(CD3+、B220+)组成无差异(图3)。表明ABRO1 MKO 小鼠骨髓和外周血髓系细胞分化正常。
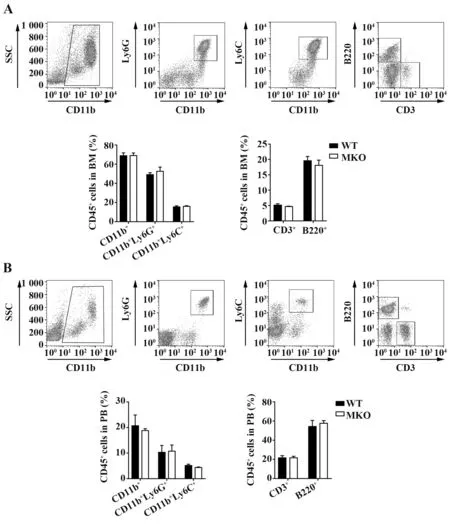
图3 流式细胞术检测ABRO1 MKO 小鼠骨髓和外周血造血分化Fig.3 Hematopoietic differentiation of bone marrow and peripheral blood in ABRO1 MKO mice detected by flow cytometry
2.3 ABRO1 MKO 小鼠抵抗LPS 诱导的败血症为阐明ABRO1 在LPS 诱导的败血症的具体分子机制,构建ABRO1 MKO 小鼠。LPS 诱导败血症实验生化指标结果显示,ABRO1 MKO 小鼠体内谷丙转氨酶(glutamic-pyruvic transaminase,GPT,又称ALT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT,又称AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)、尿素水平均低于WT 小鼠(图4A),表明ABRO1 MKO小鼠相比于WT小鼠损伤程度较低。血清中炎症因子检测结果显示,ABRO1 MKO 小鼠炎症因子IL-1β和IL-6分泌相比于WT小鼠显著减少(图4B)。LPS诱导的炎症因子风暴是导致小鼠损伤的主要原因。表明ABRO1 MKO 通过抑制小鼠炎症因子分泌进而抵抗LPS诱导的败血症。
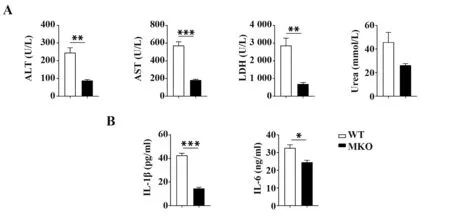
图4 ABRO1 MKO小鼠抵抗LPS诱导的败血症Fig.4 ABRO1 MKO mice resistant to LPS-induced sepsis
3 讨论
常见基因功能的研究模式包括正向研究和反向研究,即体外过表达和体内缺失[16]。基因编辑技术加速了基因功能探究,但研究过程中发现全基因敲除常导致小鼠胚胎死亡[17-18]。Cre/LoxP 系统不仅改善了小鼠胚胎致死导致的局限性,同时为在特定细胞亚群中研究基因功能提供了可能[14,18]。课题组前期研究过程中发现,Abro1全基因敲除小鼠可显著抵抗LPS 诱导的败血症以及MSU 导致的腹膜炎[12]。髓系特异性Abro1基因敲除小鼠的成功构建,为进一步揭示ABRO1 在免疫调节中的潜在机制提供了模型。
ZHENG 等[7]研究发现,ABRO1 与SHMT 蛋白结合,介导BRISC 复合体去除IFNAR1 上K63 位链接的多聚泛素链,进而启动干扰素信号通路,Abro1全基因敲除小鼠由于干扰素信号通路抑制进而抵抗LPS 诱导的败血症。但课题组研究发现,LPS 等启动信号促进ABRO1 与NLRP3 结合,这种结合依赖于NLRP3 蛋白第194 位丝氨酸(Ser194)磷酸化修饰。ABRO1 募集BRCC3 等组装形成BRISC 复合体。在ATP 等激活信号作用下,BRISC 复合体去除NLRP3 上K63 位链接的多聚泛素链,激活NLRP3 炎症小体,促进IL-1β 成熟与分泌,启动天然免疫调控[12]。课题组认为Abro1全基因敲除小鼠是由于NLRP3炎症小体活化抑制进而抵抗LPS诱导的败血症。NLRP3 炎症小体是天然免疫的关键识别器,主要表达于髓系细胞[19-20]。但IFNAR1 不仅在髓系细胞中表达,在T 细胞、B 细胞以及非免疫细胞如MEF等均呈高表达。提示髓系中特异性敲除ABRO1 可显著抑制NLRP3 信号通路活化,但对干扰素通路影响甚微[7,21]。本研究发现,ABRO1 MKO 小鼠通过减少IL-1β 分泌进而抵抗LPS 诱导的败血症,表明Abro1全基因敲除小鼠主要通过髓系细胞中NLRP3炎症小体活化抑制进而抵抗LPS诱导的败血症。
DONAGHY 等[22]研究发现,BRISC 复合体通过去除JAK2(janus kinase 2)蛋白上K63位链接的多聚泛素链,进而影响造血干细胞群稳态。Abro1全基因敲除小鼠中,HSC 增值和分化能力明显增强,外周血中白细胞数一定程度提高。但本研究发现,ABRO1 MKO 小鼠骨髓和外周血髓系细胞分化正常,可能机制为髓系细胞中特异性敲除ABRO1并不会影响造血干细胞中ABRO1 表达,但ABRO1 MKO小鼠造血干细胞稳态是否受影响仍需进一步探究。
本研究采用CRISPR/Cas9 基因编辑技术和Cre/LoxP 重组系统成功构建髓系特异性Abro1基因敲除小鼠,为揭示ABRO1在髓系细胞中的功能提供了模型[15,23-24]。目前,关于ABRO1 的功能研究主要集中于免疫调控,在非免疫细胞中的潜在作用尚不明确。Abro1全基因敲除小鼠和髓系特异性敲除小鼠联合使用也为揭示非免疫细胞中ABRO1 功能打下了坚实基础。
