嗜肺军团菌效应蛋白质介导的新型泛素化过程
2022-09-07解永超
解永超, 冯 越
(北京化工大学 生命科学与技术学院 生物技术系,北京 100029)
蛋白质是生命的基石,是生物体中最重要的生物大分子之一,几乎所有生命活动都离不开蛋白质的参与。蛋白质在细胞内外发挥多种功能,然而,蛋白质受遗传密码的限制,只由相对少量的天然氨基酸所构成,蛋白质的三级结构也仅由少量种类的二级结构组成。在某种程度上,蛋白质功能的广泛变异性可以归因于蛋白质的翻译后修饰(posttranslational modification, PTM)[1]。真核细胞内的蛋白质翻译后修饰种类繁多,目前已鉴定出超过400种类型的翻译后修饰。例如磷酸化、糖基化、乙酰化、甲基化和泛素化等[2]。通过这些修饰,改变了蛋白质的性质,细胞定位,以及蛋白质的半衰期,调控细胞内多数生理过程。其中,泛素化通常指的是将泛素以不同的连接方式,共价连接到目的蛋白质,赋予目的蛋白质不同的生理功能,从而调节大量生理过程,但也有研究证明泛素化底物是脂多糖[3]。泛素信号的功能性障碍也与许多严重疾病的有关,包括癌症、神经变性、免疫紊乱和易感染性等[4]。
鉴于泛素化过程在真核细胞的重要作用,致病菌在侵染宿主细胞的过程中,进化出大量效应蛋白质,采用多种方式,靶向宿主细胞泛素化过程中的各个阶段。例如效应蛋白质对泛素的直接修饰失活[5],对泛素结合酶E2,泛素连接酶E3活性的调控和模仿,以及发挥去泛素化酶活性靶向泛素化产物等方式,以此操控宿主细胞泛素化过程,满足病原菌自身增殖需求。嗜肺军团菌是一种革兰氏阴性菌,是军团菌肺炎的致病菌,能够引起发热和肺部感染,在1976年美国费城爆发而被鉴定,重型病死率高达15%以上[6],最近的一次爆发是在2020年的葡萄牙北部地区,病死率也高达12.5%以上[7]。本文主要以嗜肺军团菌为例,对嗜肺军团菌介导泛素化过程的效应蛋白质进行总结,且着重介绍涉及到的新型泛素化过程,同时对嗜肺军团菌效应蛋白质之间的相互调控关系进行阐述,旨在揭示嗜肺军团菌致病相关效应蛋白质与宿主泛素化过程之间的紧密联系,为人们理解以嗜肺军团菌为代表的致病菌在增殖过程中与宿主泛素化的关系提供参考。
1 嗜肺军团菌效应蛋白质与常规泛素化
1.1 常规泛素化
泛素(ubiquitin,Ub)是由76个氨基酸组成的小分子量蛋白质。泛素化过程通过一系列酶促反应进行,首先,泛素激活酶(ubiquitin-activating enzyme,E1)消耗ATP,激活泛素的C末端羧基,然后在泛素结合酶(ubiquitin-conjugating enzyme,E2)的活性位点与半胱氨酸形成硫酯键,最后,泛素连接酶(ubiquitin-ligase,E3)将泛素从E2-Ub转移到特定的底物,泛素第76位甘氨酸的羧基与底物蛋白赖氨酸(K)的ε-氨基之间形成异肽键[8](Fig.1)。蛋白质可以在一个或多个赖氨酸残基上用单泛素分子(单泛素化)或泛素聚合物(多泛素化)进行修饰。在泛素链中,泛素部分又能通过其自身赖氨酸侧链氨基(K6、K11、K27、K29、K33、K48和K63)形成异肽键,组成复杂的拓扑学结构,继而又发现了通过起始甲硫氨酸(Met1)进行连接的线性泛素链,这些泛素链也被称之为泛素代码,编码不同的生理功能[9]。泛素链(K6)被认为间接介导DNA的损伤修复[10],泛素链(K11)(K48)参与26S蛋白酶体对蛋白质的降解[11],泛素链(K27)参与DNA损伤应答以及体内免疫[12],泛素链(K29)是一种WNT信号抑制剂,同时泛素链(K48)(K63)也参与了WNT信号传递过程[13]。

Fig.1 Normal ubiquitination in eukaryotes (1)Energy is supplied by ATP.(2)The ubiquitin activator E1 transfers the activated ubiquitin molecule to the ubiquitin binding enzyme E2.(3)The ubiquitin ligase E3 connects the ubiquitin binding enzyme E2 to the target protein.(4)The ubiquitin deubiquitination enzyme digests ubiquitin products
1.2 嗜肺军团菌效应蛋白质靶向宿主常规泛素化过程
嗜肺军团菌效应蛋白质SidC、SdcA是一类新型的泛素连接酶E3,通过N端结构域发挥活性,具有Cys46-His444-Asp446催化三联体,将内质网来源的囊泡以及泛素化后的多种蛋白质招募到嗜肺军团菌液泡(Legionella-containing vacuoles,LCV)膜上,从而对宿主细胞泛素化过程进行调控[14]。最近,研究发现效应蛋白Lem27作为一种去泛素化酶,在嗜肺军团菌侵染过程中抵消SidC的影响[15]。真核细胞泛素化形成的产物,根据泛素的连接方式,可以分为8类,其中7类是通过上一个泛素的第76位甘氨酸的羧基与下一个泛素蛋白质的赖氨酸侧链氨基形成异肽键进行连接,例如K6、K11、K27、K29、K33、K48和K63。另有一类泛素链比较特殊,上一个泛素的末端羧基与下一个泛素的第1个氨基酸,甲硫氨酸(Met1)的氨基形成肽键而不是异肽键,这种泛素链称为线性泛素链[16]。多亚基泛素连接酶LUBAC催化线性泛素链的生成,调节多种细胞过程,包括激活自噬和NF-κB免疫信号[17]。致病菌已经进化出多种效应蛋白质,用不同的作用机制对其进行调控,其中一种方式是通过分泌具有去泛素酶活性的效应蛋白质,破坏宿主泛素化信号。目前,鉴定出的去泛素酶效应蛋白质,可以水解异肽链连接的多聚泛素链,例如CE蛋白酶家族(SsEL, EiaD, ShiCE, RickCE)主要针对K63型泛素链[18, 19]。嗜肺军团菌效应蛋白质LotA(Lpg2248)含有2个OTU类似结构域,主要针对K6泛素链,LotB对K63型泛素链具有高度特异性,而线性泛素链(M1)的去泛素化酶,已知的只有卵巢肿瘤相关蛋白酶(ovarian tumor-related proteases,OUT)中的OTULIN[20]。嗜肺军团菌是否已经进化出一种或多种效应蛋白质,来特异性裂解线形泛素链?朱永群课题组利用来自19个种属的43种病原菌裂解液,与线性泛素链进行体外反应,发现嗜肺军团菌的裂解液可以将泛素链K48、K63、M1裂解成泛素单体,通过149种功能未知的嗜肺军团菌效应蛋白质进行筛选,发现只有效应蛋白质RavD具有针对线性泛素链(M1)的去泛素化酶活性,同时解析了RavD与线性泛素链的复合物结构,发现了RavD独特的Cys-His-Ser催化三联体基序,通过生化实验发现,其通过C末端结构域与磷脂酰肌醇PI3P和PI4P结合,定位在嗜肺军团菌液泡(Legionella-containing vacuoles,LCV)上,然后通过N端结构域将线性泛素链切割,从而抑制NF-κB信号通路[21]。效应蛋白质LupA(Lpg1148)属于泛素类似蛋白酶(ubiquitin-like protease, UBP)家族,也含有1个传统的Cys-His-Asp蛋白酶三联体,且一旦三联体发生突变,细胞内的LegC3就可以被检测出,意味着LupA对LegC3可能具有去泛素化酶活性[22]。
2 嗜肺军团菌效应蛋白质SdeA介导的新型泛素化及其调控机制
2.1 SdeA介导的新型泛素化
嗜肺军团菌效应蛋白质SidE家族,包括4种蛋白SdeA、SdeB、SdeC和SidE,催化一种独特的泛素化过程,与真核细胞中消耗ATP的传统泛素化过程不同,不需要泛素激活酶E1、泛素结合酶E2、泛素连接酶E3的三级酶联催化,仅一个酶便可在烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)存在的条件下完成泛素化。效应蛋白质SdeA介导的泛素化过程由两步反应构成。首先,在单ADP核糖基转移酶结构域(mono-ADP-ribosyltransferase,mART)的作用下将NAD中的烟酰胺去掉,与泛素第42位精氨酸(R42)形成ADP核糖基化泛素(ADPr-Ub),然后在磷脂酶结构域(phosphodiesterase,PDE)的作用下去掉AMP,生成磷酸核糖基泛素(Pr-Ub),与底物蛋白的丝氨酸羟基形成磷酸二酯键,完成底物泛素化过程[23-25]。2018年,我们课题组率先通过X-射线晶体衍射技术解析了SdeA,SdeA-Ub以及SdeA-NADH的晶体结构,分析发现SdeAmART结构域与SdeAPDE结构域的紧密结合,构成了SdeA的催化结构域。Ub结合导致ARTT环(ADP-ribosyltransferase toxin turn-turn)和PN环(phosphate-nicotinamide loop)发生构象变化,在这一过程中,UbR72与UbR74一起发挥“探针”的功能,将Ub锚定在SdeAmART上,然后在ADPr-Ub形成过程中,UbR72和UbR42的位置发生变化,UbR72远离活性中心而UbR72靠近活性中心。我们的研究揭示了SdeA活性中心的组成并阐明其识别泛素的机制,提出了SdeA介导的泛素化过程中泛素的构象变化假设[24]。
2.2 SidJ/CaM的谷氨酰胺化活性
效应蛋白SdeA的底物多为内质网相关蛋白质,例如RTN4、FAM134B和LNP1。这些蛋白质的泛素化修饰参与内质网重构,调节内质网与高尔基体之间的物质转运过程,促进囊状结构,LCV的生物合成,使嗜肺军团菌逃逸宿主细胞的免疫系统[26]。法兰克福歌德大学Ivan Dikic课题组以去泛素化酶DupA为诱饵蛋白质,利用pull down实验,检测宿主细胞内180种SdeA潜在底物蛋白质,发现与高尔基体稳定性相关的蛋白质GRASP55 和GCP60占有较高比例,推测SdeA的泛素化活性可能与高尔基体解离相关[27]。
SdeA的泛素化活性对宿主细胞有比较强的毒性作用,过强的毒性作用并不利于嗜肺军团菌的增殖。2015年研究发现,嗜肺军团菌效应蛋白质SidJ可以在宿主体内抑制SdeA的毒性[28]。SidJ全长873个氨基酸,从N端到C端依次为N端结构域、激酶结构域和C端结构域。2016年发现SdeA介导一种独特的泛素化过程[23]。2017年有研究证明,SidJ抑制SdeA的泛素化活性[29]。2019年发现,SidJ与宿主细胞内的钙调蛋白(calmodulin,CaM)形成稳定复合物,对SdeAmART结构域的关键活性位点E860进行谷氨酰胺化修饰,使SdeAmART结构域失活,丧失毒性作用[30, 31]。由于SidJ的活性需要真核细胞内钙调蛋白的参与,因此其抑制能力在宿主细胞中受到空间限制。在无谷氨酸或SdeA的情况下,SidJ利用ATP发生自磷酸化作用。SidJ结合CaM后才具有谷氨酰胺化活性(Fig.2A),这种方式使SidJ修饰底物之前保持失活状态。

Fig.2 Structure of SidJ-CaM and alignment of PDE domain between DupA and SidE (A)Structure diagram of the SidJ-CaM complex.(B)PDE domain comparison diagram of DupA and SidE
2.3 SdjA的去谷氨酸活性
虽然SidJ-CaM复合物对SdeA(E860)谷氨酰胺化的修饰机制已经比较清晰,但仍存在一些问题,例如,SidJ/CaM是如何定位到SdeA的第860位谷氨酸?SidJ-CaM对SdeA的谷氨酰胺化修饰是否受到其他效应蛋白质的可逆修饰?2021年,Vincent S课题组通过冷冻电镜技术,解析了反应中间复合物SidJ-CaM-SdeA的结构,证明SidJ激酶结构域催化环的插入将供体谷氨酸定位在酰基腺苷酸附近以形成肽键,解释了SidJ-CaM如何定位的问题,并且证明底物特异性是由N端结构域决定[32]。嗜肺军团菌效应蛋白质SdjA与SidJ的序列和结构高度同源[33],然而SdjA的功能多年以来一直未知。2021年,我们与罗招庆、宋磊等合作证明,SdjA对SdeB和SdeC具有谷氨酰胺化活性,对SidE和SdeA并不具有这一活性,与SidJ在功能上表现出明显的差异。通过进一步研究发现,SdjA是一个双活性酶,与CaM形成复合物时对SdeB和SdeC发挥谷氨酸转移酶活性,而自身则具有将谷氨酰胺化修饰后的SdeA-Glu去谷氨酸的活性,然而,SdjA中去谷氨酰胺化活性的结构域或者氨基酸残基仍需进一步研究[34]。
2.4 DupA/DupB的去泛素化酶活性
常规泛素化是一个可逆过程,泛素化后的底物可以被去泛素化酶重新切割成泛素和底物[35]。目前,人体中约有100种去泛素化酶被鉴定出。SidE效应蛋白质家族介导的新型泛素化,催化底物丝氨酸羟基与泛素之间形成硫酯键,应该也会存在某种去泛素化酶。
最新研究表明,嗜肺军团菌效应蛋白质DupA和DupB作为一种去泛素化酶,特异性逆转SdeA介导的非常规泛素化(Fig.3)。DupA和DupB的分子量相对较小,仅由PDE结构域组成,通过PDE结构域的酶切活性将磷酸核糖基-泛素(Pr-Ub)在底物蛋白的丝氨酸上切下,是细菌感染宿主后调控多种底物磷酸核糖基泛素化的关键酶。DupA/B与SidE的PDE结构域高度相似(Fig.2B),但动力学参数却有较大差别。SidE的PDE结构域不能结合泛素化产物,即磷酸核糖基泛素连接的底物,与泛素有中度的亲和力。DupA/B的PDE结构域与泛素以及泛素化修饰后的底物都有较强的亲和力,但相对更倾向于结合修饰后的底物。当PDE(DupA/B)与修饰后底物的亲和力降低时,PDE结构域功能会向SidE的PDE结构域转化,也具有泛素连接酶活性[36]。
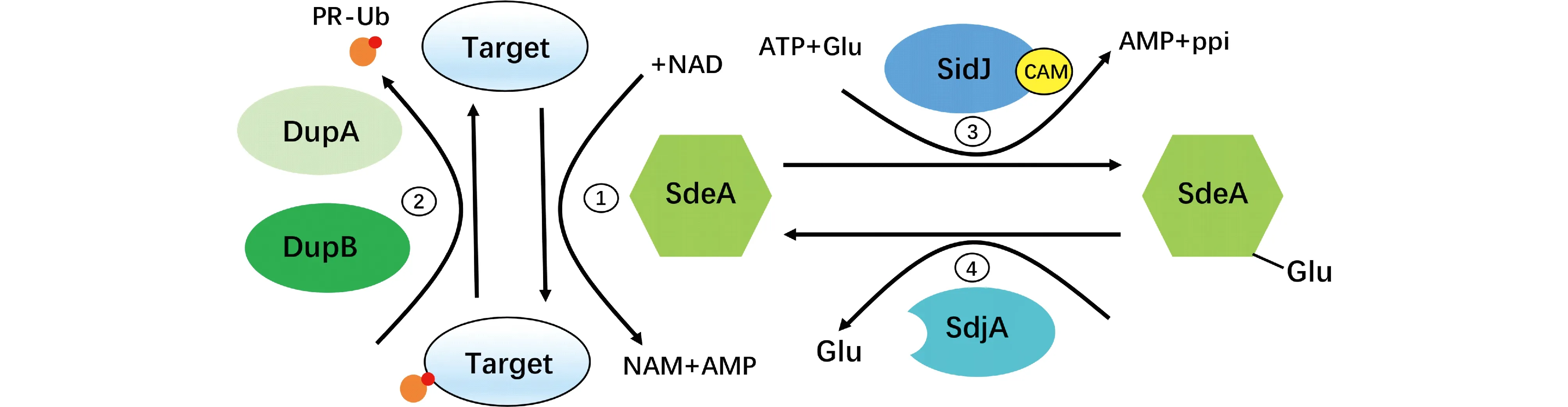
Fig.3 Regulation mode of SdeA (1)SdeA uses the NAD-mediated ubiquitination process;(2)DupA and DupB play a deubiquitination activity to digest the ubiquitination products of SdeA;(3)SdeA is modified by the SidJ-CAM complex in the presence of ATP and glutamic acid.(4)SdjA reactivated the inactive SdeA-Glu, which is modified by SidJ-CAM
3 嗜肺军团菌效应蛋白质MavC介导的新型泛素化及其调控机制
3.1 Cifs家族蛋白质
循环抑制因子(cycle inhibiting factor,Cif)家族蛋白质具有脱酰胺酶活性,在大肠杆菌的肠病原菌株和肠出血性菌株中被发现,因干扰宿主细胞周期而得名[37]。2010年有文献报道,Cif的同源蛋白CHBP是一种谷氨酰胺脱氨酶,在非变性丙烯酰胺凝胶电泳中,被CHBP处理后的泛素比野生型泛素迁移速度更快,这意味着CHBP处理后的泛素带有更强的负电荷。通过串联质谱分析,发现CHBP具有谷氨酰胺脱氨酶活性,可以将泛素以及泛素类似蛋白质NEDD8的第40位谷氨酰胺转化成谷氨酸,建立了谷氨酰胺脱酰胺作为干扰宿主细胞过程的致病策略。Cullin-RING泛素连接酶(Cullin-RING ubiquitin ligase,CRL)可以将E2连接的泛素直接转移到底物,但CRL发挥活性需要被NEDD8修饰后激活。Cif处理后的NEDD8将CRL锁定到非活跃状态,从而抑制Cullin-RING泛素连接酶的活性[38]。2012年另一篇文献解析了Cif与NEDD8的复合物结构,揭示了酶和底物之间结合的保守界面[39]。
3.2 MavC通过谷氨酰胺转移酶活性介导的新型泛素化
嗜肺军团菌通过T4SS Dot/Icm分泌系统将效应蛋白质导入宿主细胞内,调控宿主细胞生理过程。其中大量效应蛋白质通过调控宿主细胞泛素化过程,逃逸宿主细胞免疫系统,达到有利于自身增殖的目的[26]。UBE2N是宿主细胞内一种泛素结合酶E2,催化K63型泛素化链的合成,这种泛素链激活病原感染初期的NF-κB信号通路[40]。UBE2N与UBE2V1或UBE2V2形成异源二聚体,并与多种E3连接酶结合,催化k63型Ub链的延伸,对各种信号通路至关重要[41]。2018年有研究发现,嗜肺军团菌效应蛋白质MavC(Lpg2147)介导一种新型泛素化过程。MavC全长384个氨基酸,分为“主要结构域”和“嵌入结构域”,其中主要结构域又分为头部和尾部区域。MavC与Cif蛋白作用相似,是泛素的特异性脱酰胺酶,能将泛素第40位谷氨酰胺脱氨基成谷氨酸,且催化泛素与UBE2N的共价连接,从而抑制NF-κB信号通路[42]。2019年,美国普渡大学罗招庆课题组揭示了MavC发挥谷氨酰胺转移酶活性,介导新型泛素化的分子机制,鉴定出MavC的Cys74作为关键活性位点,将泛素Gln40脱氨基后与UBE2N的Lys92共价连接[43]。2020年,我们通过蛋白质晶体衍射,解析了MavC/UBE2N/Ub、MavC/UBE2N-Ub(产物)和MavC/Lpg2149三个复合物结构。通过结构分析以及生化实验,对MavC与Ub的结合方式、MavC的底物特异性、MavC识别UBE2N的机制、泛素化过程中UBE2N的构象变化等方面做了详细阐述,发现MavC对UBE2N的K92进行泛素化修饰会引起UBE2N的活性位点C87与泛素G76之间发生空间冲突,无法完成K63型泛素链的生成,从而实现NF-κB信号通路的抑制[44]。
3.3 MvcA的去泛素化酶活性
MavC对UBE2N的非典型泛素化作用可使其在k63型多聚泛素链形成中的活性消失,从而抑制嗜肺军团菌感染初期的NF-κB信号转导。但是,MavC对宿主细胞UBE2N的泛素化活性,应该也会受到某种机制的调控。嗜肺军团菌效应蛋白质MvcA(Lpg2148)是MavC的同源蛋白,同源率为50%,MvcA在基因组上与MavC相邻,并且与MavC一样,都对泛素具有脱酰胺酶活性[42]。有研究发现,MvcA在嗜肺军团菌侵染的后期可以将MavC的产物UBE2N-Ub进行去泛素化,在这一过程中,MvcA与其他脱酰胺酶具有相同的催化中心,但拥有一个独特的嵌入结构域(insertion domain),在与底物UBE2N-Ub的结合过程中发挥重要作用[43]。值得注意的是,在MavC介导的泛素化体系中,当MavC的加入量较高时,MavC本身也表现出一定的去泛素化酶活性,可以裂解UBE2N-Ub。然而在嗜肺军团菌感染宿主细胞的过程中,Ub的含量远比UBE2N-Ub的要高,简而言之,MavC主要催化非典型泛素化反应,在相反的反应中也具有弱活性,而MvcA是这种泛素化反应的专性去泛素化酶[44]。
3.4 Lpg2149的抑制机制
效应蛋白Lpg2149是一种双特异性抑制剂,抑制MavC和MvcA的脱酰胺酶活性[45, 46]。2018年,Valleau等报道嗜肺军团菌效应蛋白Lpg2149通过与MavC直接结合来抑制MavC的活性[42]。Lpg2149只在嗜肺军团菌感染初期的指数生长期可以被检测到,意味着其在开始增殖时发挥功能[43]。为了探究Lpg2149的抑制机制,我们解析了MavC-Lpg2149的晶体结构。分析发现,MavC与Lpg2149以1∶1的比例形成二聚体,Lpg2149与MavC结合后MavC的整体构象没有发生变化,但其“嵌入结构域”与“主要结构域”之间的相对位置发生变化,意味着两个结构域之间链状区域的灵活性,并且Lpg2149与泛素竞争结合MavC的同一位点,通过这种方式发挥Lpg2149的抑制作用,进一步阐明了MavC/MvcA/Lpg2149的作用及调控机制[44]。
4 问题与展望
蛋白质泛素化修饰是一种重要的蛋白质翻译后修饰,调控真核细胞内几乎所有的生理过程。泛素化不仅与真核生物的生命活动息息相关,也对病原菌侵染宿主的过程至关重要。病原菌在侵染宿主的过程中分泌大量效应蛋白质,作用方式多种多样。有的效应蛋白质直接靶向泛素,例如Cif蛋白对泛素的脱氨基活性,青紫色素杆菌效应蛋白质CteC对泛素的ADP核糖基转移酶活性[5]。有的效应蛋白质抑制泛素结合酶E2的活性,例如MavC的作用。有的效应蛋白质作为E2的模拟蛋白质,竞争结合泛素连接酶E3,例如大豆疫霉菌效应蛋白质Avr1d[47]。目前,嗜肺军团菌中已鉴定出约23个效应蛋白质与泛素化过程相关,由此可见,泛素化过程对嗜肺军团菌侵染能力的重要性[48]。其中有的效应蛋白质直接介导新型泛素化,例如SdeA和MavC。也有效应蛋白质靶向宿主泛素化产物,例如RavD(Fig.4)。这些效应蛋白质不仅对宿主泛素化过程的作用方式多种多样,对效应蛋白质自身活性也有着严格的调控,同一病原菌分泌的不同效应蛋白质之间也有协同作用。本文主要对嗜肺军团菌介导新型泛素化的几个典型效应蛋白质的结构与功能进行综述分析,一方面加深了我们对这些效应蛋白质分子机制的理解,另一方面也让我们意识到蛋白质结构与功能之间紧密而又复杂的关系。例如本文重点概述的效应蛋白质SidE与DupA,SidJ与SdjA,MavC与MvcA,他们之间的部分结构十分相似,但却介导完全相反的过程,甚至效应蛋白SdjA又受到真核细胞内钙调蛋白的调节而具有完全相反的两个活性。本文也为下一步关于病原与宿主相互作用关系的研究提供了一定的理论借鉴。

Fig.4 Legionella pneumophila effector proteins mediated ubiquitination Schematic diagram of some effector proteins associated with ubiquitination in Legionella pneumophila