链脲佐菌素联合单侧肾切除手术诱导糖尿病肾病大鼠模型的建立和评价及当归补血汤的干预作用
2022-03-23王旭马艳春赵良友朴成玉代浩然刘静吴修红
王旭,马艳春,赵良友,朴成玉,代浩然,刘静,吴修红
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
糖尿病肾病(Diabetic Nephropathy,DN)是由糖尿病引起的慢性肾脏疾病,是糖尿病常见的微血管并发症之一[1],也是导致终末期肾衰(ESRD)的首要病因[2],因此,DN的早期防治已成为亟待解决的临床问题。近年来,随着人们对DN的发生发展认识的不断深入,对其治疗药物的研究也在不断增加。在药物有效性研究中,建立适当的动物模型,可以为研究疾病的病因、发病机制以及病理、生理改变提供线索,也可为临床治疗提供理论依据[3],因此实验动物模型已成为最常用和最可靠的工具之一[4]。目前常用DN模型多为自发病模型、转基因模型、化学药物损伤模型等。既往研究表明,这些动物模型存在操作及制备技术难度大、饲养条件较为苛刻、价格贵且不易获得、成模率相对较低、模型稳定性差等问题[5],并不完全适合应用在糖尿病肾病的研究中。本研究采用链脲佐菌素(STZ)联合单侧肾切除手术,并给予脂肪乳诱导糖尿病肾病大鼠模型建立的方法,对构建动物模型的存活率、稳定性进行评估,以便为后期深入研究DN的发病机制以及干预、治疗DN药物研发提供参考和依据。
中医将DN归于“消渴”“水肿”“尿浊”“肾劳”等范畴,气虚血瘀是DN的核心病机,治宜益气养阴、健脾补肾、清热解浊、活血化瘀[6-7]。当归补血汤始载于《内外伤辨惑论》,为金元时期李东垣所著益气补血经典名方[8],方中黄芪味甘微温,善于补虚益气,能补五脏诸虚[9];当归甘辛而温,养血和营,乃“血中之圣药”[10-11],二者合投,则气血同调,共奏益气活血之功效,切中DN病因病机,与其治则相吻合[12]。本研究选用对肾脏有保护作用的AngII受体拮抗剂药物厄贝沙坦为阳性药物,通过血糖、尿量、 尿白蛋白/肌酐比值、血液及肾脏病理组织学检查等指标的改变,初步探讨当归补血汤对本研究中建立的DN模型大鼠的干预作用。
1 材料与方法
1.1 实验动物
8周龄SPF级雄性SD大鼠,体质量180~200 g,购买于辽宁长生生物技术有限公司,动物生产许可证号:SCXK(辽)2015-0001,饲养于屏障系统内。模型建立期间给予脂肪乳及维持饲料,模型建立成功后给予维持饲料。本研究的受试动物获得黑龙江中医药大学实验动物伦理委员会的批准。
1.2 试剂、药物及制备
链脲佐菌素(STZ),批号:2196,BioFrosxx;厄贝沙坦,批号:CA236,Sanofi Clir SNC;注射用青霉素钠,批号:20120325-1,哈药集团。
当归、黄芪均购于北京同仁堂药店(哈尔滨店)。经典名方当归补血汤依照本草考证,分别按黄芪当归5∶1取当归补血汤药材1 200 g,经水浸泡、煎煮、过滤、加水、再煎煮,合并两次滤液,浓缩的药液置于4 ℃冰箱中备用。
脂肪乳的制备:称取猪油160 g,加热使其融化,称取胆固醇20 g,甲基硫氧嘧啶4 g,量取吐温-80 160 mL,依次加入烧杯并充分搅拌均匀,即为油相。称取谷氨酸钠1 g,果糖5 g,蔗糖5 g置于烧杯中,加入无菌水60 mL,溶解后,再加入1,2-丙二醇60 mL,混匀,即为水相。均匀混合油相与水相后即可使用。制备模型的受试动物每日灌胃脂肪乳10 mL/kg。
1.3 主要仪器
显微镜(型号:CX31,OLYMPUS);全自动生化分析仪(型号: C311, 罗氏 );血糖测试仪(型号:HEA-232型,欧姆龙);尿液分析仪(型号:URIT-560,优利特);全自动血液分析仪(型号: XT-2000I,希森美康)。
1.4 实验方法
1.4.1 动物模型的建立
本研究采用高脂饮食+STZ+单肾切除复制DN大鼠模型,主要方法如下:选取80只SPF级SD雄性大鼠,于屏障系统内适应性饲养1周。对照组(40只)给予维持饲料,其余动物持续灌胃给予脂肪乳4周,灌胃给予脂肪乳2周后进行单肾切除手术,恢复1周后大剂量腹腔注射1次STZ(40 mg/kg)。
单侧肾切除手术方法:腹腔注射3%的戊巴比妥钠溶液,待受试动物麻醉后,腹部去毛消毒,在平行于肾脏的腹部中线位置剪开2 cm左右的切口,游离出右肾,用止血钳夹住其远端血管,用可吸收线进行结扎,祛除肾脏并缝合伤口,每只受试动物肌注青霉素钠2万U,2次/日,连续1周。
动物模型验证:造模结束72 h后测尾静脉血糖,以随机血糖(randomplasmaRBGcose,RPG)≥16.7 mmol/L为糖尿病模型成立标准,7 d后再次检查RPG,结果稳定的受试动物确定为DN大鼠模型成立。评估糖尿病模型是否成功,记录死亡动物数量。当DN大鼠模型成功后,时间设为0点,继续观察4、6、8周。
按照随机分组的方法,模型评价实验分为对照组、0周组、4周组、6周组及8周组,其中对照组给予维持饲料,其余组给予脂肪乳及维持饲料,自由饮食;当归补血汤干预实验分为对照组、DN模型组、当归补血汤组(DBD组)、厄贝沙坦组,每组10只,均给予维持饲料。
1.4.2 当归补血汤干预方法
DBD组灌胃给予4.2 g/kg的当归补血汤,灌胃体积为0.1 mL/10 g,对照组及DN模型组给予等体积的蒸馏水,给药期分别为4、8周,给药期间记录动物一般状态;实验期结束后,进行检测相关指标、取材。
1.4.3 检测指标
称取所有受试动物的各时间点体质量、单侧肾脏重量,并计算单肾体比。取尿液,检测所有受试动物各时间点的尿白蛋白(Urine albumin)及尿肌酐(Urine creatinine),并计算尿白蛋白与尿肌酐的比值(UACR);取血清或全血,检测所有受试动物各时间点的总胆固醇(TC),甘油三酯(TG)、随机血糖(RPG)等指标。
1.4.4 病理学检查
取出各组大鼠同一侧肾脏,用甲醛固定液固定保存。固定一周后进行修块,再置于包埋框中再次固定12 h。固定好的组织依次进行脱水、透明、石蜡包埋;包埋后的组织使用切片机进行5 μm石蜡切片、捞片、过夜烘片,切片置于自动染色机进行HE染色,于封片机中封固后,采用光学显微镜进行肾脏组织病理变化的检查。
1.5 统计学方法
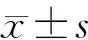
2 结果
2.1 DN模型制备
2.1.1 体质量与摄食量情况
对照组大鼠在模型建立期间体态正常,活动自如,毛发光泽,体质量增长正常,食欲良好;如表1所示,造模组大鼠的体质量在造模第2周开始增长缓慢,与对照组比较,第3、4、5周的体质量显著降低(P<0.01);造模组大鼠的摄食量在造模第3周开始降低,与对照组比较,第3、4、5周的摄食量显著下降(P<0.01)。

表1 造模期间大鼠摄食量与体质量的变化
2.1.2 成模率
造模组共40只大鼠,单侧肾切除手术中,死亡2只;STZ注射后,死亡1只;按照随机血糖(randomplasmaRBGcose,RPG)≥16.7 mmol/L为的标准,3只大鼠未合格,予以剔除。成模率为85%。
2.2 DN模型稳定性
2.2.1 一般状况及肾体比
对照组大鼠在成模期间体态正常,体质量平稳增长,活动自如,毛色光泽,食欲良好;模型组大鼠一直伴有多饮多食多尿且少体质量的糖尿病典型症状,且皮毛蓬松,活动减少;如表2所示,在成模的各个时期,与对照组比较,模型组的体质量均显著降低(P<0.01),且呈下降趋势,模型组的摄食量均显著升高(P<0.01),且呈上升趋势,模型组的尿量及肾体比均显著升高(P<0.01),并保持平稳上升。

表2 成模期间大鼠尿量与肾体比的变化
2.2.2 肾脏及血液指标
与对照组比较,模型组受试动物的UACR、UREA、TG、CHOL、RBG等指标均有显著升高(P<0.01),且随着成模时间的增加,模型组以上各个指标均有平稳上升,见表3。

表3 各组大鼠UACR及血液生化学指标的变化
2.3 当归补血汤对DN大鼠模型的干预作用
2.3.1 一般状况
对照组的受试动物在给药前与给药期间,步态正常,活动自如,被毛有光泽,食欲良好、粪便颜色正常、体质量增长正常,无死亡动物。给药前,各个模型组的受试动物出现多饮多食多尿及低体质量,有活动减少、被毛蓬松等症状。给药期间,DN组受试动物出现体型消瘦严重、被毛杂乱无光泽、尿量明显增加等症状,在干预4周及8周实验中分别死亡2只、3只。DBD组的受试动物体质量有所改善,活动增加,且给药8周的受试动物体态好于给药4周的受试动物,尿量依旧较多,相对少于DN组受试动物的尿量,无死亡动物。
2.3.1 当归补血汤对DN大鼠模型的体质量及肾体比的影响
当归补血汤干预给药4、8周后,DN模型组的体质量与对照组比较均有明显下降(P<0.01),肾体比与对照组比较均有明显增加(P<0.01);与DN模型组比较,DBD组、厄贝沙坦组的体质量均有所升高(P<0.05),与DN模型组比较,DBD组、厄贝沙坦组的肾体比均有所下降(P<0.05,P<0.01);DBD组的体质量与肾体比与厄贝沙坦组比较,差异无统计学意义(P>0.05),见表4。

表4 当归补血汤对大鼠体质量及肾体比的影响
2.3.2 当归补血汤对DN大鼠模型的UACR及血液生化学指标的影响
当归补血汤干预给药4、8周后,与对照组比较,DN模型组的UACR、UREA、TG、CHOL、RBG均有不同程度的增高(P<0.01,P<0.05);与DN模型组比较,DBD组的UACR、UREA、TG、CHOL、RBG均有不同程度的降低(P<0.01,P<0.05),厄贝沙坦组的UACR及UREA均有不同程度的降低(P<0.01,P<0.05),厄贝沙坦组的TG、CHOL、RBG差异均无统计学意义;与厄贝沙坦组比较,DBD组的UACR、UREA差异无统计学意义,见表5。

表5 当归补血汤对大鼠UACR及血液生化学指标的影响
2.3.3 病理组织学检查
如图1所示,对照组肾脏组织未见异常,肾小管上皮细胞大小正常,排列整齐,无明显的细胞增殖,肾小囊结构完整,轮廓清晰,肾小球形状规则,无肥大或萎缩。当归补血汤干预4周实验中,DN模型组大鼠肾脏组织肾小管变性坏死,肾小管上皮细胞核肿胀,炎性细胞浸润严重,DBD组肾小球轻微肿胀、血管充血,肾小球囊腔变小,厄贝沙坦组肾小管上皮细胞轻度萎缩;当归补血汤干预8周实验中,DN模型组大鼠肾脏组织肾小管上皮细胞变性萎缩,DBD组肾小管上皮细胞伴有轻度变性萎缩,厄贝沙坦组肾脏组织未见异常。各组受试动物肾组织病理学检查从正常到病变的严重程度依次为对照组、厄贝沙坦组、DBD组、DN模型组,且病变程度随着干预时间的增加而减弱。
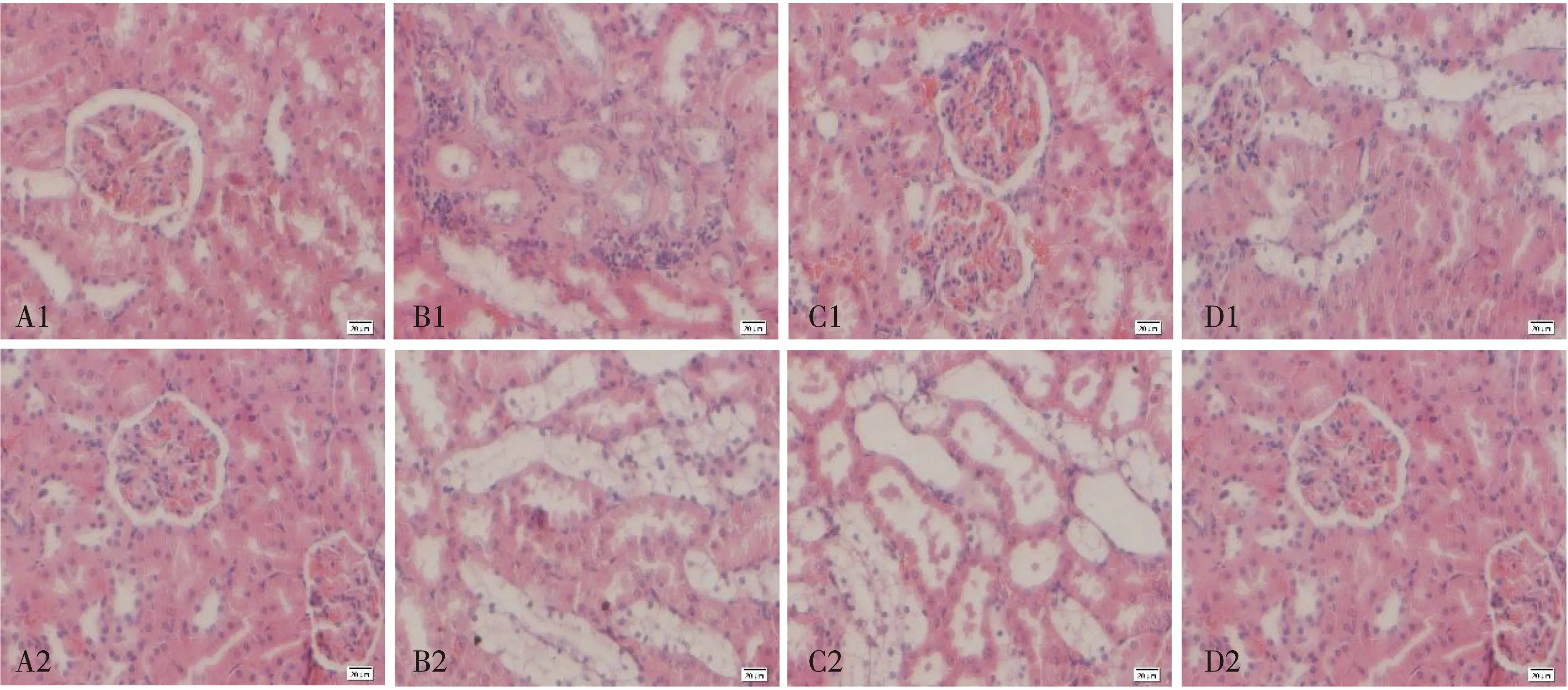
注:A.对照组;B.DN模型组;C.DBD组;D.厄贝沙坦组;1.干预4周;2.干预8周。图1 当归补血汤干预的不同组大鼠肾组织HE染色(×200)
3 讨论
DN的发病机制复杂,目前认为可能与线粒体功能紊乱,炎症反应及氧化应激等有关[13-14]。近年越来越多的研究结果显示,在病理状态下,脂肪组织可异位沉积于非脂肪组织,导致异位脂肪沉积,引起脂代谢紊乱[15]。糖尿病状态下,体内游离脂肪酸(FFA)氧化分解异常,引起肾脏脂代谢紊乱[16],进而通过多种途径引起肾脏的功能细胞损伤,促进 DN 发生发展。DN相关药物研究中常用的动物模型为腹腔注射STZ诱导的糖尿病(DM)模型,使其自发形成糖尿病并发症—糖尿病肾病,但是缺点是成模时间长,成模率低,不能很好地适用于DN研究[17]。本研究以灌胃脂肪乳结合腹腔注射STZ,模拟高糖、高脂状态,联合单侧肾切除手术,加速DN形成过程,减少造模时间,节省实验成本的同时,可以提高成模率。在本研究造模的第2周,体质量开始呈下降趋势,分析是由于进行单侧肾切除术手术后,对实验动物创伤较大,结合摄食量的减少导致多数体质量下降。在造模过程中死亡3只大鼠,其中单侧肾切除手术死亡2只,分析是手术过程中,对肾脏结扎不够牢固,导致实验动物失血过多死亡,应提高手术操作技能,减少动物死亡数量;在注射STZ后死亡1只,可能由于注射后实验动物短期低血糖,导致动物死亡,可在腹腔注射后第一天的饮水里适量加入蔗糖,并及时给予饲料,或改为连续两次注射小剂量注射STZ,以减少动物死亡数量,提高成模率。DN模型制备成功后,在对模型的连续观察的8周过程中,模型组持续出现多饮多食多尿且高血糖的糖尿病症状,且症状持续稳定,UACR、UREA的水平随着时间的增加,严重程度也逐渐增加;由于脂肪乳的给予,动物模型的TG、CHOL水平较对照组明显升高,但由于成模后并未继续给予脂肪乳,动物模型的TG、CHOL水平基本保持不变。通过以上实验结果说明,本研究通过灌胃脂肪乳及腹腔注射STZ联合单侧肾切除手术建立的DN大鼠模型,具有成模率较高,死亡率低,DN症状的稳定性、持续性较好的特点,更适用于需长期用药,且通过改善脂代谢紊乱减缓DN发生发展的相关中药研究。
在课题组的前期研究中发现,当归补血汤可改善气血双虚DN大鼠的肾功能,对肾脏具有保护作用[18]。结合当归补血汤可调节大鼠的血脂水平及临床上改善DN病人血脂水平的文献报道[19-20],课题组对当归补血汤作用于本研究中建立的DN模型的血液生化学及肾功能相关指标进行了初步的探讨。结果表明,本研究中的DN大鼠模型通过当归补血汤的干预可降低血糖、调节血脂,改善肾功能,起到改善肾组织损伤的作用,从而有效控制DN的发展。但本研究也存在些许不足,由于厄贝沙坦是通过降低血压减少尿蛋白和延缓肾功能恶化,从而起到肾脏保护作用,并无降低血糖及血脂的作用,因此在当归补血汤对大鼠血液生化学指标的影响中,出现了厄贝沙坦组受试动物的TG、CHOL、RBG等指标与模型组比较无统计学差异的结果,在之后的研究中,应选择厄贝沙坦结合具有降血糖血脂的药物作为阳性药,提高实验的精确度。由于初步探讨当归补血汤的干预作用,只设计了一个给药剂量,应增加实验剂量组,更好地确定当归补血汤的有效作用剂量,并对其降低尿白蛋白排出及血脂水平的相关分子机制进行深入研究,对中医药早期干预和延缓DN的进展具有积极的意义。
