先天性心脏病婴儿术后中心静脉置管血栓形成的影响因素△
2022-03-22孙云霞王一飞余宇晖邹有群
王 碧,孙云霞,王一飞,钟 劲,余宇晖,邹有群,庄 建
[1.广东省人民医院(广东省医学科学院)新生儿科,广州 510080;2.广东省人民医院(广东省医学科学院)心外科,广州510080]
随着危重症患儿救治水平的提高,中心静脉置管(central vein catheter,CVC)在儿童中的应用逐渐增多。维持CVC 通畅是保证包括先天性心脏病(congenital heart disease,CHD)在内的重症患儿能够得到及时、有效的评估和治疗的关键因素之一。CVC 血栓形成,甚至堵管问题,直接影响了这些患儿的救治。由于婴幼儿存在先天凝血功能异常,再加上血管细,使用的CVC 管径小,加大了维护的难度[1-2]。同时,由于血栓形成需要通过超声或血管造影诊断,目前床旁超声评估CVC 血栓在儿童重症监护室尚未普及,而血管造影的有创性也限制了对血栓的评估[3]。目前对CVC 血栓的形成及其机制报道较少。本研究拟通过对CHD 患儿术后CVC 进行床边超声评估,了解CVC 血栓形成的机制,进而指导重症患儿CVC的管理。
1 资料和方法
1.1 一般资料
本研究前瞻性对2020 年6 月1 日至9 月30 日在广东省人民医院进行CHD 手术并转回新生儿重症监护病房的CVC 患儿进行管道通畅及血栓形成评估。纳入标准为CHD 术后转入时留有CVC的患儿。排除标准为所有年龄大于3 个月、转入时已经使用肝素等抗凝药物或因凝血功能异常即将使用抗凝药物的患儿。根据是否存在CVC 血栓,将入组患儿分为CVC 血栓形成组和CVC 无血栓组。本研究已经本院医学伦理委员会批准。由于本研究未对患儿产生有创影响,按照伦理免知情同意的相关条款,本研究仅获得患儿家长的口头同意,无书面知情同意书。
1.2 评估指标
主要评估指标包括主管护士每天评估管道通畅,一名具有资质的超声检查人员在患儿转入本科时、护士汇报管道不通畅时、CVC 7 d 和14 d 及拔管前后评估CVC 周围血栓形成情况以及血栓脱落出现栓塞的情况。评估血栓所使用的B 超机为迈瑞医疗M9 便携式多普勒超声系统。探查部位包括双侧颈内静脉、锁骨下静脉、股静脉及心脏内、导管壁内/外/尖端。所有接受体外循环的手术患儿在手术中均使用肝素维持血液低凝状态,术后使用鱼精蛋白拮抗肝素效应至活化凝血时间结果恢复到正常范围。
其他评估指标还包括血栓形成的时间,形成部位,CVC 并发症(发热、败血症、任何部位的出血、静脉炎、血小板减少),堵管再通情况,形成血栓后肝素治疗的并发症(凝血功能异常、肝素相关性血小板减少症、脑室出血3~4 级)。此外,还包括患儿的一般情况、CVC 部位、手术前后凝血功能、D 二聚体和血小板水平、管道使用情况。凝血功能异常为活化部分凝血活酶时间(APTT)或凝血酶原时间(PT)检查结果>正常值上限×150%(活化部分凝血活酶时间>67.5 s 或凝血酶原时间>21.9 s);血小板降低定义为<100×109/L;CVC 相关败血症为存在感染的临床症状且血培养阳性,同时CVC末端培养和血培养培养出同一菌株。
转入后的常规治疗:对于没有血栓的CVC,常规0.9%氯化钠溶液每条通道0.5 mL/h 持续24 h维持,直至拔除CVC。对于存在血栓的CVC,中小剂量肝素[10~15 U/(kg·h)]维持,维持活化部分凝血活酶时间在60~70 s,之后根据监测的血栓变化情况,由临床医生决定肝素的调整,直至拔除CVC。
1.3 统计学分析
符合正态分布的计量资料以()表示,使用t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1~Q3)]表示,使用秩和检验。计数资料采用[n(%)]表示,使用卡方(χ2)或Fisher精确检验检测。所有单因素分析时P<0.2 的变量将纳入多因素Logistic 回归分析。以P<0.05 为差异有统计学意义。以上数据处理及统计分析均使用SPSS 21.0 完成。
2 结果
总共93例CHD患儿完成手术转入本科。26例患儿未纳入分析,包括12 例已经参加了肝素预防手术部位狭窄项目的完全性肺静脉异位引流(TAPVC)术后、8 例年龄超过3 个月、4 例因B-T 分流手术或体外膜肺氧合(ECMO)治疗后需要肝素维持和2 例因其他原因使用了肝素治疗的患儿。67 例纳入研究的患儿中,男性39 例(58.2%),手术日龄为(46±32)d,手术体质量为(3 132±893)g。22 例(32.8%)患儿有血栓形成,无血栓脱落相关并发症,无使用肝素不良反应。其中,2例出现血栓堵管,20 例超声心动图发现CVC 血栓形成。堵管时间分别为术后第1 天和术后第4 天。术后第1 天堵管的患儿(手术时体质量为2.67 kg)室间隔缺损修补、动脉导管结扎术使用3 腔3.5Fr CVC 管道,术后查D 二聚体>20 000,需要给予肝素维持治疗。术后第4 天堵管的患儿(手术时体质量为3.04 kg)完全性大动脉转位调转术使用3腔3.5FrCVC 管道,术后查凝血功能异常,曾使用血浆治疗。20 例出现CVC 血栓的患儿中,术后第1、2、3、4、5、6、>7 天发现存在血栓的例数分别为5、4、1、5、1、2 和2 例。其中,13 例为转入时出现血栓。
血栓形成组和无血栓组患儿的一般情况见表1。单因素分析显示,在年龄<3个月的CHD手术患儿中,CVC 时间、术后凝血功能异常和术后D 二聚体水平在两组间差异有统计学意义(P<0.05)。性别、出生胎龄、出生体质量、手术年龄、置管部位、管腔数量、转入时间、血小板降低、CVC 相关感染在两组间比较,差异无统计学意义(P>0.05)。虽然,CVC 血栓形成患儿的手术时体质量偏轻、体外循环比例偏高,但两组间比较,差异也无统计学意义(P>0.05)。多因素回归分析结果显示,术后凝血功能异常(OR=20.6,P=0.021)和体外循环(OR=32.7,P=0.048)是导致血栓形成的高危因素(表2)。
表1 CHD 术后两组患儿一般情况的比较[n(%),]

表1 CHD 术后两组患儿一般情况的比较[n(%),]
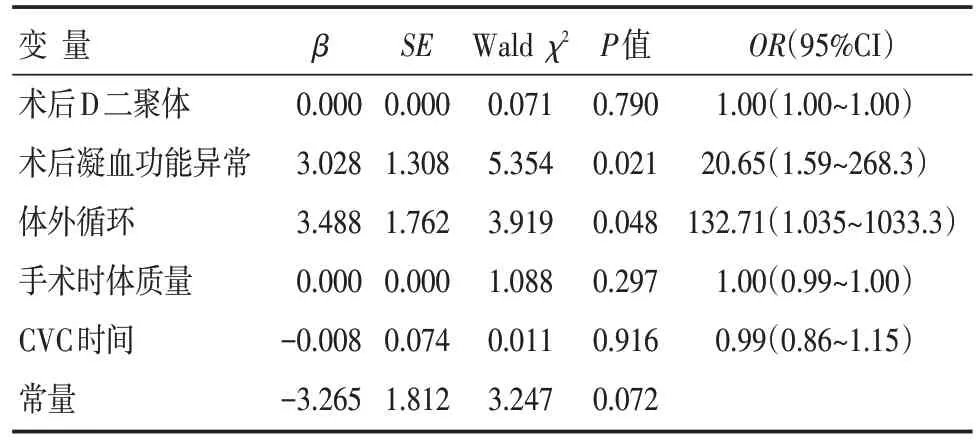
表2 CHD 术后CVC 血栓形成危险因素的多因素Logistic 回归分析结果
3 讨论
CVC 血栓形成是影响危重症患儿CVC 使用的重要因素之一,目前有关报道较少。本研究结果显示,CHD 术后患儿CVC 血栓形成率为32.8%,且血栓多在置管1 周内发生。凝血功能异常和体外循环是导致血栓形成的独立危险因素。
血栓形成是导致CVC 无法正常使用的重要因素。严重的血栓形成或脱落可能会导致血管通道的丧失、反复血栓形成、肺栓塞、门静脉高压、高血压、感染、血栓后综合征甚至死亡[1]。目前的研究显示,婴幼儿CVC 血栓形成率波动于10%~40%,且和置管的部位及置管的种类密切相关[4-5]。Shah等[4]对201 例新生儿进行的血栓形成研究中,20%的患儿出现血栓。Hanslik 等[5]更是使用静脉血管造影及超声检查对90 例CVC 患儿进行血栓形成评估,血栓形成的发生率为28%。本研究共纳入了67 例CHD 术后患儿,CVC 血栓的发生率为32.8%。然而,并非所有单位的CVC 血栓的发生率都高。波士顿儿童医院Stein 等[6]的研究显示,该院CVC相关血栓的发生率仅为3.1%。这就提示,CVC 血栓的发生是可以防控的[7]。
在CVC 血栓形成的影响因素中,基础疾病、血管直径、置管时间、置管类型以及管道中使用的药物都是高危因素。白血病患儿中,CVC 相关血栓发生率可高达66%[8]。Male 等[9]发现,从身体左侧置管和从锁骨下静脉置管的血栓发生率会增高3 倍多(53%vs.14%)。而Stein 等[6]对比CVC 经手术置入心房内和深静脉穿刺置入心房内后发现,经手术置入CVC 的方式血栓的发生率更低(0.9%vs.16.7%)。吴开元等[10]的研究显示,术后危重评分、乳酸峰值和心脏病类型是CHD 婴幼儿术后下肢静脉血栓形成的高危因素。周益平等[11]的研究显示,D 二聚体是深静脉血栓筛查的重要指标。本研究的患儿常合并凝血功能异常、围术期动静脉置管和大量血制品的使用。而且,本研究中绝大多数患儿均在手术中使用了体外循环技术,该技术会加重血管内皮细胞损伤和促进血栓形成[12-13]。虽然单因素分析中,血栓组D 二聚体明显升高,但多因素回归分析结果显示,在本研究人群中,凝血功能异常和体外循环是导致血栓形成的独立危险因素。此外,与其他研究不同,本研究人群暴露在包括小婴儿、CHD、凝血功能异常、体外循环等多种危险因素下,这可能就是本研究中血栓形成时间比其他研究早的原因。
在CVC 并发症方面,血栓相关症状最受关注,表现为局部肿胀、发红、苍白、皮温升高、疼痛和触痛、上腔静脉综合征、侧支静脉形成、管道堵塞、不明原因的血小板减少等。目前报道的血栓相关症状的发生率波动于3%~20%。Male 等[9]对85 例进行白血病化疗的CVC 儿童进行前瞻性研究的结果显示,4 例(14%)存在血栓相关症状。Hanslik 等[5]对90 例有CVC 的CHD 患儿的研究中,5 例(20%)出现包括局部红肿、疼痛或血管堵塞在内的相关症状。Jarvis 等[8]更是报道,5 例(10.6%)出现血栓相关症状的白血病患儿中,1 例出现肺栓塞和1 例出现大脑静脉窦血栓。Massicotte 等[14]对CVC儿童进行的前瞻性研究显示,6 例(3.5%)出现血栓相关症状。本研究中,2 例(3.0%)出现堵管情况,但未发现其他血栓相关症状。此外,导管相关性感染也是研究者关注的重点。Shah 等[4]的研究中,感染的发生率为3.5%。Male 等[9]报道1 例(1.2%)出现感染。Hanslik[5]报道,90 例中无一例感染。Stein[6]报道,98 例中1 例感染。Mushtaq[15]报道,10 例(3.5%)出现导管相关败血症。与以上研究的发病率类似,本研究中,2 例(3.0%)出现导管相关败血症。Tian 等[16]的Meta 分析更显示,CVC 相关感染会使血栓形成的风险增加2.66 倍。
本研究也存在不足之处:(1)本研究仅纳入CHD 术后患儿。该研究结果能否外推至其他重症儿童仍需进一步研究;(2)本研究仅纳入年龄<3 个月患儿,无法区分出不同CVC 管径对血栓形成的影响;(3)本研究未纳入CVC 穿刺困难的情况,而多次穿刺造成的血管内皮细胞损伤可能会影响血栓的形成[10]。
综上所述,本研究结果显示CHD 术后患儿CVC 血栓发生率较高。凝血功能异常和体外循环都会增加血栓形成风险。对比国外高水平医疗机构的血栓低发生率,提高围术期CVC 的精细管理可能能够减少CVC 相关血栓的形成。
利益冲突:所有作者均声明不存在利益冲突。
