癫痫模型大鼠心肌组织钠氢交换体1的表达及与凋亡的关系
2022-03-18谢懂君郑乾彭爽马鹏飞吴旭玲于云莉徐祖才马勋泰冯占辉
谢懂君,郑乾,彭爽,马鹏飞,吴旭玲,于云莉,徐祖才,马勋泰,冯占辉
癫痫是神经内科常见疾病,慢性癫痫发作常常给患者生理和心理造成巨大影响,癫痫猝死(sudden unexpected death in epilepsy,SUDEP) 就是最严重的一类损害,虽然临床很难诊断,但是在癫痫领域得到更多学者的关注,也在尝试找到更好的方式开展相关研究[1-2]。有关SUDEP的研究更多地集中在个案研究,有学者报道心律失常可能与SUDEP密切相关,也有报道称呼吸抑制也是重要的原因,在深入的机制研究中,也有报道SUDEP患者离子通道存在异常,例如有Na+通道异常和K+通道异常等,这些离子通道功能障碍最终可导致猝死[3-4]。Van等[5]报道癫痫发作患者和非癫痫发作患者心律失常存在差异,认为癫痫组患者更容易出现心脏停搏,房室传导阻滞,房颤、室颤等,且癫痫患者猝死的可能性比正常人更高。
钠氢交换体1(sodium hydrogen exchanger 1,NHE1)是NHE家族的成员之一,其作用非常重要,可调节细胞内的酸碱平衡,维持细胞的基本生理功能[6]。NHE1激活与细胞内的酸性环境密切相关,随着PH值的降低,功能逐渐增强;然而随着NHE1功能增强,也会导致Na+逐渐内流,从而促使神经元和心肌细胞的兴奋性增高。Na+过度内流可导致细胞内钠钙交换体过度激活,从而促使Ca2+过度激活,而Ca2+信号可以加剧细胞的凋亡和坏死[7]。目前在患者反复癫痫放电的情况下,心肌细胞内NHE1的表达特点以及心肌细胞凋亡情况鲜见报道。基于此,课题组建立慢性癫痫动物模型,在模型成功后的第60天,检测慢性癫痫动物模型心肌细胞的NHE1表达以及凋亡情况,为NHE1是否参与心肌细胞的凋亡提供依据。
1 材料与方法
1.1 实验动物及分组
选取雄性SD大鼠40只,其中22只采用腹腔注射氯化锂-匹罗卡品构建癫痫模型作为模型组;18只采用腹腔注射生理盐水作为对照组;建立模型第60天后,进行蛋白印迹(Western-blot)、逆转录聚合酶链式反应(RT-PCR)和流式细胞仪检测。
1.2 实验设备及试剂
NHE1抗体(美国Abcam);β-actin抗体(美国Affinity);地西泮10 mg/2 mL(成都 倍特公司);匹罗卡品,氯化锂(美国Sigma公司);山羊抗兔二抗(中杉金桥);RNAisoPlus和PrimeScript®逆转录试剂盒(日本TakeraBio);化学发光显色试剂(ECL,美国Pierce);SuperMaze动物行为视频分析系统(上海欣软信息);PM20自动显微镜(日本奥林巴斯)。
1.3 模型制作
按文献[8]建立癫痫大鼠模型,腹腔注射氯化锂,剂量为127 mg/kg,20 h后腹腔注射硫酸阿托品,剂量为1 mg/kg,30 min后腹腔注射匹罗卡品,剂量为50 mg/kg,用药后观察大鼠行为学改变,以Racine分级作为标准。Racine Ⅳ级及以上发作持续1 h后,应用地西泮,剂量为10 mg/kg,必须终止癫痫发作。对照组采用等量生理盐水注射[8]。
1.4 Western blot方法
取模型组和对照组大鼠各6只,在自发性痫性发作开始第60天,应用10%水合氯醛,剂量为300 mg/kg,麻醉后断头处死,快速分离心肌组织,置于液氮中快速冷冻,然后储存于-80 ℃冰箱中。
取心肌组织提取蛋白(按试剂盒要求),检测蛋白浓度,提取50 μg蛋白进行电泳,然后电转到于8%SDS-PAGE上电泳,电转到聚偏二氟乙烯膜上;室温5%BSA孵育聚偏二氟乙烯膜1.5 h,加入兔抗大鼠NHE1(1∶4 000)和β-actin(1∶1 000)孵育聚偏二氟乙烯膜4 ℃过夜;第二天室温下孵育NHE1膜,加入二抗(1∶5 000)孵育2 h。加入增强型化学发光试剂显色试剂对蛋白条带进行显影。用QuantityOne4.6.2软件分析NHE1的相对含量,β-actin作为内参[9]。
1.5 RT-PCR检测方法
第60天取模型组和对照组大鼠各6只,采用RT-PCR方法检测心肌NHE1mRNA的表达。按试剂盒说明书,提取总RNA,应用分光光度法测定RNA浓度和纯度。采用逆转录试剂盒合成cDNA。由TakaraBio设计合成RT-PCR引物。选择GAPDH为管家基因:顺义链5'-CCCCCAATGTATCCGTTGTG-3',反义链5'-TAGCCCAGGATGCCCTTTAGT-3';大鼠NHE1基因:顺义链 5'-GCGGCGAGCAGATCAATAA-3',反义链 5'-ACAGTGACGGCATCGTTGAG-3'[8]。
1.6 流式细胞检测方法
取1 g心肌组织滤纸拭干,生理盐水反复洗涤两次,然后用小剪刀快速将心肌组织剪碎,大小约1~3 mm3;然后加入0.25 g/100 mL的胰蛋白酶5 mL进行消化,然后采用恒温水浴,时间30 min,其间间断振荡3 次;然后用尼龙网过滤,过滤后放入离心机,以800 r/min离心,将沉淀用冰盐水洗2次,再次离心;丢弃上清液,放入70%乙醇中固定,再次离心,将上清液丢弃,用冰生理盐水漂洗2次,保证细胞数在1×106个/mL,加入碘化丙啶染液1.0 mL,然后置于4 ℃恒温箱中30 min,然后检测。
1.7 统计学方法
2 结果
2.1 模型制作情况
雄性SD大鼠40只,其中22只采用腹腔注射氯化锂-匹罗卡品构建癫痫模型作为模型组,制作模型过程中死亡3只,死亡率为14%。另18只采用腹腔注射生理盐水作为对照组,无死亡。
2.2 Western-blot结果比较
第60天模型组大鼠心肌细胞NHE1蛋白表达较对照组明显增高,差异有统计学意义(P<0.05),详见图1。
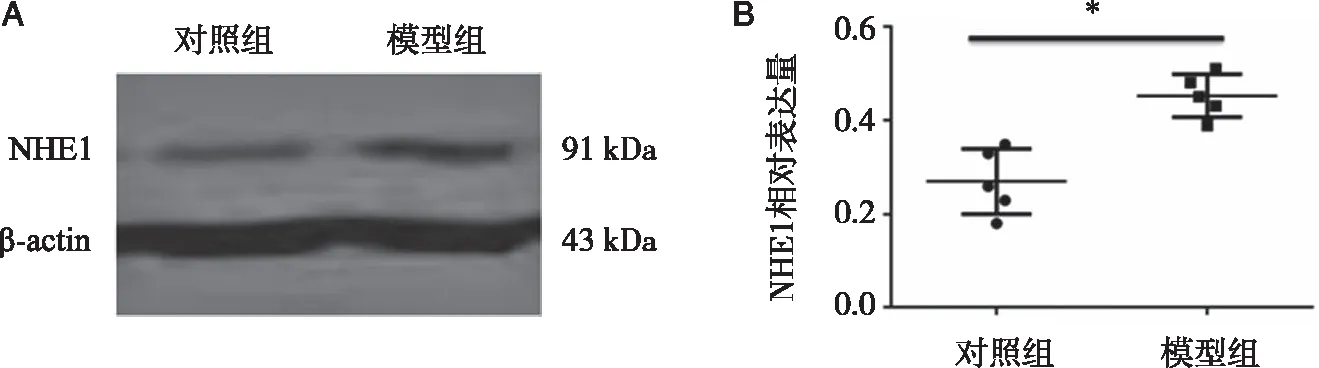
图1 模型组和对照组大鼠第60天时心肌细胞NHE1蛋白的表达
2.3 RT-PCR检测结果比较
RT-PCR检测结果显示,与对照组比较,模型组大鼠心肌细胞NHE1mRNA水平升高,差异有统计学意义(P<0.05),详见图2。

图2 模型组和对照组大鼠心肌细胞NHE1mRNA的表达
2.4 流式细胞检测结果比较
经流式细胞检测结果显示,模型组大鼠心肌细胞凋亡较对照组明显增加,差异有统计学意义(P<0.05),详见图3。
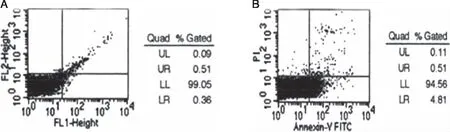
图3 模型组和对照组大鼠心肌组织凋亡情况
3 讨论
癫痫属于神经科第二大疾病,多以反复抽搐为临床表现,癫痫发作中可以导致SUDEP。然而导致SUDEP的机制目前尚不清楚,为进一步探讨慢性癫痫患者心肌细胞是否出现异常,本研究制作了慢性癫痫鼠模型,分析在慢性癫痫模型鼠第60天时心肌细胞的凋亡情况,以期明确NHE1的表达特点以及细胞凋亡情况,基于心脏病变机制从而为癫痫慢性发作导致SUDEP提供依据。本研究结果显示,模型组大鼠心肌细胞NHE1蛋白和mRNA表达均增高,同时也发现心肌细胞凋亡较对照组明显增加。
NHE1属于心肌细胞膜蛋白,在心肌细胞中表达最为广泛[10]。该蛋白的主要功能是调节细胞内酸碱平衡,维持细胞内的稳态。在大脑皮层神经元,NHE1主要是因为神经元内pH值降低而被激活[11]。当神经元呈酸中毒时,NHE1被激活,将H+排出,Na+摄入进来,以此恢复神经元内生理pH值[12]。本研究在模型鼠心肌细胞也发现了类似的特征,NHE1蛋白及mRNA均表达增高,提示在癫痫反复发作的情况下,NHE1通过激活不断调节心肌细胞的酸碱平衡,这与Leineweber等[13]的结果一致。基于上述研究结果,可以推测在癫痫反复发作的情况下,心脏也不断受到影响,心律失常也可能出现,NHE1可以通过调节PH值,调节细胞内Ca2+信号通路应对细胞的酸碱平衡的紊乱[14-15]。在反复的癫痫发作中,心肌细胞更多处于应激状态,NHE1不断通过调控Na+和H+交换,改善心肌细胞内的酸碱平衡,从而维持细胞的收缩性。然而这种不断的调整可能会造成细胞凋亡及坏死的发生。
凋亡是细胞应对外界环境改变的一个慢性调节过程,然而随着凋亡的增加也会导致心肌组织的病变逐渐加重,特别是作为心脏起搏点的窦房结细胞,在心律失常中起到重要的作用,如果窦房结细胞的凋亡过度发生,可能会导致心肌细胞在应答癫痫发作时或者急性缺氧时出现电生理的异常,从而导致猝死发生。本研究基于心肌组织开展凋亡的相关检测,证实模型鼠心肌组织在癫痫造模成功后第60天确实存在凋亡情况,由此证实心脏在癫痫发生的过程中确实是受到影响的。
本课题组前期研究结果发现,NHE1可以通过酸碱平衡的调节,促进神经元的凋亡,其机制可能与Ca2+信号通路的调控有关。NHE1的过度表达可促进钠钙交换体的过度激活,通过钠钙交换,促进Ca2+进入细胞,这可以激活Calpain,然后进一步激活Caspase3,从而促进凋亡的发生[16]。为此认为在心肌组织可能存在类似的改变,最终导致心肌细胞的凋亡。
心肌细胞的凋亡可能在心律失常的发生起到重要作用,例如心脏停搏、房颤及室颤的发生。有研究表明,SUDEP患者在发作后有更为明显的脑电抑制,继而出现呼吸抑制和心脏心律失常[16]。据研究显示,癫痫发作后丘脑的激活可以通过交感系统把兴奋传递到心脏,从而逐渐加剧心肌损害[17-19]。
总之,本研究认为慢性癫痫患者在不断的癫痫发作中,可能会出现心律失常,同时心肌细胞慢性凋亡增加,凋亡的发生可能与NHE1的参与有关,最终可能导致患者发生SUDEP。
