1株大黄鱼源金黄杆菌的分离鉴定和耐药性分析
2022-03-17吴佳怡潘苑霞呼高伟张林州
蔡 杰,吴佳怡,潘苑霞,呼高伟,张林州
(1.中国科学院深圳先进技术研究院,深圳 518055;2.台州学院生命科学学院,台州 318000;3.汤阴县畜牧兽医总站,汤阴 456150)
金黄杆菌(Chryseobacteriumsp.)是一类无鞭毛,无芽孢,严格好氧生长的革兰氏阴性菌,呈短小杆状,其广泛分布于水体、土壤和环境中,是常见的条件性致病菌[1]。常见的致病性金黄杆菌主要有脑膜脓毒金黄杆菌(Chryseobacteriummeningosepticum)、产吲哚金黄杆菌(Chryseobacteriumindologenes)及黏金黄杆菌(Chryseobacteriumgleum),金黄杆菌既可引发外源性感染,也可因机体免疫力低下或抗生素滥用而引起内源性感染,常可引起心内膜炎、术后感染、蜂窝织炎,严重时导致败血症的发生[2]。金黄杆菌虽为条件性致病菌,但其感染宿主范围非常广泛,不仅包括人,同时可引起畜禽[3]、虹鳟[4]、乌鳢[5]、鲟鱼[6]、中华鳖[7]和河蟹等多种水生动物发生严重的疾病。金黄杆菌还可引起棘胸蛙发生歪头病,致死率达100%[8],而对鲟鱼的致死率达83.3%[6],由此说明金黄杆菌对部分水生动物具有较强的致病性,对水产养殖业可造成极大的经济损失。金黄杆菌不仅可感染动物,在植物体内,如萝卜和拟南芥中也发现了该菌[9-10]。
作为“四大海产”之一的大黄鱼,因其肉质鲜嫩,营养丰富深受消费者喜爱,是中国近海重要的经济鱼类。近年来,随着水产养殖业集约化养殖程度的加快和人工养殖密度的增加,加上管理水平的参差不齐和渔药的不规范使用,引起大黄鱼抵抗力降低或正常菌群失调,导致易感染条件性致病菌[11]。大黄鱼感染金黄杆菌后影响“餐桌安全”,对人类健康造成潜在威胁。因此,对该菌在食品动物中进行流行病学调查和监测工作的开展对于该病的防控起到重要作用。本试验通过病料采集、细菌分离培养、16S rRNA基因序列鉴定、致病性及耐药性分析,对该养殖场大黄鱼疑似细菌感染病例进行诊断,并根据药敏试验指导临床用药,以期为大黄鱼金黄杆菌病的诊断和临床防治提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 伴随有进食障碍、不合群、行动迟缓、体表溃疡的患病大黄鱼收集于浙江台州某养殖场,体长30 cm左右,质量400~500 g。
1.1.2 主要试剂及仪器 细菌基因组DNA提取试剂盒、PCR Master Mix和凝胶回收试剂盒均购自生工生物工程(上海)股份有限公司;细菌生化微量鉴定管和药敏纸片均购自杭州滨和微生物试剂有限公司。FD-1B-80型真空冷冻干燥机购自北京博医康公司。
1.2 病原菌分离和纯化培养
取濒死患病大黄鱼,无菌条件生理盐水反复冲洗体表3次,超净台中用75%酒精棉球对体表进行擦拭消毒。剪取鳃丝、鳍条和溃疡处组织制成水浸片进行镜检,排除寄生虫感染。在超净工作台中剖取大黄鱼的肝脏和肾脏,用生理盐水冲洗后采用匀浆器将其研磨均匀,取研磨液置于离心管中,3 000 r/min离心5 min。取上清液划线接种于TSA培养基,28 ℃培养48 h。挑取数量多,形态一致的单个优势菌落反复划线纯化培养。将纯化菌株置于含15%甘油的LB液体培养基中,-80 ℃保存。
1.3 分离菌革兰氏染色和扫描电镜观察
挑取纯化培养后的单菌落,均匀涂布于含有一滴生理盐水的载玻片中央,经火焰固定,进行结晶紫染色、碘染、酒精脱色和蕃红复染后光学显微镜进行观察分析。
扫描电镜样品准备方法参考梁静南等[12]方法进行,并做出相应的调整。离心收集1 mL经培养后D600 nm值为1.0的菌液,PBS清洗3次。加入2.5%戊二醛,4 ℃固定过夜。固定后,PBS清洗3次。依次用30%、 50%、 70%、 80%、 90%和100%的酒精进行梯度脱水,最后采用乙酸异戊酯置换2次,15 min/次。将分离菌进行梯度冷冻(4、-20和-80 ℃)后置于真空冷冻干燥机中冷冻干燥8 h。取少量冻干粉末进行真空喷金处理,使用日立S-4800型扫描电子显微镜进行观察拍照。
1.4 分离菌生理生化鉴定
参考文献[13-14]方法将分离的单菌落接种于相应的生理生化鉴定管中,按照细菌生化微量鉴定管说明书进行结果判定,并对照《伯杰细菌鉴定手册》对分离菌株进行初步鉴定。
1.5 16S rRNA基因扩增及序列分析
利用细菌基因组提取试剂盒提取分离菌基因组DNA并作为模板,利用通用引物27F(5′-AGAGT-TTGATCCTGGCTCAG-3′)和1492R(5′-GGTTA-CCTTGTTACGACTT-3′)PCR扩增16S rRNA序列[13],引物由生工生物工程(上海)股份有限公司合成。PCR反应体系50 μL:10×PCR Buffer 5 μL,MgCl23 μL,dNTP Mixture 1 μL,上、下游引物(5 μmol/L)各1 μL,基因组DNA 1 μL,Taq酶1 μL,ddH2O 37 μL。PCR反应条件:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃孵育10 min。PCR产物进行1.0%琼脂糖凝胶电泳检测,切胶并利用凝胶纯化回收试剂盒回收约1 500 bp 的PCR扩增产物,连接到pUCm-T载体上,转化大肠杆菌DH5α感受态细胞,提取质粒后送生工生物工程(上海)股份有限公司测序。
将测得的16S rRNA基因序列提交至NCBI-BLAST功能模块和EzBioCloud database(https:∥www.ezbiocloud.net/)进行参考菌株的序列相似性比对分析,利用Clustal X软件进行多重序列比对,利用Mega 6.0软件构建遗传进化树,最大似然算法分析,并执行Bootstrapping(1 000次复制)[15]。
1.6 动物回归试验
将纯化后的分离菌在TSA培养基中传代培养,37 ℃震荡培养至对数生长期。用平板稀释法计算每毫升悬液的细菌数。选取体重10 g左右的健康大黄鱼鱼苗50尾(浙江宏野海产品有限公司),适应饲养7 d。试验分5组,试验1、2、3、4组和对照组,10尾/组,试验组分别腹腔注射浓度为1.0×109、1.0×108、1.0×107和1.0×106CFU/mL的分离菌,0.1 mL/尾,对照组注射等体积生理盐水。 保持水温20~25 ℃,期间正常给氧和换水,连续观察15 d,记录鱼苗的死亡情况,根据Reed-Muench法计算半数致死量(LD50)[16],并对濒死鱼肝脏进行病原菌分离与鉴定。
无菌条件下解剖病死鱼,分离肝脏、肾脏和脾脏组织,使用4%多聚甲醛进行组织固定,送上海尔湾生物技术有限公司进行普通包埋和石蜡切片。样品组织经过70%~100%酒精逐级脱水处理,二甲苯透明,石蜡包埋,切片,最后经苏木精-伊红染色,显微镜进行成像。
1.7 药敏试验
挑取纯化后的单个菌落接种于LB液体培养基中,震荡培养12 h。采用纸片扩散法进行药敏试验[17]。将菌悬液均匀涂布在LB固体培养基表面,用灭菌的镊子贴上含有不同种类抗菌药的纸片,30 ℃恒温培养36 h,测量抑菌圈直径(inhibition zone diameter,IZD),并参照药敏试验判断标准来判定结果。
2 结 果
2.1 分离菌革兰氏染色与形态学特征
在培养基表面可看到黄色圆形菌落,表面凸起、光滑,边缘整齐富有光泽(图1A);革兰氏染色结果显示,分离菌为革兰氏阴性红色短棒状菌,呈单个分散或成对分布(图1B),电镜结果显示,分离菌为末端钝圆的棒状杆菌。扫描电镜观察显示,分离菌长为1.2~1.8 μm,宽为 0.4~0.6 μm,菌体黏连,无鞭毛,不具有运动能力,无芽孢(图1C)。将分离菌命名为CH-2020-09。
2.2 分离菌生理生化特征
分离菌CH-2020-09生理生化试验结果见表1。由表1可知,分离菌可在麦康凯琼脂上生长,可利用葡萄糖、麦芽糖等产酸,不发酵蔗糖、乳糖等;氧化酶、过氧化氢酶、明胶酶、DNA 酶试验结果均为阳性,可水解七叶苷,上述结果与细菌鉴定手册中金黄杆菌属菌株基本一致,因此,初步判定CH-2020-09为金黄杆菌属细菌(Chryseobacteriumsp.)。
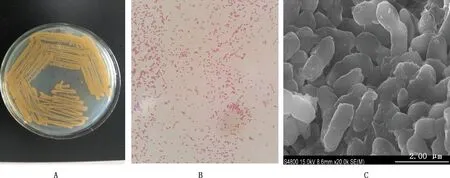
图1 分离菌菌落形态(A)、革兰氏染色镜检(B,1 000×)和超微结构观察(C,50 000×)Fig.1 Observation of the isolate colonies (A),Gram staining (B,1 000×) and ultrastructure (C,50 000×)
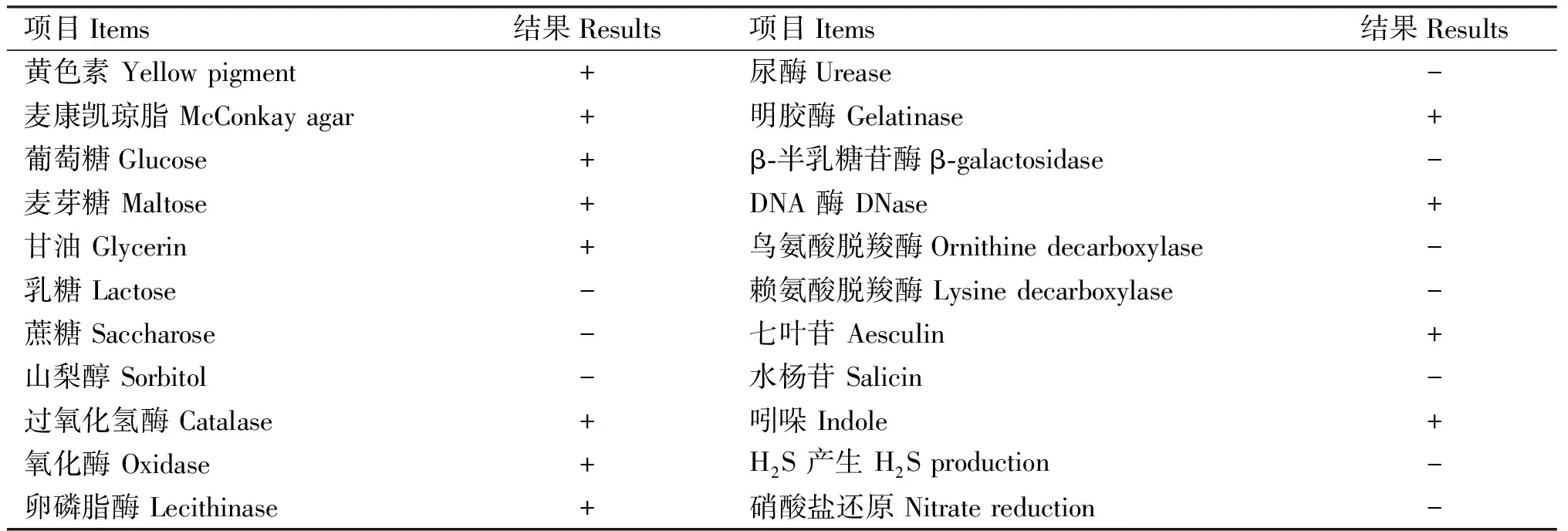
表1 分离菌的生长特征与生化鉴定
2.3 分离菌16S rRNA基因扩增与序列分析
菌株CH-2020-09 16S rRNA基因PCR扩增结果显示,扩增到了大小约1 500 bp的产物(图2)。测序后将测得的长1 453 bp的16S rRNA基因序列提交至NCBI,经BLAST比对分析发现,分离株与GenBank中公布的金黄杆菌株5127相似性为98.0%,与金黄杆菌株FRGDSA 4580/97和水生金黄杆菌株10-46的相似性均为97.0%;而在EzBiO Cloud database 网站与标准菌株比对的结果显示,菌株CH-2020-09与水生金黄杆菌亚种KCTC 12483的相似性最高,为99.3%。通过生物学软件 Mega 6.0构建系统发育树,结果显示,菌株CH-2020-09可与不同种金黄杆菌(Chryseobacterium)聚为一簇(图3)。综合上述形态学特征、生理生化鉴定及 16S rRNA 基因序列比对结果,鉴定分离菌CH-2020-09为金黄杆菌未定种(Chryseobacteriumsp.)。
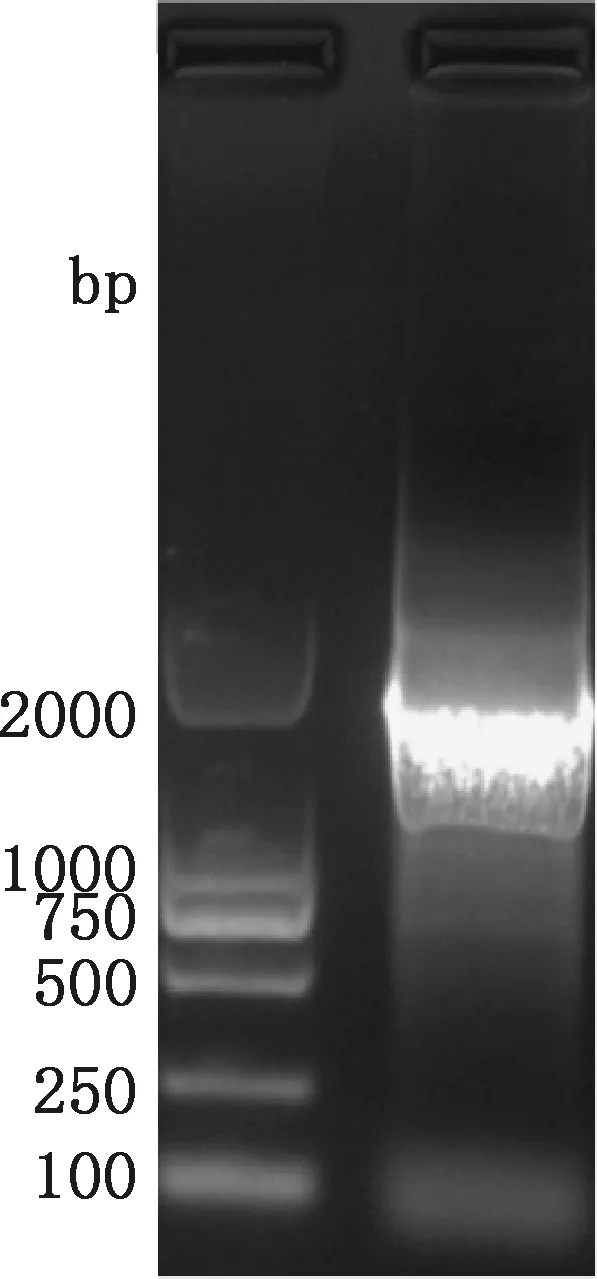
图2 分离菌CH-2020-09 16S rRNA 基因 PCR 扩增结果电泳图Fig.2 PCR amplification electrophoresis of 16S rRNA gene of the isolated strain CH-2020-09
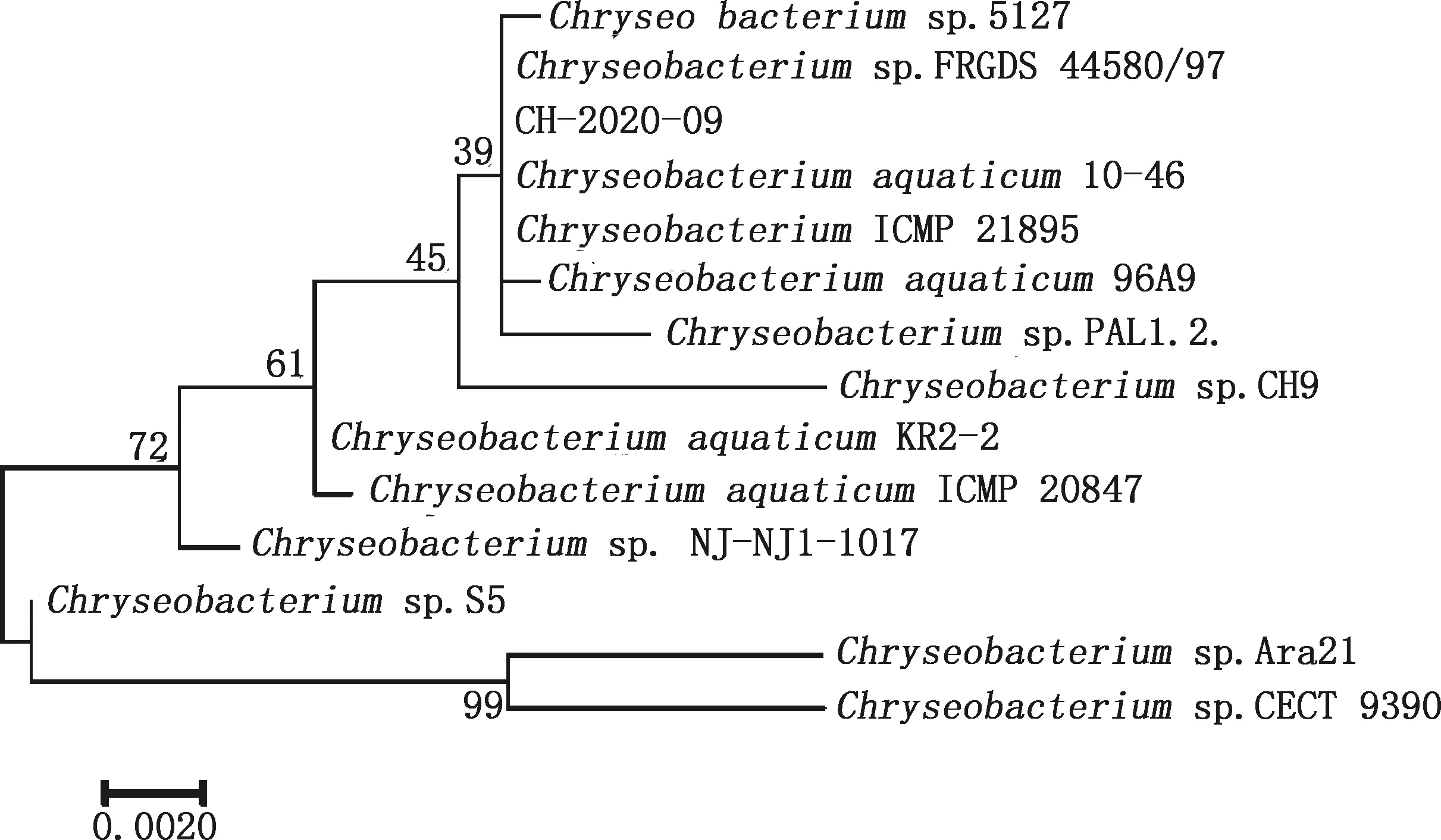
图3 分离菌CH-2020-09及金黄杆菌参考株的16S rRNA 基因系统发育树Fig.3 Phylogenetic tree of 16S rRNA gene of strain CH-2020-09 and reference strains of Chryseobacterium
2.4 动物回归试验结果
分离菌经腹腔注射大黄鱼后,试验鱼主要表现为行动迟缓,不合群,采食障碍,注射部位微红,有胀气,解剖腹腔后,有少量腹水和肝脏肿大,而对照组大黄鱼表现正常,死亡率为0(表2)。从人工感染发病濒死大黄鱼的肝脏组织可再次分离到与CH-2020-09形态一致的菌落,而未分离到其他细菌,同时在对照组试验鱼体内未分离到该菌。经计算CH-2020-09对大黄鱼的LD50为6.32×104CFU/mL。
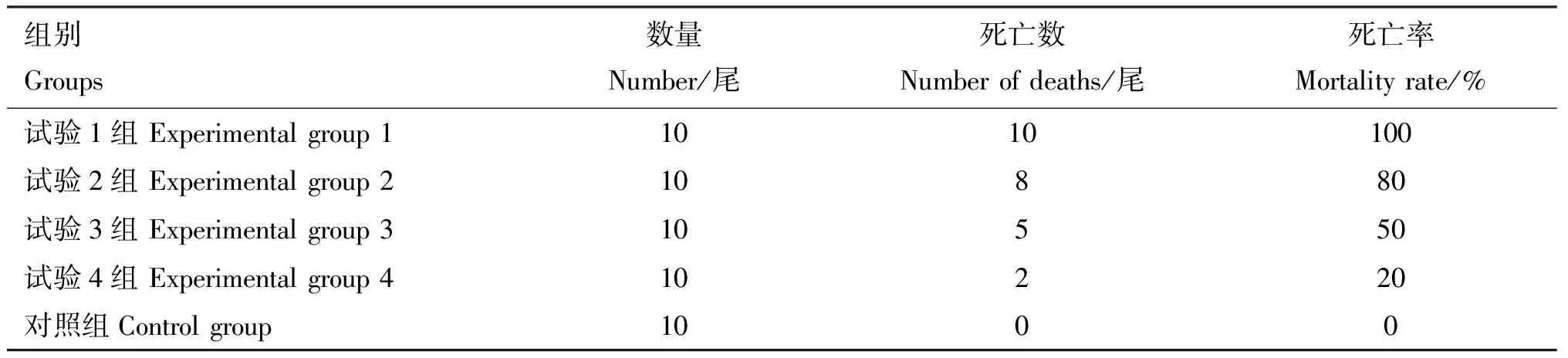
表2 分离菌CH-2020-09对大黄鱼的感染致死情况
2.5 组织病理变化
感染CH-2020-09后的大黄鱼肝脏、肾脏、脾脏组织病变明显。正常大黄鱼肝细胞排列紧密,呈不规则型,细胞界限和细胞核清晰(图4A),感染组肝脏肿大,细胞排列疏松、结构模糊,细胞坏死,细胞核消失,出现空泡化(图4A′,箭头所示);正常大黄鱼肾小管管腔结构规则清晰,肾小管上皮细胞排列整齐、界限清晰,管腔中刷状缘明显,细胞核完整(图4B),感染组肾小管充血,结构破坏,管腔呈现不规则或闭合,刷状缘紊乱,细胞出血空泡变性(图4B′,箭头所示);正常大黄鱼脾脏组织红细胞群和白细胞群均匀分布存在,细胞核完整,淋巴细胞分布其中(图4C),感染组脾细胞肿大,部分脾脏组织细胞坏死、空泡化,红细胞崩解,含铁血黄素沉积。淋巴细胞坏死和数量减少(图4C′,箭头所示)。
2.6 药敏试验结果
纸片法检测菌株CH-2020-09对16种抗菌药的敏感性,结果发现菌株CH-2020-09对阿米卡星和左氧氟沙星敏感,对庆大霉素、新霉素和红霉素中度敏感,对头孢克肟、氨苄西林、卡那霉素、呋喃唑酮、青霉素-G和链霉素等11种抗菌药均耐药(表3)。

A~C,分别为对照组鱼的肝脏、肾脏和脾脏组织;A′~C′,分别为试验组鱼的肝脏、肾脏和脾脏组织A-C,Liver,kidney and spleen of fish in control group,respectively;A′-C′,Liver,kidney and spleen of fish in experimental group,respectively图4 组织病理学观察(2 000×)Fig.4 Histopathological observation (2 000×)
3 讨 论
金黄杆菌属于黄杆菌科 (Flavobacteriaceae) 金黄杆菌属 (Chryseobacterium),该属目前有60 多种菌,近几年相继有新种被鉴定[18-19]。部分金黄杆菌是条件性致病菌,其可感染人类和多种动物引发疾病。近年来由于水产养殖业集约化程度的加大及渔药的不规范使用,由金黄杆菌感染引起多种水产养殖动物发生疾病的报道逐年增多,包括乌鳢[5,17]、鲟鱼[6]、中华鳖[7]、金结鱼[15]、牛蛙[20]、鲫鱼[21],可引起水产动物发生疾病的金黄杆菌主要有脑膜炎败血金黄杆菌、大菱鲆金黄杆菌(Chryseobacteriumscophthalmum)和产吲哚金黄杆菌。其中从患病金结鱼(Torputitora)分离到的大菱鲆金黄杆菌表现出很强的毒性效应。
本研究从患病大黄鱼体内分离到1株致病性金黄杆菌CH-2020-09,通过形态学观察和生理生化试验初步鉴定该分离菌为金黄杆菌属细菌,该分离菌与卜令飞等[20]从牛蛙体内分离到的金黄杆菌生理生化特征相似。16S rRNA序列分析结果显示,其与不同种金黄杆菌的相似性在97.0%以上,与金黄杆菌标准菌株KCTC 12483的相似性最高为99.3%,综合以上数据可证实分离菌株CH-2020-09为金黄杆菌未定种,种的确定还有待于进一步鉴定。
为进一步了解分离菌对宿主的致病性,本研究通过人工感染试验和组织病理学观察研究了分离的金黄杆菌对大黄鱼的致病作用,结果显示,金黄杆菌感染后可引起大黄鱼的肝脏和肾脏组织发生充血肿大,组织细胞发生空泡化变性及脾脏组织中含铁血黄素沉积。金黄杆菌CH-2020-09引发大黄鱼发生的组织病理变化与Neetu等[15]研究发现大菱鲆金黄杆菌引起金结鱼肝脏、肾脏、脾脏等组织充血出血的病理变化一致。截至目前有关金黄杆菌致病机理方面的研究较少,大多数研究主要是通过人工感染试验研究其致病性,而王鑫毅等[5]对产吲哚金黄杆菌的胞外产物成分的致病性研究结果表明金黄杆菌的胞外产物具有较强的毒性。
抗生素是治疗细菌性疾病的首选特效药之一,但近年来,由于抗生素在养殖业中的过度应用,导致严重的耐药性问题[22]。前期研究表明,在人类临床上金黄杆菌属对三代头孢菌素、喹诺酮类及亚胺培南等抗菌药存在严重的耐药性[23]。孔杰等[24]在鲟鱼体内分离到1株金黄杆菌liver 5,其对氧氟沙星敏感,对新霉素、红霉素中度敏感。源于棘腹蛙中的金黄杆菌CQW201410对哌拉西林和环丙沙星敏感[25]。何夙旭等[6]研究结果表明,鲟鱼源金黄杆菌B8对大多数临床上上常用抗生素有很强的耐药性,但对新霉素和红霉素敏感。药敏试验结果显示,本研究分离的金黄杆菌CH-2020-09对阿米卡星和左氧氟沙星敏感,对庆大霉素、新霉素和红霉素中度敏感,对其他不同种类的抗菌药均耐药,该结果与上述研究基本相似。无论人类或兽医临床上金黄杆菌属多数菌株的耐药性愈发广泛和严重,为该病的治疗和防控带来了巨大的挑战。因此,在确诊感染金黄杆菌时进行药物敏感性检测后选择敏感性药物用于临床治疗,可进一步减少抗菌药滥用,另外,可抵御金黄杆菌感染的安全有效的疫苗有待被开发出来[26]。
4 结 论
本研究从浙江台州地区发病的大黄鱼体内分离到1株金黄杆菌CH-2020-09,其16S rRNA序列与金黄杆菌标准株相似性为99.3%,CH-2020-09可导致大黄鱼的肝脏、肾脏和脾脏组织发生明显的病理变化,其对阿米卡星和左氧氟沙星敏感,对庆大霉素、新霉素和红霉素中度敏感。
