柴胡皂苷D对小鼠乳腺癌治疗过程中的药物代谢影响研究
2022-03-16赵明月侯玉珠孙开菊刘淑莹
赵明月,侯玉珠,刘 鑫,王 洋,孙开菊,庞 博,刘淑莹,李 丹,苏 蕊,3
(1.长春中医药大学,吉林 长春 130117;2.吉林大学第一医院心内科,吉林 长春 130021;3.吉林大学无机合成与制备化学国家重点实验室,吉林 长春 130012)
乳腺癌是世界范围内发病率第二的癌症,在女性癌症患者中发病率居首位[1]。目前,在乳腺癌的临床治疗中采用手术辅以化疗的方式,常用的治疗药物有阿霉素(adriamycin, ADM),但由于阿霉素易产生耐药性,成为乳腺癌化疗中难以解决的难题[2-4]。枸橼酸他莫昔芬是治疗女性复发转移乳腺癌的常用西药,缺点是会对生殖系统产生不良影响,轻者月经失调、闭经,重者导致内膜息肉和内膜癌,且长时间(17个月以上)大量服用会出现视网膜病或角膜混浊[5-8]。而其他西药,如依西美坦(对胎儿有影响[9]、肝功能异常[10])、氯氧喹(扰乱血液系统、肝功能异常[11])、来曲唑(对胎儿有影响[12])和曲妥珠单抗(具有心肌毒性[13]、肺毒性[14])对人体均会产生较大的不良反应。因此,寻找毒性小、耐药性小、靶向性强、有效性高的药物是临床上亟需解决的问题。
中药具有疗而不伤、固本培元的优势[15]。研究表明,从不同中药中提取获得的柴胡皂苷[16-17]、姜黄素[18]、小檗碱[19]、青蒿素[20]、人参皂甙[21]等有效成分具有抗癌活性。中药中的抗癌活性成分对乳腺癌肿瘤微环境有直接的细胞毒性作用,对乳腺癌肿瘤免疫具有间接的调节作用,能够明显改善化疗效果[22-23]。Wang等[24]研究表明,甘草次酸能够通过损害p38 MAPK-AP1信号轴有效抑制乳腺癌侵袭和转移;Gunjan等[25]认为18β-甘草次酸可通过调节Akt/FOXO3a/Bim通路诱导人乳腺癌MCF-7细胞凋亡;Sun等[26]证实了柴胡皂苷D(SsD)可以在较低的药物浓度下选择性地抑制乳腺癌细胞的生长, 并有望成为安全、有效、经济的抗癌药物。
柴胡皂苷是柴胡中具有代表性的生物活性成分,是很多抗病毒、抗炎、抗肿瘤、调节免疫等药物的有效成分[27]。近年来,通过对柴胡提取物SsD进行研究,证明SsD是柴胡中具有显著药用活性的三萜皂苷[28],具有抗癌、调节免疫[29]、抑制三阴性乳腺癌细胞的增殖[30]等作用,但是会诱导LO2肝细胞线粒体凋亡,激活细胞凋亡蛋白酶,进而导致肝毒性[31]。由于乳腺癌的发生和进展与代谢物的改变密切相关,在其恶性转化、治疗过程中,乳腺癌细胞的代谢组发生了一系列重组[32],会发生糖代谢[33]、氨基酸代谢[34]、脂质代谢[35]与核苷酸代谢[36]的紊乱。虽然SsD的药用活性已有报道[30,37],但其在乳腺癌治疗过程中机体所产生的代谢变化尚不明确。
本文拟构建乳腺癌小鼠动物模型,设置健康组、对照组和给药组,采用不同剂量SsD对其进行给药治疗,并利用超高效液相色谱-串联静电场轨道阱质谱(UHPLC-Orbitrap MS)对3个组别不同给药天数后的小鼠血清中的差异代谢物进行筛查,并对化合物进行鉴定,旨从代谢组学角度研究小分子代谢物的变化,阐述药物的疗效及对机体的影响。
1 实验部分
1.1 仪器与试剂
四极杆静电场轨道阱高分辨质谱仪:美国Thermo Fisher Scientific 公司产品;单通道数字移液器:德国Eppendorf公司产品;Vortex Mixer QL-866涡旋振荡器:上海达姆实业有限公司产品;D-37520 Osterode离心机:德国Sigma公司产品;氮吹仪:上海鑫翁科学仪器有限公司产品。
SsD标准品(批号:20874-52-6):上海源叶生物公司产品;氮气(99.99%):长春巨洋气体有限责任公司产品;甲醇、异丙醇、乙腈:HPLC级,美国Fisher化学公司产品;超纯水:采用上海和泰仪器有限公司超纯水装置(18.25 MΩ·cm)制备;Balb-c小鼠(SPF级):购于辽宁长生生物技术股份有限公司;吐温-20:上海阿拉丁生化科技股份有限公司产品。
1.2 实验方法
1.2.1SsD腹腔注射液的配制 在20.00 mg SsD标准品中加入含1%吐温-20的生理盐水,定容至5.00 mL,得到50 μmol/L SsD贮备液,于4 ℃储存。取适当体积储备液,稀释获得2.00 mg/kg(2.5 μmol/L)和0.4 mg/kg(0.5 μmol/L)的SsD腹腔注射液。
1.2.2血清提取 采用蛋白沉淀法提取小鼠血清。将取出的全血置于EP管内,4 ℃放置1 h后,以4 339 r/min离心15 min,获得血清样本,保存于-80 ℃。质谱检测前对血清样本进行预处理,取一定量的血清于EP管内,加入3倍血清体积的甲醇,涡旋30 s,随后以11 134 r/min离心15 min,取上清液,氮气吹干;加入1.5倍血清体积的超纯水,涡旋15 s,过0.22 μm 水相滤膜,获得待分析样品。
1.2.3乳腺癌小鼠模型的构建 选择26只Balb-c小鼠,置于12 h昼夜更替的动物房内,自由进食、饮水。将其分为健康组、对照组和给药组(高(2.0 mg/kg SsD)、低(0.4 mg/kg SsD)剂量组),皮下注射4T1细胞,在肿瘤约100 mm3时完成构建乳腺癌肿瘤模型。对乳腺癌模型小鼠进行给药治疗,每隔1天腹腔注射给药,每次注射200 μL SsD,连续给药2周。在实验期间,记录高、低剂量组体重、肿瘤大小以及死亡情况。30天后进行安乐死,收集肝心脾肺肾和肿瘤组织。
1.2.4血样采集 分别在给药0、3、6、9、12、15、21和30天,用毛细玻璃管从眼眶静脉丛采血,处理后进行UPLC-Orbitrap MS测定。
1.3 实验条件
1.3.1色谱条件 Thermo Accucore C18色谱柱(100 mm×2.1 mm ×1.9 μm);流动相:0.1%甲酸水(A)和乙腈(B);梯度洗脱程序:0~1 min(10%B),1~8 min(10%~65%B),8~10 min(65%B),10~17 min(65%~85%B),17~18 min(85%~100%B),18~21 min(100%B),21~26 min(100%~10%B);流速0.3 mL/min;进样量10 μL;柱温35 ℃。
1.3.2质谱条件 正离子采集模式;Full-scan扫描;质量扫描范围m/z70~1 000;分辨率70 000;自动增益控制(AGC):1×106;鞘气和辅助气均为氮气,流速分别为8.4和12.1 L/min;毛细管温度300 ℃;喷雾电压3.5 kV。
2 结果与讨论
2.1 非靶向代谢组学中靶目标代谢物离子的筛查
采用UPLC-Orbitrap MS对待测样品进行全扫描,获得高分辨代谢物离子的质荷比数据,随后对从样品中提取的6 766个离子进行全扫描的非靶向分析,工作流程示于图1。

图1 UPLC-Orbitrap MS 非靶向代谢组学工作流程图Fig.1 Workflow of the UPLC-Orbitrap MS based untargeted metabolomics method
经过“80%规则”[38]处理后保留了6 427个离子,对所选离子进一步筛选合并,以减少冗余离子,最后确定5 835个离子作为靶离子。给药21天后,对照组和高、低剂量给药组的总离子流图示于图2,所得代谢产物离子峰形较好,分离度较高,离子数量丰富。此外,为考察该方法的准确性和精密度,对保留离子峰面积的相对标准偏差(RSD)进行计算,结果示于图3。在正离子模式下,对提取离子的峰面积进行积分,43.2%代谢产物离子的峰面积RSD为0%~5%;29.3%代谢产物离子的峰面积RSD为5%~10%;16.1%代谢产物离子的峰面积RSD为10%~15%;8.0%代谢产物离子的峰面积RSD为15%~20%。共计96.6%的离子峰面积RSD(n=6)小于20%,表明本方法具有较好的重复性和稳定性。

图2 连续给药21天后的总离子流图Fig.2 Total ion chromatograms after 21 days of continuous administration

图3 血清样本中代谢物离子的RSD分布Fig.3 RSD distribution of all metabolites in the serum samples
2.2 柴胡皂苷D的药效作用评价
对小鼠连续治疗30天后安乐死取肿瘤组织进行比较发现:对照组无变化;低剂量治疗组小鼠的肿瘤体积小于对照组,为对照组体积的3/5;高剂量治疗组的肿瘤体积显著减小,为对照组体积的1/10。此外,对小鼠进行了生存期实验,结果示于图4。可见,在实验结束(30天)时,采用低剂量SsD治疗的小鼠显示了60%的存活率,高剂量治疗组可以达到80%的存活率,表明SsD对乳腺癌肿瘤具有明显的治疗作用,能够提高小鼠的存活率。
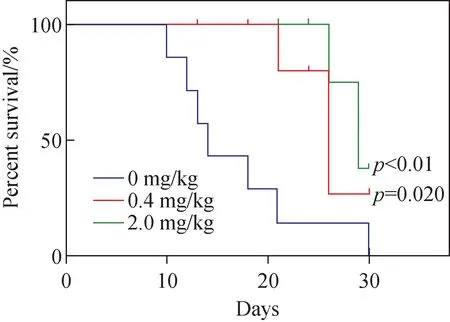
图4 对照组和给药组小鼠的生存期图Fig.4 Survival curves of mice in control group andadministration groups
2.3 小鼠血清内代谢物变化研究及治疗效果判断的多变量分析
为排除干扰,在质谱数据的多变量判别分析之前做以下处理:1) 将SsD的准分子离子m/z781.476 4[M+H]+及其产生的二聚体离子以及加合产物离子(如m/z803.458 5[M+Na]+)排除在待分析统计的数据集之外。2) 经过单因素方差分析及PLS-DA分析,只有当代谢物特征p值小于0.05,VIP>1,才可用于统计学分析。此外,所筛查的代谢物特征离子信息需满足在预设的3个组别的80%以上样品中能够被有效提取到,才能加入训练集中进行统计分析。最终获得的数据集包含所筛查的内源性代谢物离子的保留时间、离子形式及所对应化合物的分子式、分子质量和结构等信息。在将原始数据导入Compound Discover软件之前,将质量误差设为≤10×10-6,保留时间偏差为±0.25 min。
将筛查的5 835个靶离子信息导入统计软件的数据集中,使用非监督PCA和监督PLS-DA进行多元模式识别,实验结果示于图5。可知,在PCA分数图中,给药治疗0天、3天后,对照组和治疗组(高、低剂量)无法达到明确区分;给药治疗9天后,对照组和低剂量治疗组无法明显区分,但与高剂量组可以清晰判别;给药治疗15天后,3个组别可以基本判别;给药治疗21天后,能够显著将3个组别区分开。

注:a.0天;b.3天;c.9天;d.15天;e.21天图5 对照组、低剂量和高剂量给药组的PCA分数图Fig.5 PCA score plots of mice with control group, SsD low concentration group and SsD high concentration group
采用监督PLS-DA进行组别区分时,能够较清晰地区分3个组别的血清样本,示于图6。PLS-DA模型中涉及2个重要参数:R2为解释率,是原始数据信息百分比的平方;Q2为PLS-DA模型的预测能力。本研究通过拟合,在正离子模式中得到R2>0.82、Q2>0.71,表明实验构建的模型稳定有效,不存在过度拟合的情况。因此,在接下来的组内、组间特征离子筛查实验中,采用分离情况较好的PLD-DA模型中的VIP值(VIP>1)筛查特征代谢化合物离子,随后将代谢物离子信息导入在线代谢组学数据库(HMDB)进行化合物结构鉴定。
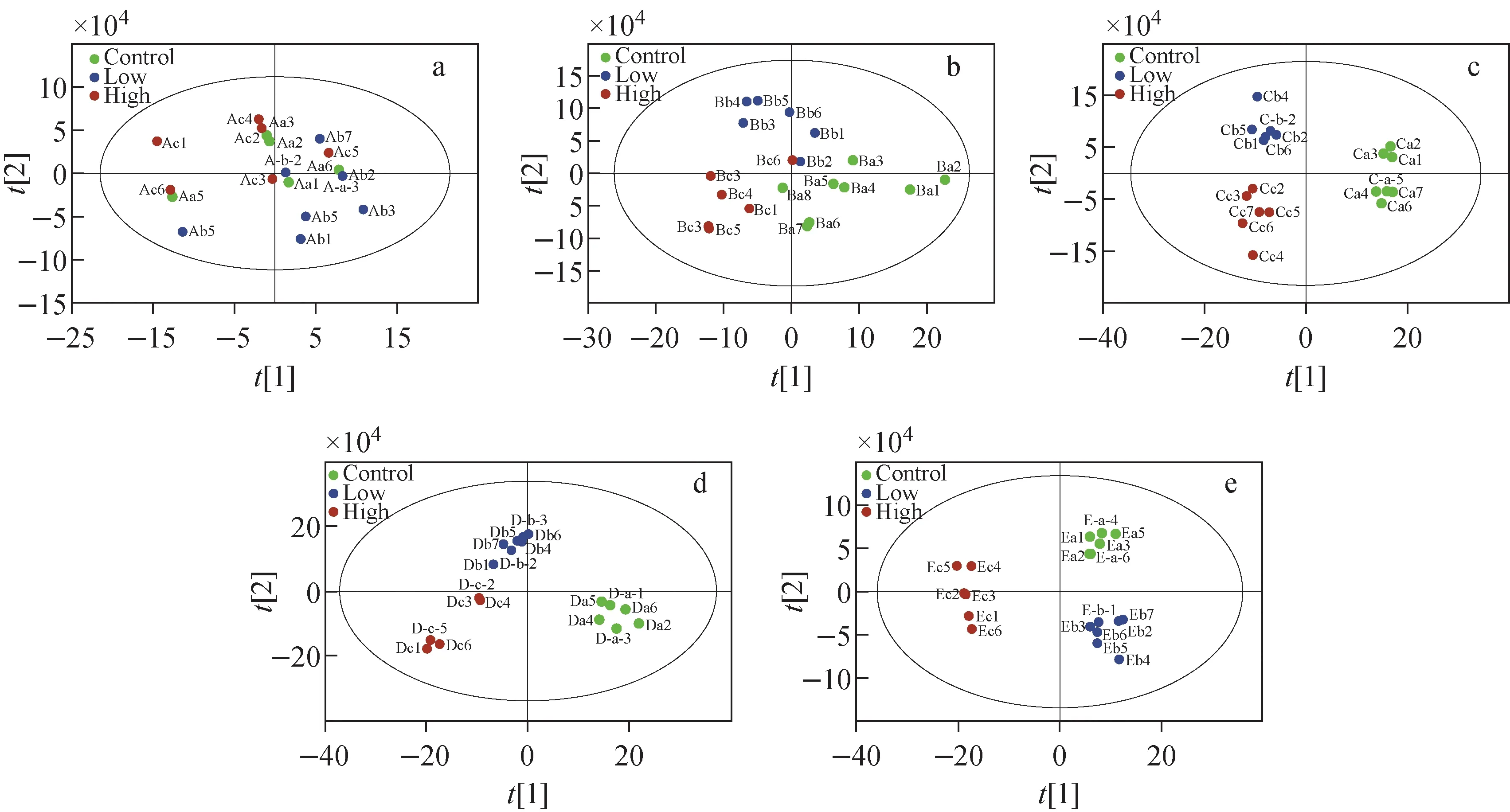
注:a.0天;b.3天;c.9天;d.15天;e.21天图6 对照组、低剂量和高剂量给药组的PLS-DA分数图Fig.6 PLS-DA score plots of mice with control group, SsD low concentration group and SsD high concentration group
2.4 组内、组间代谢物变化研究
本实验分别考察了同一组内(对照组、低剂量和高剂量给药组内)小鼠血清内代谢物随饲养天数的变化情况(横向代谢物变化研究),以及3个组别之间在给药21天后小鼠血清内代谢物的变化情况(纵向代谢物变化研究),并研究横纵向筛查所得化合物的重合性,以提高特征离子筛查的准确度。
组内代谢物变化结果表明,随着饲养天数的增加,3个组别代谢物均有明显变化;对照组中,小鼠饲养过程中肿瘤体积随天数增加明显增大。将VIP值从大到小排序,筛查并列出VIP>1的前50个代谢物离子,示于图7。以对照组筛查的代谢物为目标,比对治疗组筛查获得的代谢物离子,结果列于表1。对照组筛查获得12个目标代谢物离子,且在肿瘤生长过程中趋势变化显著,其强度随给药时间变化的趋势示于图8,并对这12个化合物离子的生物学意义进行考察。
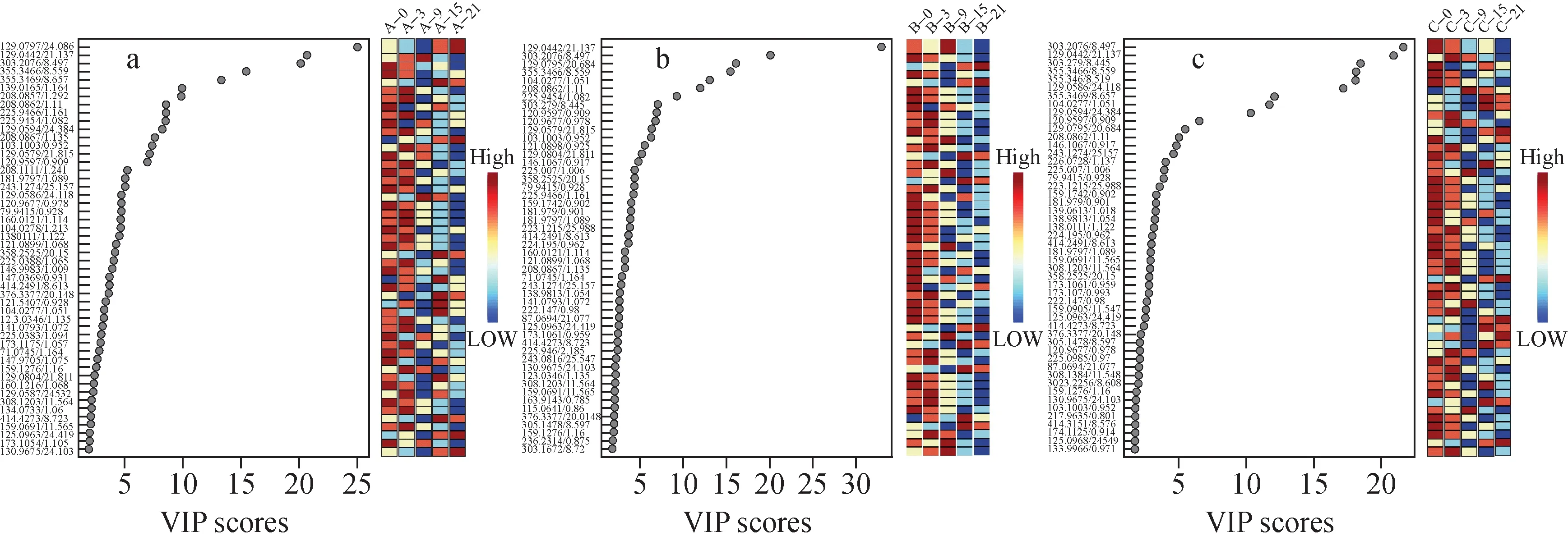
图7 对照组(a)、低剂量(b)和高剂量(c)给药组的离子筛查 VIP 得分图Fig.7 VIP score plots of the control group (a), SsD low concentration group (b), and SsD high concentration group (c)
研究表明,哌可酸(m/z130.086 98)在人体的含量与乳腺癌进展速度呈正相关[39-40]。本实验结果表明,在对照组小鼠血浆中,m/z130.086 98离子强度随癌症患病时间延长而显著增加;在治疗组中,随着腹腔注射时间延长,低剂量给药组小鼠血清中m/z130.086 98强度升高,但离子强度增加趋势较对照组下降;高剂量给药组m/z130.086 98离子强度变化不大,表明SsD能够抑制哌可酸的增加,示于图8a。N-丙烯酰甘氨酸(m/z130.051 48)是在甘氨酸N-酰基转移酶作用下的产物。Tian等[41]研究表明,甘氨酸N-酰基转移酶的异常表达与乳腺癌进程密切相关。图8b表明,在对照组和治疗组中,m/z130.051 48离子随时间增加均呈现降低趋势;给药治疗相同时间(9天、21天),m/z130.051 48离子在给药组中强度与对照组相比呈现升高的趋势,表明了SsD具有干预治疗作用。3-亚甲基吲哚(m/z130.066 68)是3-甲基吲哚的代谢产物之一,与生物体内色氨酸代谢途经相关[42],但与乳腺癌进展的关系尚不明确。从图8c可知,在对照组与低剂量治疗组中,随癌症患病天数增加,m/z130.066 68离子强度呈下降趋势;在高剂量治疗组中,该离子强度明显上升,表明SsD能够促进小鼠体内血清中3-亚甲基吲哚含量增加。L-犬尿氨酸(m/z209.093 98)是一种免疫抑制代谢产物,可显著抑制T细胞增殖,诱导T细胞凋亡,其含量变化与肝脏的代谢调节有关[43-44]。在SsD治疗乳腺癌的过程中,即使是0.4 mg/kg SsD也可以使L-犬尿氨酸离子强度显著下降,而在对照组中,随小鼠癌症患病天数增加,m/z209.093 98离子强度呈显著上升趋势,表明SsD对L-犬尿氨酸具有显著的抑制作用,示于图8d。苯乙胺(m/z122.097 08)具有抑制人乳腺癌MCF-7细胞增殖的能力[45]。在对照组中,m/z122.097 08离子强度随时间增长而明显降低;在低剂量组中,m/z122.097 08离子强度的降低趋势有所减缓;在高剂量组中,苯乙胺水平变化不显著,示于图8e。给药21天时,苯乙胺含量顺序为:高剂量组>低剂量组>对照组,表明SsD影响苯乙胺在小鼠体内的生成和代谢,列于表2。由图8f可知,对照组中DL-2-氨基辛酸(m/z160.133 58)离子强度随时间变化呈现显著上升趋势;在低剂量SsD给药后,该离子上升趋势变得缓慢,得到抑制;在高剂量给药组中,该离子强度发生显著下降,表明SsD可能通过抑制DL-2-氨基辛酸的合成来控制乳腺癌的发展。次黄嘌呤(m/z137.046 98)是一种潜在的有毒化合物,也是乳腺癌诊断的潜在生物标志物[46],图8k表明,次黄嘌呤离子强度在3组中变化不大,但组间比较表明,其离子强度在高剂量组低于低剂量组和对照组。图8g和图8l表明,N(6)-甲基赖氨酸(m/z161.128 88)和己酰肉碱(m/z260.188 28)在对照组中呈下降趋势,而在高、低剂量组变化不明显,表明SsD可能对这3个代谢物离子产生影响,使之趋于正常化。由图8h和8j可知,吲哚乙醛(m/z160.076 38)和己酰甘氨酸(m/z174.112 68)的离子强度在3个组别中均呈现下降趋势。3-甲基组胺(m/z126.103 58)能够抑制淋巴细胞活化,在手术切除乳腺癌肿瘤后,尿液中3-甲基组胺含量会显著下降[47-48]。由图8i可知,给药后,3-甲基组胺的增长速率会明显下降,表明SsD对其代谢途径存在影响。

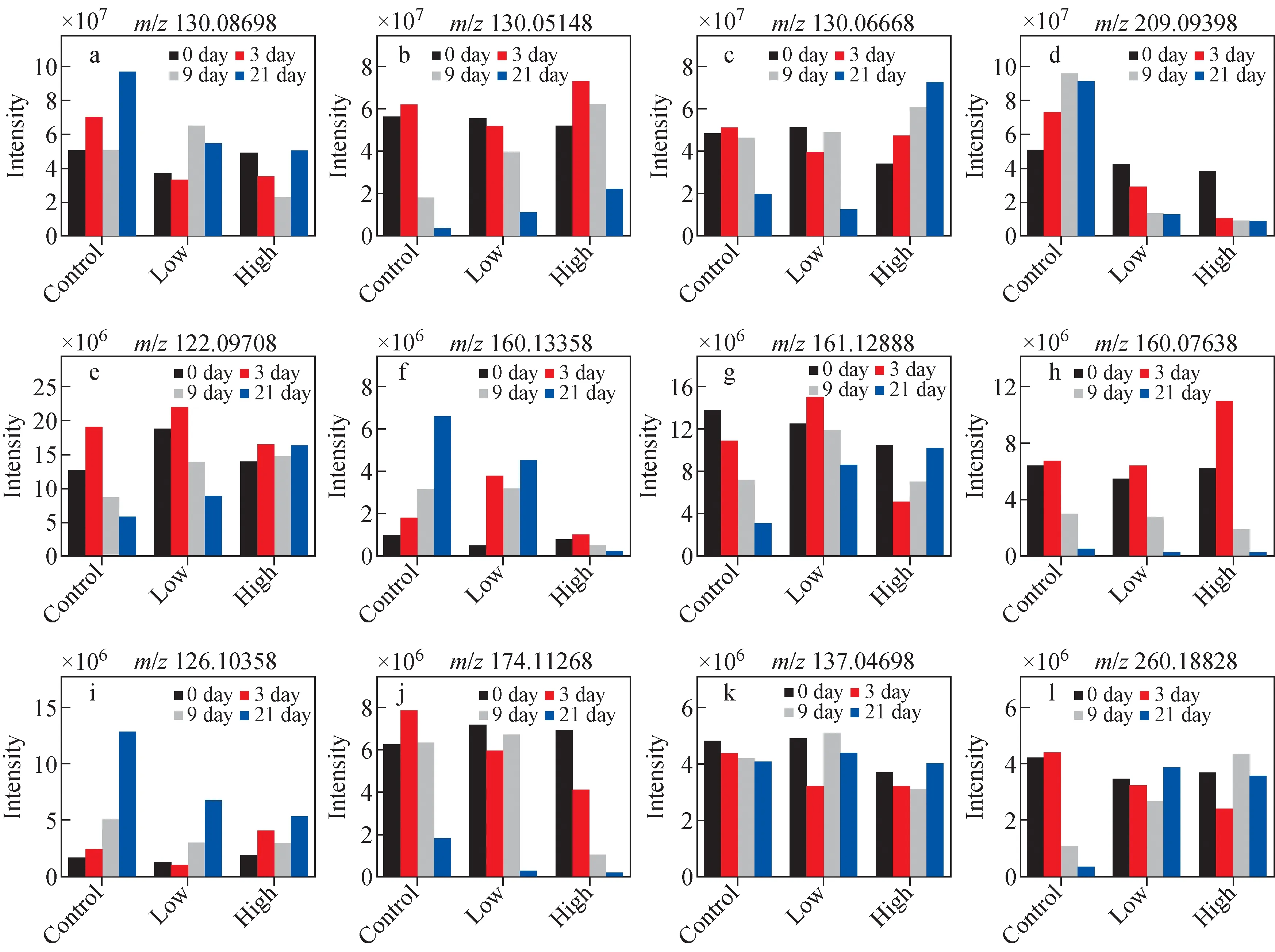
注:a.哌可酸;b.N-丙烯酰甘氨酸;c.3-亚甲基吲哚;d.L-犬尿氨酸;e.苯乙胺;f.DL-2-氨基辛酸;g.N(6)-甲基赖氨酸;h.吲哚乙醛;i.3-甲基组胺;j.己酰甘氨酸;k.次黄嘌呤;l.己酰肉碱图8 组内筛查获得的12种代谢产物离子强度随给药时间变化的趋势图Fig.8 Intensity variations of potential 12 biomarkers obtained by intra-group screening
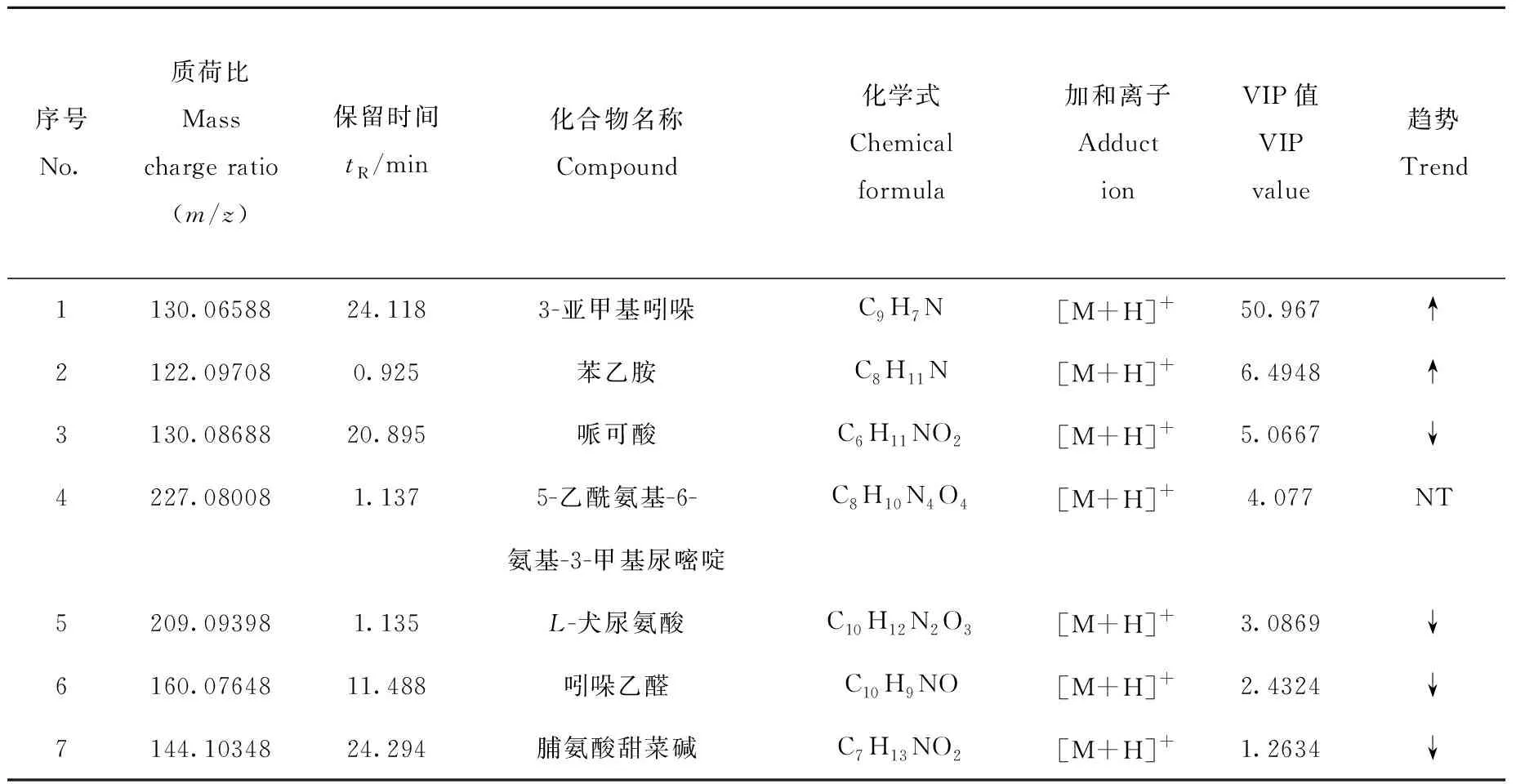
表2 给药21天后,对照组、低剂量和高剂量给药组组间小鼠血清的差异代谢物及其变化情况Table 2 Differential metabolite ions in serum screening of control group, SsD low concentration group and SsD high concentration group after 21 administration days
取给药治疗21天后的血清进行代谢物变化筛查,研究组间代谢组学,对组间变化明显的化合物进行筛查和鉴定,所得信息列于表2。可知,7种化合物组间变化趋势明显。其中,在对照组、低剂量给药组和高剂量给药组中,m/z130.065 88离子强度呈上升趋势,m/z122.097 08、130.086 88、209.093 98、160.076 48和144.103 48离子强度呈明显下降趋势,并且所获得的5种离子和表2中筛查的离子重合,分别是3-亚甲基吲哚、苯乙胺、哌可酸、L-犬尿氨酸、吲哚乙醛。实验结果得到交互验证,说明代谢物离子筛查结果准确可靠。5-乙酰氨基-6-氨基-3-甲基尿嘧啶(m/z227.080 08)可在体内产生,需经过肝脏和肾脏的调节,存在于生物体的血液、尿液和粪便中。目前未见5-乙酰氨基-6-氨基-3-甲基尿嘧啶与乳腺癌代谢相关的报道,其变化的产生可能与SsD相关,需要进一步研究。脯氨酸甜菜碱(m/z144.103 48)对肾脏的渗透调节有积极作用,虽然之前未明确脯氨酸甜菜碱与乳腺癌进展的关系,但其在食管鳞状癌与甲状腺癌中都发生了明显变化[49-50],推测小鼠血清中脯氨酸甜菜碱含量的变化可能与SsD药物作用相关。
3 结论
本工作建立了一种代谢组学方法用于研究柴胡皂苷D对乳腺癌的治疗作用及其治疗过程中药物作用对机体代谢物产生的影响。结果表明,SsD对乳腺癌小鼠具有较好的治疗效果,能够显著提高小鼠的存活率。此外,随着给药次数和天数的增加,通过研究对照组、SsD低剂量和SsD高剂量给药组小鼠血清中的代谢物离子变化,筛查与药物影响作用较大的代谢物离子,并对其进行定性分析和变化趋势研究。SsD在治疗乳腺癌过程中的代谢变化主要表现为氨基酸代谢与核苷酸代谢,这给药物作用靶点和潜在肿瘤标志物筛查研究提供了理论依据。
