5-氨基异噁唑的4-位芳基化
2022-03-16张晓梅
刘 辉, 张晓梅
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.西华大学 化学系, 四川 成都 610039;3.中国科学院大学, 北京 100049)
异噁唑类衍生物具有多种生物活性,异噁唑也常作为关键的活性结构片段广泛存在于农药、医药和生物活性分子中[1-3]。近年来研究也表明,在分子结构中引入异噁唑骨架有助于提高化合物生物活性,降低其毒性和改善药代动力学的特点[4]。如Chart 1所示,氯苯西林(Cloxacillin)、双氯西林(Dicloxacillin)、苯甲异噁唑青霉素(Oxacillin)及氟氯西林(Flucloxacillin)等被广泛用于治疗青霉素耐药型金黄色葡萄球菌所导致的感染[5-8]。鹅膏氨酸(Ibotenic acid)是日本科学家在1964年从毒蝇鹅膏菌中提取出来的天然产物,具有很强的神经毒性,常被用作脑损伤剂[9-10]。基于异噁唑在药物中的重要作用,化学家们已经开发了多种可行的合成异噁唑类化合物的方法。例如1,3-双羰基化合物与羟胺反应[11-12],α-炔酮(醛)与羟胺反应[13-14],卤代α,β-不饱和羰基化合物[15]与羟胺反应等。虽然已有多种方法可用于构建该类化合物,但仍存在一些缺点:使用1,3-双羰基化合物合成时会涉及到选择性;α-炔酮(醛)、卤代α,β-不饱和羰基化合物等原料稳定性差且产率低,不利于反应放大。
Chart 1
对苯醌及其衍生物具有较高的化学活性,由于含有α,β-不饱和羰基结构,可与多种亲核试剂发生1,2-或1,4-加成反应,加成产物很容易进一步芳构化形成芳基化产物。近年来,本课题组在对苯醌及其衍生物参与的反应研究中取得了一定进展[16-19]。为了进一步研究对苯醌及其衍生物的反应,本文实现了在酸催化下对苯醌单亚胺与5-氨基异噁唑的加成反应,并以中等到良好的产率构建一系列新颖的4-芳基-5氨基异噁唑类衍生物。
1 实验部分
1.1 仪器与试剂
Büchi B-545型熔点仪;Bruker Avance-300 MHz型核磁共振仪(TMS为内标);Bruker FT-MS/BioTOF Q型质谱仪。
所用试剂均为分析纯。
1.2 化合物3a~3n的合成(以3a为例)
向干燥反应管中依次加入5-氨基异噁唑(1a)19 mg(0.1 mmol)、2,5-二氯取代的对苯醌单亚胺(2a)50 mg(1.5 mmol)和联萘酚磷酸酯(PA)3.5 mg(0.01 mmol),氯仿为溶剂,于0 ℃下反应12 h(TLC检测)。反应结束后,直接经硅胶柱层析纯化得到白色固体3a40 mg,收率75%。
用类似的方法合成化合物3b~3n。
N-(2,5-dichloro-3-(5-(ethylamino)-3-phenylisoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3a):white solid, m.p.187.7~189.3 ℃, 75% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.73(s, 2H), 7.48(d,J=8.3 Hz, 2H), 7.42~7.25(m, 4H), 7.21(d,J=8.1 Hz, 2H), 7.19~7.12(m, 2H), 6.93(t,J=5.8 Hz, 1H), 3.04(ddd,J=12.9 Hz, 8.9 Hz, 5.6 Hz, 2H), 2.30(s, 3H), 1.05(t,J=7.2 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 167.23, 161.71, 152.63, 143.40, 137.44, 132.85, 130.24, 129.74, 129.68, 129.25, 128.83, 127.01, 126.76, 125.99, 119.55, 119.01, 83.36, 37.16, 21.28, 15.64; HR-MS(ESI)m/z: Calcd for C24H21Cl2N3O4SH+{[M+H]+}518.0703(35Cl), 520.0673(35Cl37Cl), found 518.0684(35Cl), 520.0670(35Cl37Cl)。
N-(2,5-dichloro-3-(3-(3-chlorophenyl)-5-(ethylamino)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3b): white solid, m.p.166.3~168.4 ℃, 67% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.85(s, 1H), 9.73(s, 1H), 7.52~7.41(m, 3H), 7.37(t,J=7.9 Hz, 1H), 7.28(s, 1H), 7.23(t,J=1.9 Hz, 1H), 7.19(d,J=8.0 Hz, 2H), 7.10~7.01(m, 2H), 3.17~2.97(m, 2H), 2.30(s, 3H), 1.05(t,J=7.1 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 167.13, 160.10, 152.37, 142.90, 137.31, 133.16, 132.54, 132.05, 130.50, 129.33, 129.17, 126.62, 126.11, 125.75, 124.97, 118.82, 118.78, 82.90, 36.83, 20.94, 15.28; HR-MS(ESI)m/z: Calcd for C24H20Cl3N3O4SH+{[M+H]+}552.0313(35Cl), 556.0254(35Cl37Cl2), found 552.0311(35Cl), 556.0286(35Cl37Cl2)。
N-(2,5-dichloro-3-(3-(4-chlorophenyl)-5-(ethylamino)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3c): white solid, m.p.204.4~206.8 ℃, 75% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.75(s, 2H), 7.49(d,J=7.8 Hz, 2H), 7.41(d,J=8.2 Hz, 2H), 7.31(s, 1H), 7.21(d,J=8.0 Hz, 2H), 7.16(d,J=8.1 Hz, 2H), 6.99(t,J=5.7 Hz, 1H), 3.13~2.99(m, 2H), 2.31(s, 3H), 1.05(t,J=7.2 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 167.05, 160.36, 152.32, 142.91, 137.34, 134.04, 132.31, 129.37, 129.15, 128.97, 128.70, 128.11, 126.72, 125.74, 118.88, 82.85, 36.85, 20.96, 15.33; HR-MS(ESI)m/z: Calcd for C24H20Cl3N3O4SH+{[M+H]+}552.0313(35Cl), 556.0254(35Cl37Cl2), found 552.0292(35Cl), 556.0240(35Cl37Cl2)。
N-(3-(3-(4-bromophenyl)-5-(ethylamino)isoxazol-4-yl)-2,5-dichloro-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3d): white solid, m.p.197.3~199.5 ℃, 57% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.75(s, 2H), 7.54(d,J=8.5 Hz, 2H), 7.48(d,J=8.0 Hz, 2H), 7.31(s, 1H), 7.21(d,J=7.9 Hz, 2H), 7.09(d,J=8.5 Hz, 2H), 6.99(t,J=5.8 Hz, 1H), 3.14~2.97(m, 2H), 2.31(s, 3H), 1.04(t,J=7.1 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ 167.04, 160.40, 152.27, 142.87, 137.35, 132.26, 131.55, 129.32, 129.06, 128.33, 126.67, 125.74, 122.71, 118.86, 82.84, 36.82, 20.93, 15.28; HR-MS(ESI)m/z: Calcd for C24H20BrCl2N3O4SH+{[M+H]+}595.9808(35Cl), 599.9749(37Cl), found 595.9788(35Cl), 599.9744(37Cl)。
N-(2,5-dichloro-3-(5-(ethylamino)-3-(4-fluorophenyl)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3e): white solid, m.p.216.5~216.9 ℃, 79% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.79(s, 1H), 9.72(s, 1H), 7.49(d,J=7.9 Hz, 2H), 7.30(s, 1H), 7.22(d,J=9.1 Hz, 2H), 7.18(d,J=6.6 Hz, 4H), 6.96(t,J=5.8 Hz, 1H), 3.13~2.98(m, 2H), 2.30(s, 3H), 1.05(t,J=7.2 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 166.96, 162.56(J=244.5 Hz), 160.45, 152.35, 142.87, 137.29, 132.38, 129.36, 129.11, 128.54(J=8.25 Hz), 126.71, 126.58, 125.67, 118.96, 118.81, 115.56(J=21.75 Hz), 82.79, 36.82, 20.91, 15.32; HR-MS(ESI)m/z: Calcd for C24H20Cl2FN3O4SH+{[M+H]+}536.0608(35Cl), 538.0579(35Cl37Cl), found 536.0572(35Cl), 538.0555(35Cl37Cl)。
N-(2,5-dichloro-3-(5-(ethylamino)-3-(4-methoxyphenyl)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3f): white solid, m.p.210.1~211.8 ℃, 78% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.74(s, 1H), 9.72(s, 1H), 7.50(d,J=8.3 Hz, 2H), 7.30(s, 1H), 7.21(d,J=8.0 Hz, 2H), 7.11(d,J=8.8 Hz, 2H), 6.92~6.80(m, 3H), 3.76(s, 3H), 3.04(dq,J=10.7, 6.9 Hz, 2H), 2.30(s, 3H), 1.04(t,J=7.1 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 166.83, 160.85, 159.94, 152.42, 142.89, 137.34, 132.58, 129.39, 129.04, 127.77, 126.72, 125.63, 122.40, 119.37, 118.66, 113.91, 82.64, 55.15, 36.82, 20.96, 15.36; HR-MS(ESI)m/z: Calcd for C25H23Cl2N3O5SH+{[M+H]+}548.0808(35Cl), 550.0779(35Cl37Cl), found 548.0817(35Cl), 550.0802(35Cl37Cl)。
N-(2,5-dichloro-3-(5-(ethylamino)-3-(furan-2-yl)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3g): white solid, m.p.215.2~217.4 ℃, 73% yield;1H NMR(300 MHz, Acetone-d6)δ: 8.73(s, 1H), 8.41(s, 1H), 7.64(d,J=7.6 Hz, 3H), 7.54(d,J=1.8 Hz, 1H), 7.31(d,J=8.0 Hz, 2H), 6.45(dd,J=3.4 Hz, 1.8 Hz, 1H), 6.37~6.28(m, 1H), 6.01(d,J=3.4 Hz, 1H), 3.31~3.19(m, 2H), 2.36(s, 3H), 1.15(t,J=7.2 Hz, 3H);13C NMR(75 MHz, Acetone-d6)δ: 168.17, 154.70, 153.05, 145.45, 144.54, 144.38, 138.26, 132.25, 130.43, 129.15, 128.13, 127.45, 120.12, 119.05, 112.08, 110.61, 82.44, 38.33, 21.47, 15.81; HR-MS(ESI)m/z: Calcd for C22H19Cl2N3O5SK+{[M+K]+}546.0054(35Cl), 548.0025(35Cl37Cl), found 546.0059(35Cl), 548.0023(35Cl37Cl)。
N-(2,5-dichloro-3-(5-(ethylamino)-3-(thiophen-2-yl)isoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3h): white solid, m.p.220.2~221.4 ℃, 88% yield;1H NMR(300 MHz, Acetone-d6)δ: 8.79(s, 1H), 8.41(s, 1H), 7.66(s, 1H), 7.63(d,J=8.4 Hz, 2H), 7.49(dd,J=5.1 Hz, 1.2 Hz, 1H), 7.27(d,J=8.0 Hz, 2H), 7.00(dd,J=5.1 Hz, 3.6 Hz, 1H), 6.75(dd,J=3.6 Hz, 1.2 Hz, 1H), 6.35(t,J=5.7 Hz, 1H), 3.38~3.12(m, 2H), 2.34(s, 3H), 1.15(t,J=7.2 Hz, 3H);13C NMR(75 MHz, Acetone-d6)δ: 168.50, 157.54, 153.34, 144.53, 138.19, 132.51, 131.94, 130.42, 129.45, 128.21, 128.12, 127.87, 127.58, 127.00, 120.20, 118.96, 82.94, 38.27, 21.49, 15.82; HR-MS(ESI)m/z: Calcd for C22H19Cl2N3O4S2Na+{[M+Na]+}546.0086(35Cl), 548.0057(35Cl37Cl), found 546.0078(35Cl), 548.0053(35Cl37Cl)。
N-(3-(3-(tert-butyl)-5-(ethylamino)isoxazol-4-yl)-2,5-dichloro-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3i): white solid, m.p.89.1~92.4 ℃, 74% yield;1H NMR(300 MHz, Acetone-d6)δ: 8.40(s, 1H), 8.35(s, 1H), 7.63(d,J=8.3 Hz, 2H), 7.61(s, 1H), 7.32(d,J=8.0 Hz, 2H), 5.87(t,J=5.9 Hz, 1H), 3.27~3.06(m, 2H), 2.39(s, 3H), 1.09(t,J=7.2 Hz, 3H), 0.99(s, 9H);13C NMR(75 MHz, Acetone-d6)δ: 170.22, 168.25, 153.21, 144.54, 138.14, 132.58, 130.47, 129.14, 128.18, 127.43, 120.67, 119.82, 82.51, 38.13, 33.55, 29.13, 21.48, 15.90; HR-MS(ESI)m/z: Calcd for C22H25Cl2N3O4SNa+{[M+Na]+}520.0835(35Cl), 522.0806(35Cl37Cl), found 520.0818(35Cl), 522.0788(35Cl37Cl)。
N-(2,5-dichloro-4-hydroxy-3-(5-(methylamino)-3-phenylisoxazol-4-yl)phenyl)-4-methylbenzenesulfonamide(3j): white solid, m.p.193.0~195.4 ℃, 86% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.74(s, 2H), 7.47(d,J=7.9 Hz, 2H), 7.42~7.28(m, 3H), 7.27(s, 1H), 7.21(d,J=8.2 Hz, 2H), 7.17(dt,J=6.9 Hz, 1.5 Hz, 2H), 6.87(q,J=4.9 Hz, 1H), 2.66(d,J=4.8 Hz, 3H), 2.30(s, 3H);13C NMR(75 MHz, DMSO-d6)δ: 167.52, 161.34, 152.41, 143.00, 137.24, 132.68, 130.07, 129.46, 129.31, 129.07, 128.53, 126.71, 126.46, 125.67, 119.22, 118.75, 82.75, 28.43, 21.02; HR-MS(ESI)m/z: Calcd for C23H19Cl2N3O4SH+{[M+H]+}504.0546(35Cl), 506.0517(35Cl37Cl), found 504.0549(35Cl), 506.0539(35Cl37Cl)。
N-(2,5-dichloro-4-hydroxy-3-(5-(isopropylamino)-3-phenylisoxazol-4-yl)phenyl)-4-methylbenzenesulfonamide(3k): white solid, m.p.193.1~195.4 ℃, 55% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.71(s, 2H), 7.48(d,J=8.3 Hz, 2H), 7.42~7.28(m, 3H), 7.28(s, 1H), 7.20(d,J=8.1 Hz, 2H), 7.18~7.11(m, 2H), 6.78(d,J=8.4 Hz, 1H), 3.59(dt,J=14.1 Hz, 6.9 Hz, 1H), 2.29(s, 3H), 1.08(dd,J=6.5 Hz, 4.4 Hz, 6H);13C NMR(75 MHz, DMSO-d6)δ: 166.55, 161.33, 152.47, 142.91, 137.40, 132.62, 130.14, 129.45, 129.27, 129.14, 128.50, 126.73, 126.51, 125.66, 119.26, 118.63, 83.06, 44.44, 23.21, 23.05, 21.03; HR-MS(ESI)m/z: Calcd for C25H23Cl2N3O4SH+{[M+H]+}532.0859(35Cl), 534.0830(35Cl37Cl), found 532.0870(35Cl), 534.0841(35Cl37Cl)。
N-(3-(5-(butylamino)-3-phenylisoxazol-4-yl)-2,5-dichloro-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3l): white solid, m.p.176.8~178.5 ℃, 60% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.74(s, 2H), 7.48(d,J=8.3 Hz, 2H), 7.42~7.28(m, 3H), 7.27(s, 1H), 7.20(d,J=8.2 Hz, 2H), 7.17(dd,J=8.2 Hz, 1.4 Hz, 2H), 6.98(t,J=6.0 Hz, 1H), 3.01(qd,J=7.4 Hz,2.3 Hz, 2H), 2.30(s, 3H), 1.40(p,J=7.2 Hz, 2H), 1.29~1.14(m, 2H), 0.83(t,J=7.3 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 166.99, 161.30, 152.41, 142.89, 137.36, 132.65, 130.11, 129.39, 129.22, 129.04, 128.47, 126.67, 126.46, 125.64, 119.26, 118.65, 82.62, 41.64, 31.75, 20.98, 19.29, 13.58; HR-MS(ESI)m/z: Calcd for C26H25Cl2N3O4SH+{[M+H]+}546.1016(35Cl), 548.0986(35Cl37Cl), found 546.0996(35Cl), 548.0974(35Cl37Cl)。
N-(2,5-dibromo-3-(5-(ethylamino)-3-phenylisoxazol-4-yl)-4-hydroxyphenyl)-4-methylbenzenesulfonamide(3m): white solid, m.p.189.3~193.8 ℃, 82% yield;1H NMR(300 MHz, Acetone-d6)δ: 8.70(s, 1H), 8.17(s, 1H), 7.75(s, 1H), 7.58(d,J=7.9 Hz, 2H), 7.44~7.36(m, 1H), 7.36~7.28(m, 4H), 7.24(d,J=8.0 Hz, 2H), 6.35~6.23(m, 1H), 3.37~3.20(m, 2H), 2.36(s, 3H), 1.18(t,J=7.2 Hz, 3H);13C NMR(75 MHz, Acetone-d6)δ: 168.38, 162.21, 154.14, 144.48, 138.21, 132.49, 131.27, 130.39, 130.11, 129.31, 128.09, 127.65, 126.27, 121.26, 109.54, 85.86, 38.25, 21.48, 15.91; HR-MS(ESI)m/z: Calcd for C24H21Br2N3O4SH+{[M+H]+}605.9692(79Br), 607.9672(79Br81Br), 609.9651(81Br), found 605.9682(79Br), 607.9682(79Br81Br), 609.9648(81Br)。
N-(3-(5-(ethylamino)-3-phenylisoxazol-4-yl)-4-hydroxy-2,5-dimethylphenyl)-4-methylbenzenesulfonamide(3n): white solid, m.p.204.4~205.7 ℃, 99% yield;1H NMR(300 MHz, DMSO-d6)δ: 9.11(s, 1H), 8.24(s, 1H), 7.43~7.33(m, 3H), 7.33~7.27(m, 2H), 7.24(dd,J=8.3 Hz, 1.7 Hz, 2H), 7.15(d,J=8.0 Hz, 2H), 6.79(s, 1H), 6.56(t,J=5.9 Hz, 1H), 3.02(dq,J=13.4 Hz, 6.7 Hz, 2H), 2.29(s, 3H), 2.06(s, 3H), 1.35(s, 3H), 1.03(t,J=7.1 Hz, 3H);13C NMR(75 MHz, DMSO-d6)δ: 166.92, 161.31, 153.76, 142.41, 137.60, 134.80, 130.84, 130.55, 129.24, 129.08, 128.35, 126.59, 126.54, 125.67, 121.51, 117.13, 84.21, 36.87, 20.93, 16.44, 15.54, 14.65; HR-MS(ESI)m/z: Calcd for C26H27N3O4SH+{[M+H]+}478.1795, found 478.1799。
2 结果与讨论
2.1 反应条件优化
以3-苯基-5-氨基异噁唑1a和2,5-二氯取代的对苯醌单亚胺2a为反应的模板底物,对反应条件进行了筛选,实验结果见表1。首先,考察了不同的酸对反应的催化作用(Table 1, Entries 1~4),其中联萘酚磷酸酯(PA)作催化剂时能以较好的产率得到目标产物。接着为进一步提高反应的产率,开展了对反应溶剂的筛选。当使用其他氯代溶剂时,反应的产率均出现了不同程度的降低(Table 1, Entries 5~7);在甲叔醚或氯苯中,反应产率出现了大幅降低(Table 1, Entries 8, 10);而在四氢呋喃和乙腈中反应不能发生。因此,仍以氯仿为最优溶剂。最后,在最优催化剂和溶剂下对反应温度进行了考察(Table 1, Entries 13~14)。结果表明,降低反应温度对反应速率减慢,产率也出现一定程度降低。综上,以氯仿作溶剂,在PA(10 mmol/mmol)催化下,0 ℃反应为最优条件。
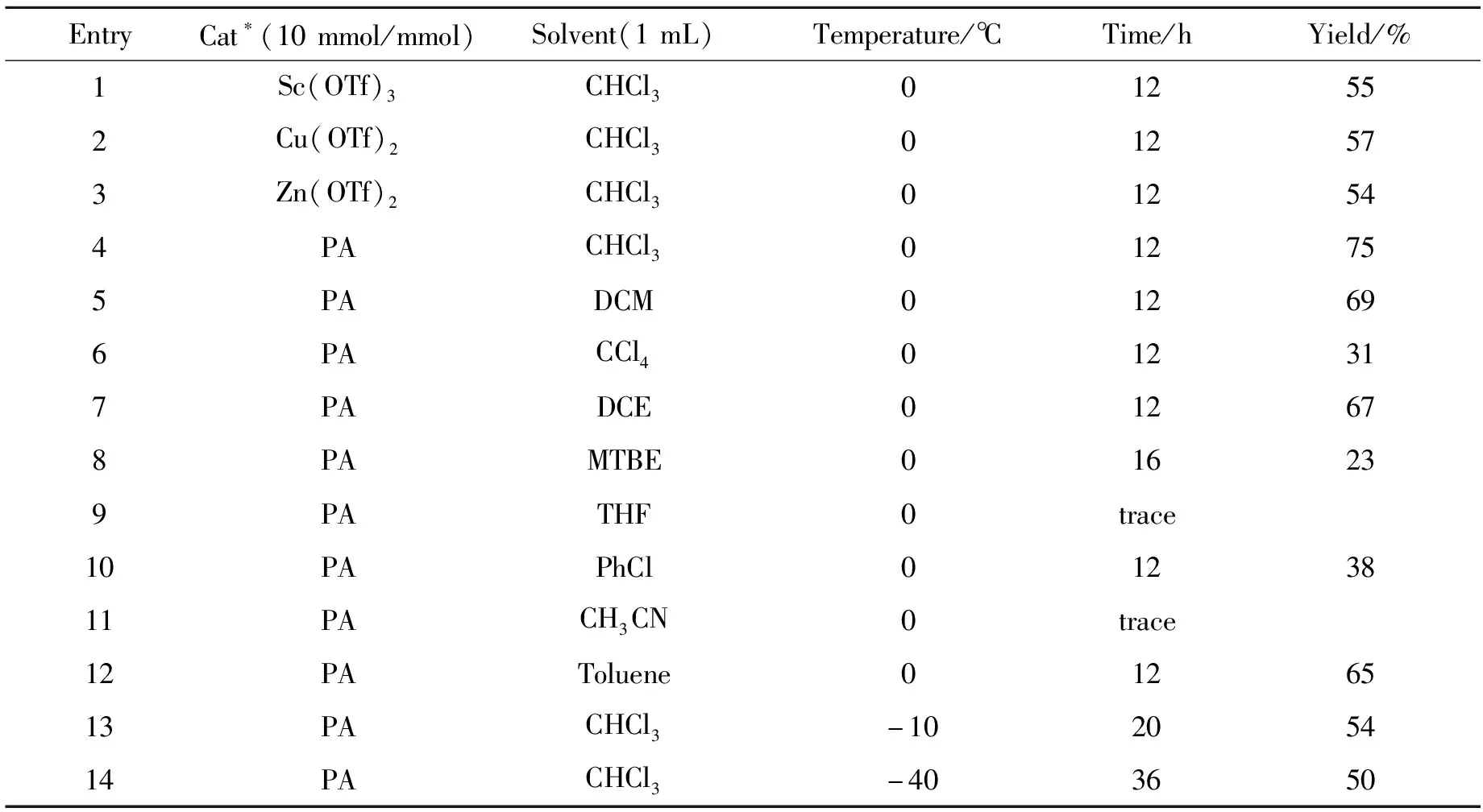
表1 5-氨基异噁唑与对苯醌单亚胺反应条件的优化
2.2 底物普适性研究
在最优条件下,对反应的底物进行了普适性研究,实验结果见Scheme 1 所示。由结果表明,异噁唑C3位苯环取代基无论是给电子还是吸电子基都对反应均具有很好的普适性(3a~3f);异噁唑C3位为其他芳杂环或是烷烃取代基对该反应依然有较好的适应性(3g~3i);异噁唑C5位氨基的不同保护基对该反应同样具有很好的适应性(3j~3l);对于对苯醌单亚胺上不同取代基考察发现,当使用给电子取代基时反应可以以定量的产率得到目标产物3n。

Scheme 1
报道了在温和的条件下5-氨基异噁唑和取代对苯醌单亚胺发生的加成反应,可以以中等到优秀的产率(55%~99% yield)构建一系列新颖的异噁唑C4位芳基化产物。反应对不同取代基的底物均具有很好的普适性。
