新型异吲哚酮衍生物的合成与活性研究
2022-03-16曹瑞霞贾玉萍
曹瑞霞, 贾玉萍
(1.齐鲁师范学院 化学与化工学院,山东 济南 250200;2.山东省药学科学院,山东 济南 250101)
癌症是全球第二大人类死亡诱因,根据世界卫生组织的数据,2018年癌症造成约960万人死亡[1]。其主要原因是恶性肿瘤细胞无管制的生长,扩散到人体不同的器官[2]。在男性中,癌症最常发生在肺、前列腺、结肠直肠、胃和肝脏器官;而对于女性,常发生于乳房、结肠、肺、宫颈和胃器官[3-4]。近几年对癌症治疗的药物研究引起了世界科学家极大的关注[5-6]。
异吲哚酮是许多具有重要生物、药物活性化合物的基本骨架结构。作为一类杂环生物碱,它主要存在于天然产物,如Cichorine(1, Chart 1)[7]和Vitedoamine A(2)[8],以及部分重要的合成药物中,如Indoprofen(3)[9]和Lenalidomide(4)[10-11]。异吲哚酮结构具有显著的生物活性,如能抑制肿瘤细胞生长[12],抗A型流感病毒(H1N1)活性[13],抗多种植物病原体活性[14],潜在治疗II型糖尿病等代谢综合症活性[15]。因此,异吲哚酮作为母核结构,具有良好的生物活性,在新药研发中具有重要的研究价值[16]。

Chart 1

Chart 2
邻卤代甲基或邻酰基苯甲酸酯与胺类物质的缩合反应是合成异吲哚酮类化合物的传统方法[17-21],邻苯二甲酰亚胺的选择性还原以及苯并[c]吡咯酮衍生物的各种有机转化也被用于合成异吲哚酮衍生物[22]。氮的烷基化或者芳基化合成的产物涉及到包括化工、医疗、医药及国防等重要科技领域[23]。然而在异吲哚酮结构的N-2位引入不同的烷基或者芳基的报道较少。以Lenalidomide为先导物,对N-2位的哌啶-2,6-二酮和4-位胺基进行结构修饰,在N-2位通过变换不同的R2基团引入不同的芳基和吡啶基,以及引入正已基,4-位胺基分别被不同取代位置的溴基团R1修饰,设计合成了I,II和III等3个系列化合物(Chart 2),有望得到生物活性较好且生物利用度较高的异吲哚酮衍生物。
本文以不同溴代的2-甲基苯甲酸(1a~1c)为原料,使用浓盐酸催化生成甲酯得到中间体(2a~2c);然后在偶氮二异丁腈催化下,与N-溴代丁二酰亚胺发生溴代反应,生成不同的苄溴(3a~3c);最后与不同的苯胺,吡啶胺和正已胺反应,得到15个新的异吲哚酮衍生物(I1~I5,II1~II5和III1~III5,Scheme 1),其结构经1H NMR和HR-MS(ESI)表征。并研究了15个新化合物对人肺癌细胞A549、人结肠癌细胞Colo205、人胰腺癌细胞PNAC-1和人骨髓瘤细U266的体外抑制活性。
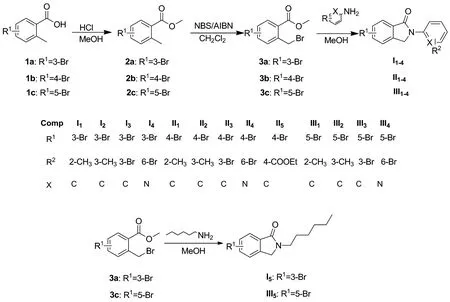
Scheme 1
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪(温度未校正);Bruker AV 400 MHz型核磁共振仪(DMSO-d6,CDCl3为溶剂,TMS为内标);Agilent 6540 Q-TOF(ESI)型质谱仪。
3-溴-2-甲基苯甲酸、4-溴-2-甲基苯甲酸、5-溴-2-甲基苯甲酸、N-溴代丁二酰亚胺(NBS)、偶氮二异丁腈(AIBN)、间溴苯胺、正己胺、2-溴-6-氨基吡啶、邻甲苯胺、间甲基苯胺、4-氨基苯甲酸乙酯、甲醇、二氯甲烷和浓盐酸均为分析纯或化学纯;A549、Colo205、PNAC-1和U266,中科院上海细胞库;其余所用试剂均为分析纯。
1.2 合成
(1)2a~2c的合成通法[24]
将原料1a~1c0.093 mol和3 mL浓盐酸加入200 mL甲醇中,加热回流反应8 h(TLC检测)。冷却至室温,用乙酸乙酯萃取,有机相依次用饱和NaHCO3溶液洗涤3次,无水Na2SO4干燥,浓缩蒸干得中间体2a~2c,收率96%。
(2)3a~3c的合成通法
将中间体2a~2c0.029 mol,AIBN 0.0029mol和NBS 0.032 mol加入100 mL二氯甲烷溶液中,加热回流反应4 h(TLC检测)。待原料反应完后,冷却至室温,用二氯甲烷萃取,有机相用饱和食盐水洗涤3次,无水Na2SO4干燥,浓缩蒸干得中间体3a~3c(不经纯化,直接用于下步反应)。
(3)I1~I5,II1~II5和III1~III5的合成通法
将中间体3a~3c0.003 mol和不同的芳香胺或者正已胺 0.003 mol 在20 mL 甲醇溶液中,搅拌下于60 ℃反应至终点(TLC检测)。冷却至室温,用乙酸乙酯萃取,有机相用饱和食盐水洗涤3次,无水Na2SO4干燥,浓缩蒸干,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚,V/V=1/5)纯化得化合物I1~I5,II1~II5和III1~III5。
4-溴-2-(2-甲基苯基)-2,3二氢异吲哚-1-酮(I1): 淡黄色固体,收率52.10%, m.p.106.5~109.5 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.367(s, 3H), 4.949(s, 2H), 7.030(d,J=7.6 Hz, 1H), 7.330(t,J=7.6 Hz, 1H), 7.528(t,J=7.6 Hz, 1H), 7.723(s, 1H), 7.788(m, 2H), 7.897(d,J=8.0 Hz, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr{[M+H]+}302.0175, found 302.0169。
4-溴-2-(3-甲基苯基)-2,3二氢异吲哚-1-酮(I2): 淡黄固体,收率68.60%,108.5~110.5 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.368(s, 3H), 4.949(s, 2H), 7.030(d,J=7.2 Hz, 1H), 7.330(t,J=7.6 Hz, 1H), 7.529(t,J=7.6 Hz, 1H), 7.724(s, 1H), 7.802(m, 2H), 7.902(d,J=4.4 Hz, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr{[M+H]+}302.0175, found 302.0178。
4-溴-2-(3-溴苯基)-2,3二氢异吲哚-1-酮(I3): 淡黄色固体,收率52.68%,m.p.148.5~151.6 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 4.982(s, 2H), 7.399(m, 2H), 7.531(t,J=7.6 Hz, 1H), 7.820(d,J=7.6 Hz, 1H), 7.903(s, 1H), 7.918(d,J=2.4 Hz, 1H), 8.243(s, 1H); HR-MS(ESI)m/z: Calcd for C14H10NOBr2{[M+H]+}365.9124, found 365.9121。
4-溴-2-(6-溴吡啶基)-2,3二氢异吲哚-1-酮(I4): 淡黄色固体,收率51.44%, m.p.218.5~221.6 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 4.956(s, 2H), 7.466(d,J=7.6 Hz, 1H), 7.547(t,J=7.6 Hz,1H), 7.862(m, 2H), 7.951(d,J=8.0 Hz, 1H), 8.510(d,J=8.4 Hz, 1H); HR-MS(ESI)m/z: Calcd for C13H9N2OBr2{[M+H]+}366.9076, found 366.9073。
4-溴-2-已基-2,3二氢异吲哚-1-酮(I5): 淡黄色固体,收率48.65%,m.p.86.5~89.3 ℃;1H NMR(CDCl3, 400 MHz)δ: 0.889(t,J=6.8 Hz, 3H), 1.359(m, 6H), 1.682(m, 2H), 3.627(d,J=7.6 Hz, 2H), 4.298(s, 2H), 7.361(t,J=7.6 Hz, 1H), 7.645(d,J=7.6 Hz, 1H), 7.793(d,J=7.6 Hz, 1H); HR-MS(ESI)m/z: Calcd for C14H19NOBr{[M+H]+}296.0645, found 296.0649。
5-溴-2-(2-甲基苯基)-2,3二氢异吲哚-1-酮(II1): 淡黄色固体,收率62.48%, m.p.185.60~187.65 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.358(s, 3H), 5.006(s, 2H), 7.019(d,J=7.2 Hz, 1H), 7.327(t,J=7.6 Hz, 1H), 7.729(m, 4H), 7.916(s, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr {[M+H]+}302.0175, found 302.0178。
5-溴-2-(3-甲基苯基)-2,3二氢异吲哚-1-酮(II2): 淡黄色固体,收率77.84%,m.p.181.80~184.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.361(s, 3H), 5.011(s, 2H), 7.022(d,J=7.6 Hz, 1H), 7.329(t,J=7.6 Hz, 1H), 7.727(dd,J=8.4 Hz,J=12.8 Hz, 4H), 7.920(s, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr{[M+H]+}302.0175, found 302.0172。
5-溴-2-(3-溴苯基)-2,3二氢异吲哚-1-酮(II3): 淡黄色固体,收率70.81%, m.p.140.50~143.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 5.046(s, 2H), 7.403(m, 2H), 7.741(t,J=8.4 Hz, 2H), 7.849(d,J=8.0 Hz, 1H), 7.935(s, 1H), 8.209(s, 1H); HR-MS(ESI)m/z: Calcd for C14H10NOBr2{[M+H]+}365.9124, found 365.9119。
5-溴-2-(6-溴吡啶基)-2,3二氢异吲哚-1-酮(II4): 白色固体,收率54.50%, m.p.219.50~222.50 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 5.066(s, 2H), 7.449(d,J=7.6 Hz, 1H), 7.760(s, 2H), 7.852(t,J=8.0 Hz, 1H), 8.008(s, 1H), 8.517(d,J=8.4 Hz, 1H); HR-MS(ESI)m/z: Calcd for C13H9N2OBr2{[M+H]+}366.9076, found 366.9069。
4-(5-溴-1-羰基-1,3-二氢异吲哚-2-基)苯甲酸乙酯(II5): 白色固体,收率64.20%, m.p.220.10~223.50 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 1.339(t,J=6.8 Hz, 3H), 4.323(dd,J=6.8 Hz,J=13.6 Hz, 2H), 5.080(s, 2H), 7.754(s, 2H), 7.956(s, 1H), 8.049(dd,J=8.4 Hz,J=12.0 Hz, 4H); HR-MS(ESI)m/z: Calcd for C17H15NO3Br{[M+H]+}360.0230, found 360.0235。
6-溴-2-(2-甲基苯基)-2,3二氢异吲哚-1-酮(III1): 黄色固体,收率57.95%, m.p.169.10~171.50 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.360(s, 3H), 4.996(s, 2H), 7.027(d,J=7.2 Hz, 1H), 7.334(m, 1H), 7.645(d,J=8.0 Hz, 1H), 7.711(t,J=3.6 Hz, 2H), 7.864(dd,J=1.6 Hz,J=8.0 Hz, 1H), 7.904(d,J=1.6 Hz, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr{[M+H]+}302.0175, found 302.0173。
6-溴-2-(3-甲基苯基)-2,3二氢异吲哚-1-酮(III2): 淡黄色固体,收率61.96%, m.p.173.50~175.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 2.360(s, 3H), 4.991(s, 2H), 7.026(d,J=7.6 Hz, 1H), 7.332(m, 1H), 7.642(d,J=8.0 Hz, 1H), 7.705(s, 2H), 7.861(dd,J=1.6 Hz,J=8.0 Hz, 1H), 7.900(d,J=1.6Hz, 1H); HR-MS(ESI)m/z: Calcd for C15H13NOBr{[M+H]+}302.0175, found 302.0171。
6-溴-2-(3-溴苯基)-2,3二氢异吲哚-1-酮(III3): 淡黄色固体,收率50.06%,m.p.207.20~210.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 5.030(s, 2H), 7.427(t,J=7.6 Hz, 2 H), 7.655(d,J=7.6 Hz, 1H), 7.874(t,J=8.8 Hz, 2H), 7.932(s, 1H), 8.219(s, 1H); HR-MS(ESI)m/z: Calcd for C14H10NOBr2{[M+H]+}365.9124, found 365.9127。
6-溴-2-(6-溴吡啶基)-2,3二氢异吲哚-1-酮(III4): 白色固体,收率64.50%,m.p.219.40~222.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 5.015(s, 2H), 7.439(d,J=7.6 Hz, 1H), 7.699(d,J=8.0 Hz, 1H), 7.839(t,J=8.0 Hz, 1H), 7.895(d,J=8.0 Hz, 1H), 7.933(s, 1H), 8.487(d,J=8.4Hz, 1H); HR-MS(ESI)m/z: Calcd for C13H9N2OBr2{[M+H]+}366.9076, found 366.9071。
6-溴-2-已基-2,3二氢异吲哚-1-酮(III5): 白色固体,收率71.50%, m.p.84.50~86.60 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 0.856(t,J=6.8 Hz, 3H), 1.271(m, 6H), 1.584(m, 2H), 3.501(t,J=7.2 Hz, 2H), 4.447(s, 2H), 7.571(d,J=8.4 Hz, 1H), 7.765(d,J=2.0 Hz, 1H), 7.787(s, 1H); HR-MS(ESI)m/z: Calcd for C14H19NOBr{[M+H]+}296.0645, found 296.0649。
1.3 性能或活性测试
采用MTT法[25]测试了目标化合物对不同肿瘤细胞的增殖抑制作用。将目标化合物(I1~I5,II1~II5和III1~III5)配制成5个不同浓度,分别测定作用48 h后对人肺癌细胞A549、人结肠癌细胞Colo205、人胰腺癌细胞PNAC-1和人骨髓瘤细胞U266增殖的影响。在酶标仪570 nm测定吸光度值,并计算抑制率。
2 结果与讨论
2.1 合成
本文以不同溴代的2-甲基苯甲酸(1a~1c)为原料,在甲醇溶液中加入浓盐酸催化,生成中间体(2a~2c),该反应简单,后处理容易。本文没有采用二氯亚砜生成甲酯的方法,因为二氯亚砜有异味,易潮解,存在潜在危险。
在第二步反应中,大部分文献报道使用四氯化碳作溶剂[26-35],四氯化碳对身体损害比较大,并且对大气污染危害严重。依据《蒙特利尔协议》的有关规定,我国于2007年起在全国境内全面禁止四氯化碳的使用,至2014年我国必须全部停用[36]。随着协议在我国的执行,购买四氯化碳必须出具国家环保总局签发的采购证明。所以,寻找四氯化碳的替代品成为了当务之急。在最近的苄溴化反应研究中,也有采用新戊酸甲酯、二氯甲烷、氯仿、氯苯及二硫化碳等替代四氯化碳溶剂进行苄溴化反应[37]。本文尝试使用二氯甲烷作溶剂,在AIBN催化下,与NBS发生溴代反应,反应收率很好。为苄溴化反应溶剂的选择,提供了一条可靠的参考依据。
最后一步不同的苄溴和不同的胺关环,生成15个新的异吲哚酮衍生物(I1~I5,II1~II5和III1~III5),此反应需要在甲醇中加热,用TLC检测反应,直到原料消失。实验结果表明,以此法制备目标化合物,反应能较好地进行,且后处理方便。
2.2 体外细胞抑制活性
测试了目标化合物(I1~I5,II1~II5和III1~III5)对人肺癌细胞A549、人结肠癌细胞Colo205、人胰腺癌细胞PNAC-1和人骨髓瘤细胞U266增殖的影响,结果见表1。
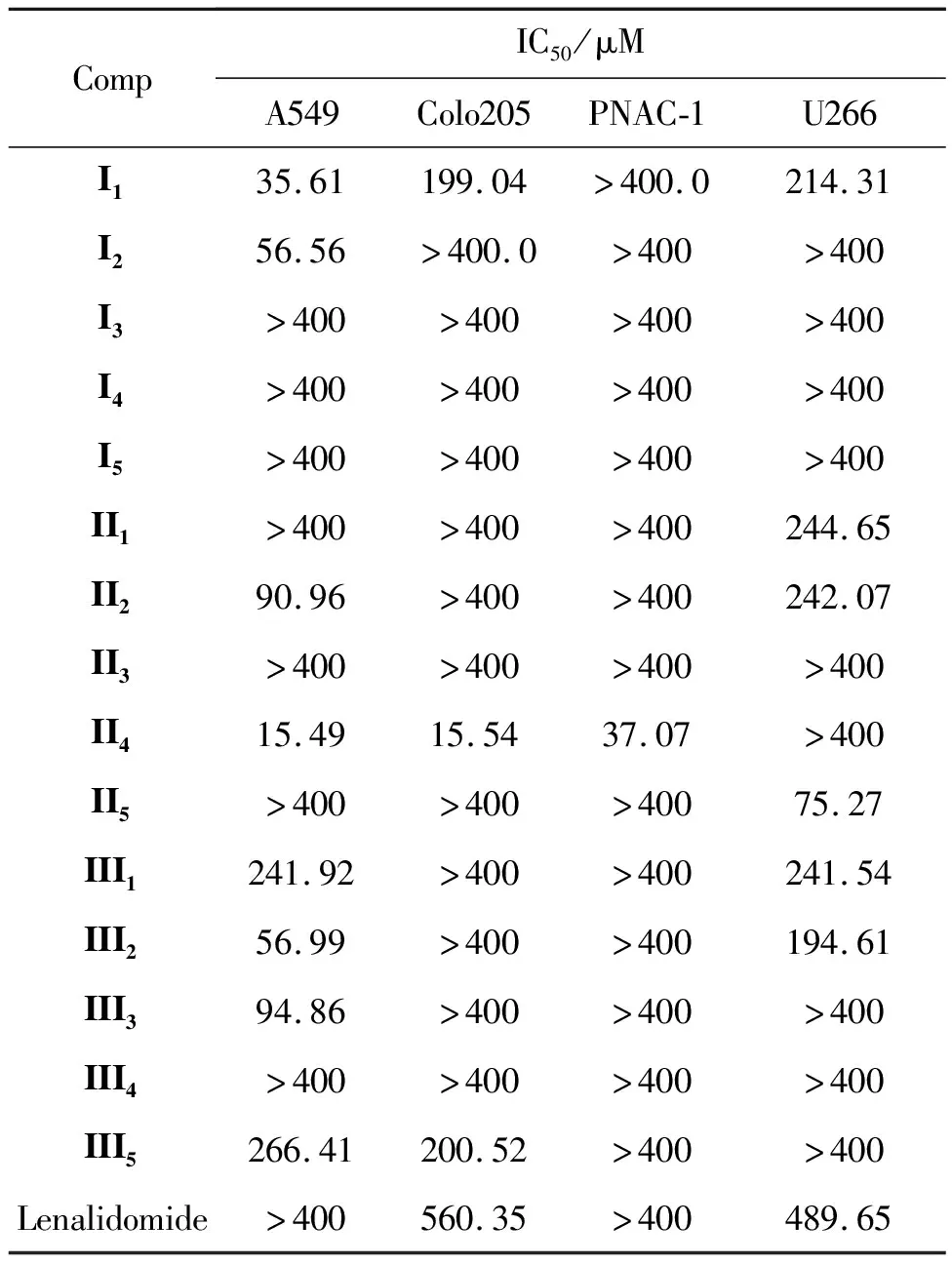
表1 化合物的体外细胞抑制活性
由表1可知,对人肺癌细胞A549抑制活性顺序是:II4>I1>I2>III2>II2>III3>III1>III5,化合物II4(IC50=15.49 μM)抑制活性最好; 对人结肠癌细胞Colo205有3个化合物有抑制作用,其顺序为II4>I1>III5,化合物II4(IC50=15.54 μM)活性最好; 对人胰腺癌细胞PNAC-1有最好抑制活性的是化合物II4(IC50=37.07 μM);对人骨髓瘤细胞U266有抑制活性顺序为II5>III2>I1>III1>II2>II1,化合物II5(IC50=75.27 μM)抗肿瘤活性最好。
取代基R2的种类和位置对化合物的抑制活性有明显影响。I系列中I1(R2=2-CH3, X=C)和I2(R2=3-CH3, X=C)对人肺癌细胞A549的抑制活性较好,IC50分别为35.61 μM和56.56 μM。I1对人结肠癌细胞Colo205和人骨髓瘤细胞U266也有一定的抑制活性,其他化合物活性较弱;II系列中II4(R2=6-Br, X=N)对人肺癌细胞A549、人结肠癌细胞Colo205和人胰腺癌细胞PNAC-1具有很好的抑制活性,II2(R2=3-CH3, X=C)对人肺癌细胞A549有抑制活性,IC50为90.96 μM,II5(R2=4-COOEt, X=C)对人骨髓瘤细胞U266抗肿瘤活性最好,IC50为75.27 μM;III系列中I2(R2=3-CH3,X=C)和I3(R2=3-Br, X=C)对人肺癌细胞A549有较好的抑制活性,IC50分别为56.99 μM和94.86 μM,其他取代基对4种肿瘤细胞的抑制活性较弱。
对比化合物I1~I5,II1~II5和III1~III5对人肺癌细胞A549、人结肠癌细胞Colo205和人胰腺癌细胞PNAC-1的抑制活性发现,II4(R2=6-Br, X=N)抑制活性最好,在异吲哚环N-2位引入吡啶环,能够增强其生物活性。
探索了异吲哚酮衍生物合成方法。该反应路线原料易得,操作方便。对溴化反应的溶剂进行了改进,尝试了文献报道较少的二氯甲烷替代四氯化碳,给该类反应提供了可靠的参考依据。初步的生物活性研究表明,在N-2位引入芳香杂环取代时,化合物的抑制活性更强。芳香杂环有利于化合物电荷的分散而稳定,进一步增强化合物的抑制活性,具有进一步研究的价值。
