串联型氮杂-迈克尔加成/分子内亲核取代反应构建1,3-硅杂四氢吡啶环
2022-03-16李林洁宋振雷
李林洁, 范 昱, 马 昌, 高 璐, 宋振雷
(四川大学 华西药学院,四川 成都 610041)
碳和硅在元素周期表中同属第IV主族,但分属第二、三周期。因此两者在性质上既有相似性也存在差异。硅和碳在性质上“同异共存”的特点使硅成为了碳非常理想的生物电子等排体。近年来,将生物活性分子结构中的碳替换成硅,或者是构建新的含硅活性分子正在成为重要且实用的药物创新研发策略,并且已有9个含硅分子进入了临床研究[1]。研究表明,硅元素的引入在提升活性分子的组织渗透性,提高活性以及降低毒性等诸多方面均表现出了吸引人的优势。
六元氮环是药物、天然产物等生物活性分子中广泛存在的一类核心结构和关键药效团,例如用于治疗抑郁症、精神分裂症、癫痫[5, 6]等神经系统疾病的各种活性分子中均含有此类结构(Chart 1a)。目前,难以透过血脑屏障是神经疾病类药物通常存在的主要问题之一,即使在较大的用药量下也难以获得理想的效果。硅元素的引入通常能够增加分子的亲脂性,继而提升其组织渗透性,因而正在成为改善上述问题非常有希望的策略(Chart 1b)。但是,目前构建硅杂六元氮环的方法以及相应的结构类型均十分有限。鉴于此,本课题组在有机硅试剂的开发和应用方面的研究基础上,开发了2-硅-1,3-碘代对甲苯磺酰胺试剂,并应用该试剂发展了串联型氮杂-迈克尔加成/分子内亲核取代反应,实现了一系列结构新颖的1,3-硅杂四氢吡啶环的合成。

Chart 1
2-硅-1,3-碘代对甲苯磺酰胺8通过Scheme 1所示的方法合成。商业可得的二氯亚甲基二甲基硅烷5与碘化钠在丙酮中回流4 h后,以99%的收率给出双碘代产物6。化合物6在碳酸氢钠促进下与商业可得的N-(叔丁氧羰基)对甲苯磺酰胺发生分子间单取代,生成化合物7。化合物7随后在三氟乙酸作用下脱除叔丁氧酰基,以两步50%的收率给出2-硅-1,3-碘代对甲苯磺酰胺8。

Scheme 1
以碳酸钾做碱,乙腈为反应溶剂,在70 ℃下反应4 h后,2-硅-1,3-碘代对甲苯磺酰胺8与炔酯以及烷基、芳基和杂环取代的炔酮顺利地发生串联型氮杂-迈克尔加成/分子内亲核取代反应。通过该反应,以中等至优秀的收率(40%~90%)合成了如Scheme 2所示的16个结构新颖的1,3-硅杂四氢吡啶化合物9a~9p。
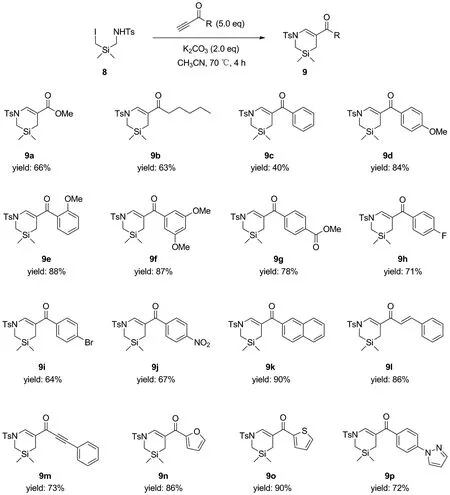
Scheme 2
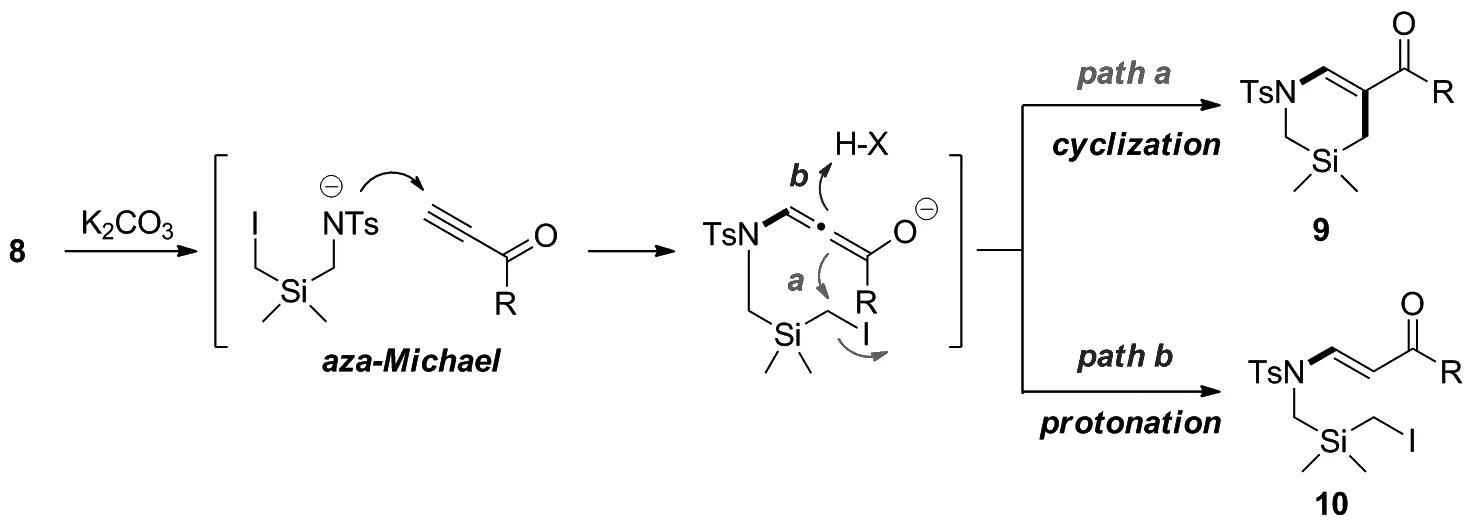
Scheme 3
1 实验部分
1.1 仪器与试剂
Bruker AC-E400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Finnigan LCQDECA型质谱仪;Agilent LCMS QQQ 6420A型液质联用仪。
硅胶,200~300目,青岛海洋化工厂;GF254硅胶板,烟台江友硅胶开发有限公司;其余所用试剂均为分析纯。
1.2 合成
(1)8的合成
6: 将商业可得的二氯亚甲基二甲基硅烷5(6.28 g, 40 mmol),丙酮(200 mL)加入圆底烧瓶中,加入NaI(30 g, 200 mmol),于60 ℃回流反应3~4 h。减压浓缩,残余物用硅胶快速柱层析(洗脱剂:石油醚)纯化得无色液体6(7.48 g, 99%);1H NMR(400 MHz, CDCl3)δ: 2.12(s, 4H), 0.31(s, 6H)。其余数据与文献报道一致[15]。
7: 室温下,将N-(叔丁氧羰基)对甲苯磺酰胺(9.975 g, 36.75 mmol)用DMF(400 mL)溶解后,加入底物6(12.5 g, 36.75 mmol)和碳酸氢钠(6.175 g, 73.5 mmol),于30 ℃反应7 h。用饱和NH4Cl溶液(200 mL)淬灭反应,乙酸乙酯(3×200 mL)萃取,合并有机相,依次用水和饱和NaCl溶液(2×600 mL)洗涤,无水Na2SO4干燥,过滤,减压浓缩得到粗品,立即用于下一步反应[7]。
8: 粗品7用DCM(400 mL)稀释后,缓慢滴入三氟乙酸(115 g, 1.1 mol),滴毕,于室温反应30 min。用饱和NaHCO3溶液(200 mL)淬灭反应,DCM(3×200 mL)萃取,合并有机相,依次用饱和NaCl溶液洗涤,无水Na2SO4干燥,过滤,减压浓缩,残余物经硅胶快速柱层析(梯度洗脱液:0~13%乙酸乙酯/石油醚)纯化得白色固体87.04 g,两步收率共50%[16], m.p.110.7~112.5 ℃;1H NMR(400 MHz, CDCl3)δ: 7.75(d,J=8.4 Hz, 2H), 7.32(d,J=8.4 Hz, 2H), 4.53(t,J=6.0 Hz, 1H), 2.44(s, 3H), 2.42(s, 2H), 1.99(s, 2H), 0.19(s, 6H);13C NMR(100 MHz, CDCl3)δ: 143.69, 135.31, 129.87, 127.67, 31.29, 21.69,-4.04,-16.69;HR-MSm/z: Calcd for C11H18INO2SSi{[M+Na]+}415.9770, found 415.9754。
(2)9的合成
9a: 手套箱环境下,加入底物7(38.3 mg, 0.1 mmol),丙炔酸甲酯(42 mg, 0.5 mmol), K2CO3(27.6 mg, 0.2 mmol),再加入乙腈(1 mL),于70 ℃反应4 h。反应液减压浓缩,残余物经硅胶快速柱层析(梯度洗脱液:0~13%乙酸乙酯/石油醚)纯化得白色固体9a(22 mg, 66%), m.p.121.2~123.8 ℃;1H NMR(400 MHz, CDCl3)δ: 8.14(s, 1H), 7.70(d,J=8.0 Hz, 2H), 7.33(d,J=8.0 Hz, 2H), 3.74(s, 3H), 2.67(s, 2H), 2.44(s, 3H), 1.43(s, 2H), 0.08(s, 6H);13C NMR(100 MHz, CDCl3)δ: 169.54, 144.58, 136.85, 134.00, 130.09, 127.62, 105.49, 51.98, 32.50, 21.76, 8.14,-4.10; HR-MS(ESI-TOF)m/z: Calcd for C15H21NO4SSi{[M+Na]+}362.0853, found 362.0856。
参考9a合成9b~9p。
9b: 淡黄色固体23.9 mg,产率63%, m.p.112.5~114.8 ℃;1H NMR(400 MHz, CDCl3)δ: 8.08(s, 1H), 7.70(d,J=8.0 Hz, 2H), 7.35(d,J=8.0 Hz, 2H), 2.68(s, 2H), 2.64(t,J=7.5 Hz, 2H), 2.44(s, 3H), 1.73~1.62(m, 2H), 1.61(s, 2H), 1.37~1.31(m, 4H), 0.91(t,J=6.7 Hz, 3H), 0.06(s, 6H);13C NMR(100 MHz, CDCl3)δ: 200.67, 144.80, 137.72, 133.86, 130.16, 127.55, 116.04, 37.28, 32.64, 31.79, 25.56, 22.70, 21.76, 14.12, 6.74,-4.13; HR-MS(ESI-TOF)m/z: Calcd for C19H29NO3SSi{[M+Na]+}402.1530, found 402.1532。
9c: 白色固体15.4 mg,产率40%, m.p.137.2~141.3 ℃;1H NMR(400 MHz, CDCl3)δ: 7.75(s, 1H), 7.60(d,J=8.0 Hz, 2H), 7.54~7.50(m, 3H), 7.46~7.43(m, 2H), 7.34(d,J=8.0 Hz, 2H), 2.78(s, 2H), 2.45(s, 3H), 1.62(s, 2H), 0.14(s, 6H);13C NMR(150 MHz, CDCl3)δ: 197.87, 144.91, 142.65, 139.50, 133.87, 131.17, 130.14, 128.99, 128.34, 127.58, 115.88, 32.97, 21.79, 7.59,-4.02; HR-MS(ESI-TOF)m/z: Calcd for C20H23NO3SSi{[M+Na]+}408.1060, found 408.1062。
9d: 淡黄色固体35 mg,产率84%, m.p.122.6~124.7 ℃;1H NMR(600 MHz, CDCl3)δ7.73(s, 1H), 7.62(d,J=8.0 Hz, 2H), 7.55(d,J=8.3 Hz, 2H), 7.34(d,J=8.0 Hz, 2H), 6.94(d,J=8.3 Hz, 2H), 3.88(s, 3H), 2.76(s, 2H), 2.45(s, 3H), 1.60(s, 2H), 0.13(s, 6H);13C NMR(100 MHz, CDCl3)δ196.83, 162.29, 144.80, 141.08, 133.91, 131.68, 131.36, 130.10, 127.55, 55.54, 32.93, 21.76, 8.03,-4.03; HR-MS(ESI-TOF)m/z: Calcd for C21H25NO4SSi{[M+Na]+}438.1166, found 438.1162。
9e: 淡黄色固体36.4 mg,产率88%, m.p.114.1~118.0 ℃;1H NMR(400 MHz, CDCl3)δ: 7.65(s, 1H), 7.52(d,J=8.4 Hz, 2H), 7.42~7.37(m, 1H), 7.30(d,J=8.0 Hz, 2H), 7.13(dd,J=7.4, 1.8 Hz, 1H), 7.03~6.94(m, 2H), 3.78(s, 3H), 2.72(s, 2H), 2.43(s, 3H), 1.59(s, 2H), 0.11(s, 6H);13C NMR(100 MHz, CDCl3)δ: 196.97, 156.41, 144.72, 143.43, 133.82, 130.94, 130.00, 129.64, 128.76, 127.47, 120.55, 116.97, 111.47, 55.73, 32.94, 21.72, 6.55,-4.15; HR-MS(ESI-TOF)m/z: Calcd for C21H25NO4SSi{[M+Na]+}438.1166, found 438.1168。
9f: 淡黄色固体38.5 mg,产率87%, m.p.111.0~115.6 ℃;1H NMR(400 MHz, CDCl3)δ: 7.84(s, 1H), 7.63(d,J=8.3 Hz, 2H), 7.34(d,J=8.0 Hz, 2H), 6.64(d,J=2.3 Hz, 2H), 6.59(t,J=2.3 Hz, 1H), 3.84(s, 6H), 2.77(s, 2H), 2.44(s, 3H), 1.59(s, 2H), 0.12(s, 6H);13C NMR(100 MHz, CDCl3)δ: 197.33, 160.60, 144.85, 142.89, 141.33, 133.76, 130.20, 127.56, 115.56, 107.11, 103.05, 55.67, 32.87, 21.76, 7.38,-4.06; HR-MS(ESI-TOF)m/z: Calcd for C22H27NO5SSi{[M+Na]+}468.1271, found 468.1275。
9g: 白色固体34.7 mg,产率78%, m.p.139.7~141.8 ℃;1H NMR(400 MHz, CDCl3)δ: 8.12(d,J=8.0 Hz, 2H), 7.71(s, 1H), 7.58(d,J=8.1 Hz, 2H), 7.54(d,J=8.1 Hz, 2H), 7.35(d,J=7.9 Hz, 2H), 3.96(s, 3H), 2.78(s, 2H), 2.46(s, 3H), 1.61(s, 2H), 0.14(s, 6H);13C NMR(100 MHz, CDCl3)δ: 196.97, 166.59, 145.11, 143.72, 143.46, 133.69, 132.14, 130.21, 129.63, 128.72, 127.55, 115.70, 52.51, 32.94, 21.79, 7.29,-4.05; HR-MS(ESI-TOF)m/z: Calcd for C22H25NO5SSi{[M+Na]+}466.1115, found 466.1120。
9h: 白色固体28.7 mg,产率71%, m.p.106.3~109.4 ℃;1H NMR(400 MHz, CDCl3)δ:7.72(s, 1H), 7.60(d,J=8.0 Hz, 2H), 7.58~7.51(m, 2H), 7.34(d,J=8.0 Hz, 2H), 7.13(t,J=8.6 Hz, 2H), 2.78(s, 2H), 2.45(s, 3H), 1.60(s, 2H), 0.13(s, 6H);13C NMR(150 MHz, CDCl3)δ: 195.27, 163.44(d,J=250.4 Hz), 143.85, 141.10, 134.39(d,J=3.2 Hz), 132.63, 130.24(d,J=8.7 Hz),129.01, 126.39, 114.46, 114.32(d,J=21.6 Hz), 31.76, 20.63, 6.57,-5.20; HR-MS(ESI-TOF)m/z: Calcd for C20H22FNO3SSi{[M+Na]+}426.0966, found 426.0971。
9i: 淡黄色固体29.55 mg,产率64%, m.p.145.1~148.2 ℃;1H NMR(400 MHz, CDCl3)δ: 7.73(s, 1H), 7.61(d,J=8.0 Hz, 2H), 7.58(d,J=8.4 Hz, 2H), 7.40(d,J=8.4 Hz, 2H), 7.35(d,J=8.0 Hz, 2H), 2.78(s, 2H), 2.46(s, 3H), 1.60(s, 2H), 0.13(s, 6H);13C NMR(100 MHz, CDCl3)δ: 196.57, 145.06, 142.59, 138.23, 133.75, 131.63, 130.61, 130.20, 127.58, 125.86, 115.52, 32.93, 21.81, 7.60,-4.04; HR-MS(ESI-TOF)m/z: Calcd for C20H22BrNO3SSi{[M+Na]+}486.0165, found 486.0167。
9j: 淡黄色固体28.7 mg,产率67%, m.p.154.6~157.2 ℃;1H NMR(400 MHz, CDCl3)δ: 8.31(d,J=8.7 Hz, 2H), 7.72(s, 1H), 7.65(d,J=8.6 Hz, 2H), 7.58(d,J=8.3 Hz, 2H), 7.36(d,J=8.0 Hz, 2H), 2.79(s, 2H), 2.46(s, 3H), 1.62(s, 2H), 0.14(s, 6H);13C NMR(100 MHz, CDCl3)δ: 195.52, 149.16, 145.55, 145.33, 143.85, 133.60, 130.29, 129.62, 127.59, 123.67, 115.36, 32.99, 21.81, 7.29,-4.07; HR-MS(ESI-TOF)m/z: Calcd for C20H22N2O5SSi{[M+Na]+}453.0911, found 453.0917。
9k: 淡黄色固体39.0 mg,产率90%, m.p.57.3~59.7 ℃;1H NMR(400 MHz, CDCl3)δ: 7.98~7.87(m, 2H), 7.74(d,J=8.4 Hz, 1H), 7.66(s, 1H), 7.56~7.49(m, 2H), 7.48~7.43(m, 1H), 7.39~7.37(m, 1H), 7.29(d,J=8.1 Hz, 2H), 7.19(d,J=8.0 Hz, 2H), 2.75(s, 2H), 2.41(s, 3H), 1.72(s, 2H), 0.16(s, 6H);13C NMR(100 MHz, CDCl3)δ: 198.78, 144.74, 144.46, 137.99, 133.75, 133.50, 131.05, 130.01, 129.95, 128.61, 127.42, 126.75, 126.26, 125.64, 125.54, 124.74, 117.63, 32.90, 21.74, 6.72,-4.07; HR-MS(ESI-TOF)m/z: Calcd for C24H25NO3SSi{[M+Na]+}458.1217, found 458.1220。
9l: 淡黄色固体35.2 mg,产率86%, m.p.138.2~140.5 ℃;1H NMR(400 MHz, CDCl3)δ: 8.19(s, 1H), 7.66(d,J=7.9 Hz, 2H), 7.60(s, 1H), 7.55(d,J=6.6 Hz, 2H), 7.41~7.32(m, 3H), 7.29(d,J=8.1 Hz, 2H), 7.21(d,J=7.1 Hz, 1H), 2.68(s, 2H), 2.39(s, 3H), 1.52(s, 2H), 0.04(s, 6H);13C NMR(150 MHz, CDCl3)δ: 190.31, 144.90, 142.43, 138.19, 135.41, 133.79, 130.20, 130.10, 129.01, 128.30, 127.64, 121.39, 117.08, 32.81, 21.78, 7.44,-4.11; HR-MS(ESI-TOF)m/z: Calcd for C22H25NO3SSi{[M+Na]+}434.1217, found 434.1223。
9m: 黄色固体29.7 mg,产率73%, m.p.115.0~118.4 ℃;1H NMR(400 MHz, CDCl3)δ: 8.81(s, 1H), 7.74~7.68(m, 4H), 7.46~7.40(m, 3H), 7.34(d,J=8.0 Hz, 2H), 2.76(s, 2H), 2.44(s, 3H), 1.51(s, 2H), 0.09(s, 6H);13C NMR(150 MHz, CDCl3)δ: 178.75, 145.11, 144.56, 133.12, 130.46, 130.27, 128.81, 127.67, 120.71, 117.84, 91.21, 85.74, 33.04, 21.78, 5.98,-4.17; HR-MS(ESI-TOF)m/z: Calcd for C22H23NO3SSi{[M+Na]+}432.1060, found 432.1065。
9n: 淡黄色固体32.1 mg,产率86%, m.p.104.2~106.3 ℃;1H NMR(400 MHz, CDCl3)δ: 8.39(s, 1H), 7.70(d,J=7.8 Hz, 2H), 7.63(s, 1H), 7.34(d,J=7.9 Hz, 2H), 7.06(s, 1H), 6.54(s, 1H), 2.76(s, 2H), 2.44(s, 3H), 1.58(s, 2H), 0.10(s, 6H);13C NMR(101MHz, CDCl3)δ: 182.97, 152.49, 145.77, 144.85, 140.19, 133.93, 130.15, 127.60, 117.94, 114.96, 111.87, 32.93, 21.75, 7.70,-4.12; HR-MS(ESI-TOF)m/z: Calcd for C18H21NO4SSi{[M+H]+} 376.1033, found 376.1040。
9o: 淡黄色固体35.3 mg,产率90%, m.p.107.1~108.9 ℃;1H NMR(400 MHz, CDCl3)δ: 8.11(s, 1H), 7.68(d,J=8.0 Hz, 2H), 7.62~7.57(m, 1H), 7.52~7.46(m, 1H), 7.35(d,J=7.9 Hz, 2H), 7.15~7.09(m, 1H), 2.78(s, 2H), 2.45(s, 3H), 1.61(s, 2H), 0.12(s, 6H);13C NMR(150 MHz, CDCl3)δ: 188.52, 144.89, 143.60, 139.75, 133.85, 132.16, 132.11, 130.16, 127.64, 127.59, 115.69, 32.91, 21.76, 8.30,-4.08; HR-MS(ESI-TOF)m/z: Calcd for C18H21NO3S2Si{[M+Na]+}414.0624, found 414.0623。
9p: 白色固体31.5 mg,产率72%, m.p.136.7~140.6 ℃;1H NMR(400 MHz, CDCl3)δ: 8.02(s, 1H), 7.81~7.77(m, 4H), 7.66~7.61(m, 4H), 7.35(d,J=8.0 Hz, 2H), 6.52(s, 1H), 2.79(s, 2H), 2.45(s, 3H), 1.63(s, 2H), 0.14(s, 6H);13C NMR(101 MHz, CDCl3)δ: 196.52, 144.98, 142.27, 142.14, 141.86, 137.12, 133.84, 130.63, 130.18, 127.56, 126.99, 118.48, 115.67, 108.41, 32.96, 21.77, 7.73,-4.03; HR-MS(ESI-TOF)m/z: Calcd for C23H25N3O3SSi{[M+H]+}452.1459, found 452.1465。
2 结果与讨论
2.1 底物适用范围
通过对串联成环反应中的碱、溶剂、温度、当量和添加剂的系统考察,发现在碳酸钾的促进下,8和丙炔酸甲酯能在70 ℃下顺利发生环化,以66%的收率得到化合物9a。在该最优反应条件下,烷基、芳基和杂环取代的炔酮也均适用于该体系(Scheme 2)。其中,供电子基取代的芳基炔酮(9d~9f)普遍比非取代的(9c)和吸电子基取代的(9g~9j)芳基炔酮产率更高。另外,苯环上甲氧基取代位点及取代数量对产率影响较小,2-位或4-位取代,或3,5-位双取代给出了相似的产率(9d~9f)。不饱和双键以及内炔并不适用于该反应,这使我们能够化学选择性地合成产物9l和9m。另外,呋喃、噻吩、苯基吡唑等药物分子中常见的官能团也能够耐受反应,并给出相应的1,3-硅杂四氢吡啶化合物产物(9n~9p)。在尝试使用萘基钠或萘基锂等条件脱除1,3-硅杂四氢吡啶环结构中的对甲苯磺酰基时,发现反应体系非常复杂。推测是因为不饱和羰基在上述条件下也能够被还原,反应受到了干扰了。下一阶段,课题组将继续尝试对不饱和羰基进行官能团后再脱除对甲苯磺酰基,或者筛选其他氮保护基。
2.2 反应机理
根据实验结果,提出了反应机理(Scheme 3)。首先,底物8在碱作用下失去质子形成氮负离子,氮负离子与炔酯或炔酮发生氮杂-迈克尔加成给出相应的联烯基烯醇盐中间体。该中间体随后通过路径a与烷基碘发生分子内SN2型亲核取代,给出1,3-硅杂四氢吡啶产物9。在某些反应中也同时观察到了少量的质子化副产物10的生成(路径b),这也支持了反应是经过联烯基烯醇盐中间体进行的猜测。
开发了一种新型的用于硅杂氮环合成的试剂——2-硅-1,3-碘代对甲苯磺酰胺。该试剂由商业可得试剂出发,只需3步反应便可进行克级规模的合成。试剂为白色固体,性质稳定,使用方便。应用该试剂,发展了串联型氮杂-迈克尔加成/分子内亲核取代反应,实现了一系列结构新颖的1,3-硅杂四氢吡啶环的合成。该反应具有以下特点:1)反应体系简单,无需过渡金属催化;2)底物适用范围广,包括炔酯以及烷基、芳基和杂环取代的炔酮。该工作有助于发展更多高效的硅杂氮环的合成策略,构建结构丰富的硅杂氮环化合物库,以及促进含硅药物的创新研发。
