甘草酸二铵对四氯化碳诱导肝纤维化模型小鼠氧化应激损伤的保护作用
2022-03-16段丽杰王立新
段丽杰,王立新
(天津市第二人民医院,天津 300192)
我国是“乙肝大国”,实施乙型肝炎免疫预防策略近30 年,一般人群乙肝病毒表面抗原携带率仍高达7.18%[1-2]。慢性乙型肝炎人群由于反复的炎症损伤及修复,极易出现肝脏纤维化,逐渐发展为肝硬化、肝癌,严重影响生活质量,甚至危及生命。肝纤维化作为慢性乙肝病毒感染疾病进程的中间环节,是临床有效改善防控疾病进展、延长寿命、降低经济负担的重要靶点。本实验运用CCl4所致肝纤维化模型作为研究对象,采用甘草酸二铵作为受试药物,求证该药在调控氧化应激损伤、延缓肝纤维化疾病发展进程中的作用。
1 实验材料
1.1 实验动物 成年雄性C57BL/6 小鼠50 只,体重(20±2)g,由北京华阜康生物科技股份有限公司提供[SYXK(京)2019-0022],小鼠饲养于SPF 级清洁环境中,自由进食。
1.2 实验药品 甘草酸二铵胶囊(正大天晴集团药业股份有限公司,批号210317110);水飞蓟宾(上海源叶生物科技有限公司,批号R10F11Y108464);CCl4(天津市凯通化学试剂有限公司,批号20190828);橄榄油(山东鲁花集团有限公司,批号20190507);谷丙转氨酶(ALT,批号20191031)、谷草转氨酶(AST,批号20191028)、白蛋白(ALB,批号 20191020)、总蛋白(TP,批号20190803)均来源于南京建成生物工程研究所有限公司;α 平滑肌动蛋白[α-SMA,abcam(上海)贸易有限公司,批号ab7817];总RNA提取试剂盒(#DP419,批号 #DP419)、cDNA 反转录试剂盒(#KR116-02,批号 #R6906)、SYBR 扩增试剂盒 (#P205-02,批号#S7516),均来源于天根生化科技(北京)有限公司。
1.3 实验仪器 高性能通用台式冷冻离心机(Thermo Scientific,型号:Thermo Sorvall ST16R);多功能酶标仪(Thermo Fisher Scientific,型号:Multiskan FC);光学显微镜(Nikon,型号:ECLIPSE TS100);荧光定量PCR 仪(Bio-RAD,型号:iQTM5)。
2 实验方法
2.1 肝纤维化小鼠模型的建立 通过腹腔注射CCl4建立肝纤维化小鼠模型。选取雄性C57BL/6 小鼠,体重(20±2)g,将CCl4溶于橄榄油中制备20%的CCl4橄榄油溶液,每只小鼠腹腔注射20%的CCl4橄榄油溶液2 ml/kg,2 次/周,连续注射 6 周(每周一、周四注射)。
2.2 实验分组及给药方案 选取雄性C57BL/6 小鼠50 只,体重(20±2)g,随机分成 5 组,每组 10 只,具体分组方案如下:正常组:腹腔注射橄榄油0.2 ml,2 次/周,连续注射6 周;模型组:腹腔注射CCl4建立肝纤维化模型,造模2 周后,灌胃生理盐水0.2 ml/d,连续灌胃4 周;阳性药组:腹腔注射CCl4建立肝纤维化模型,造模2 周后,灌胃100 mg(/kg·d)水飞蓟宾,连续灌胃4周;甘草酸二铵低剂量组:腹腔注射CCl4建立肝纤维化模型,造模2 周后,灌胃甘草酸二铵68 mg(/kg·d),连续灌胃4周;甘草酸二铵高剂量组:腹腔注射CCl4建立肝纤维化模型,造模2 周后,灌胃甘草酸二铵136 mg(/kg·d),连续灌胃4 周。
2.3 指标观察 造模及给药结束后检测各组小鼠体重,称取肝脏重量,计算肝指数。肝指数公式为:肝指数(%)=肝脏重量(g)/体重(g)×100%。
2.4 血清肝功能指标检测 造模给药后,小鼠目内眦取血,常温静置 30 min,于 4 ℃、3 500 r/min 离心,取上清液,-80 ℃保存待测。使用生化试剂盒测定各组小鼠血清中血清ALT、AST、ALB 及 TP 的含量。
2.5 病理学观察 造模给药后收集各组小鼠肝脏组织,用福尔马林溶液固定,石蜡包埋,制成3 μm 切片,常规HE 染色,光学显微镜下观察各组小鼠肝组织病理学改变,同时对肝脏进行masson 及天狼星红染色,观察各组小鼠肝脏纤维化程度,masson 染色结果:胶原纤维呈蓝色,细胞核呈蓝黑色;天狼星红染色结果:胶原纤维呈红色,细胞核呈绿色。在200×视野下随机选取3 个视野,运用Image Pro Plus 6.0 对纤维染色阳性区域进行量化,检测积分光密度(IOD),计算阳性表达区域。
2.6 免疫组化检测 将肝组织石蜡切片常规脱蜡至水,抗原修复,封闭,α-SMA(0.034 μg/ml)4 ℃ 孵育过夜,滴加二抗,DAB 显色,苏木精复染。显微镜下拍照,运用Image Pro Plus 6.0 对纤维染色阳性区域进行量化,检测积分光密度(IOD),计算阳性表达区域。
2.7 肝组织匀浆抗氧化指标检测 称取0.1 g 冻存的肝组织,置于900 μl 生理盐水中,涡旋30 s,之后3 000 r/min 离心15 min 制备10%的肝组织匀浆。按试剂盒说明书分别测定SOD、MDA 和GSH-Px 抗氧化指标水平。
2.8 荧光定量PCR 检测 造模给药结束后,提取各组小鼠肝组织中总RNA,利用转录酶将RNA 逆转录成cDNA,以cDNA 为模板进行PCR 扩增,检测各组小鼠肝组织中抗氧化相关基因SOD、MDA、GSH-Px表达以β-actin 为内参,运用2-△△CT方法计算基因相对表达量。具体引物序列见表1。
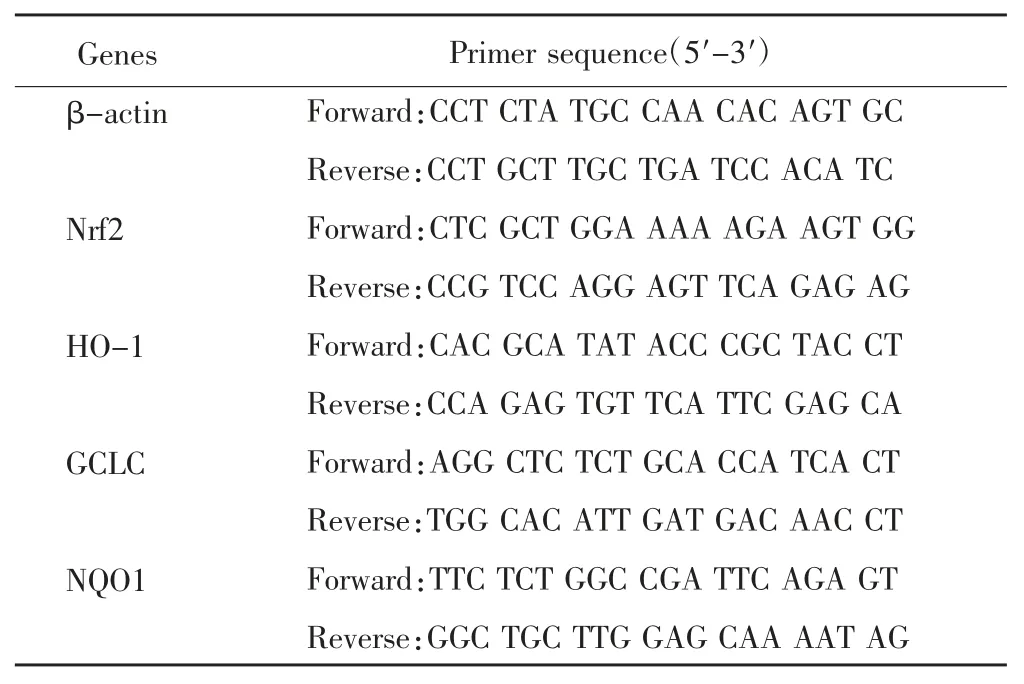
表1 引物序列
2.9 统计学处理 实验结果采用SPSS Statistics 20.0统计软件进行分析,计量资料以表示,采用t 检验,多组间均数比较采用单因素方差分析。P<0.05 为有统计学意义。
3 结果
3.1 体重和肝指数水平比较 造模给药后,与正常组比较,模型组小鼠体重显著降低(P<0.01),肝指数显著升高(P<0.01);与模型组比较,阳性药组(P<0.05)、甘草酸二铵低剂量组(P<0.05)和甘草酸二铵高剂量组(P<0.01)小鼠体重显著上升,肝指数显著下降(P<0.01)。见表 2。
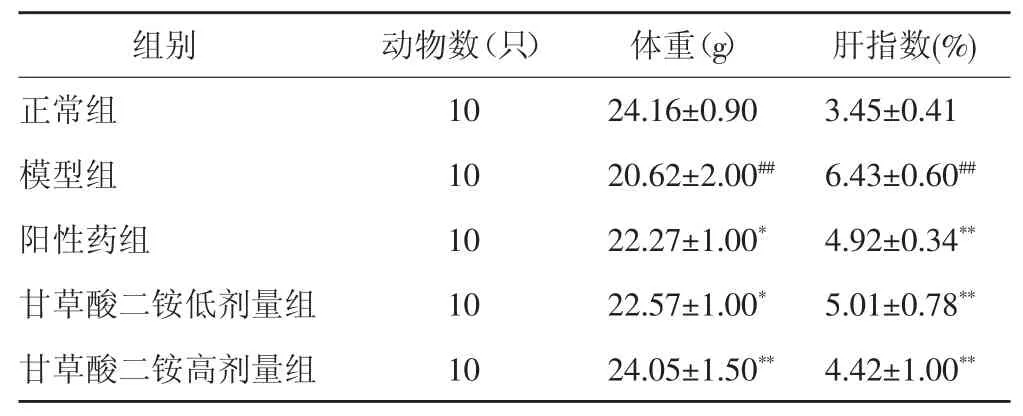
表2 造模给药后各组小鼠体重及肝指数水平比较
3.2 血清肝功能指标比较 造模给药后,与正常组比较,模型组小鼠血清中ALT 和AST 水平显著升高(P<0.01),ALB 和 TP 水平显著降低(P<0.01);与模型组比较,阳性药组、甘草酸二铵低剂量组和甘草酸二铵高剂量组血清ALT 及AST 水平显著降低(P<0.01),ALB 及 TP 水平显著升高(P<0.05,P<0.01)。见表 3。
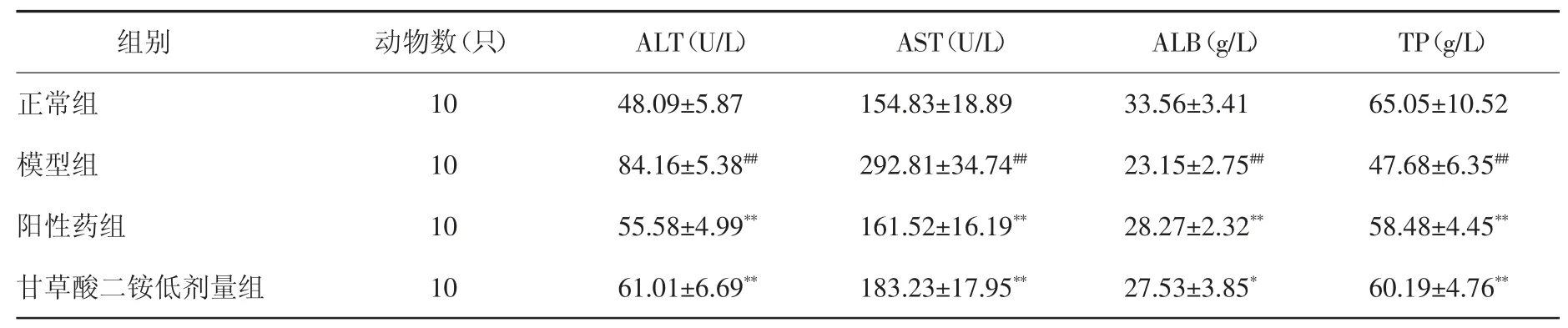
表3 造模给药后各组小鼠血清ALT、AST、ALB 及TP 水平比较
3.3 HE 染色结果 肝组织HE 染色结果表明,模型组小鼠肝细胞排列散乱,肝细胞出现明显的肝细胞气球样变,同时可观察到明显的炎细胞浸润,甘草酸二铵组小鼠肝细胞排列较模型组更为整齐,肝细胞气球样变及肝组织中炎细胞浸润均有所缓解。见图1。
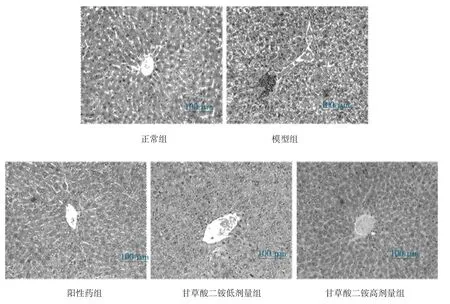
图1 各组小鼠肝组织HE 染色(200×)
3.4 Masson 和天狼星红染色结果 masson 及天狼星红染色结果表明,模型组小鼠肝组织纤维含量显著增加(P<0.01),甘草酸二铵干预可显著减少肝纤维化模型小鼠肝组织中纤维沉积(P<0.01)。见图2-5。
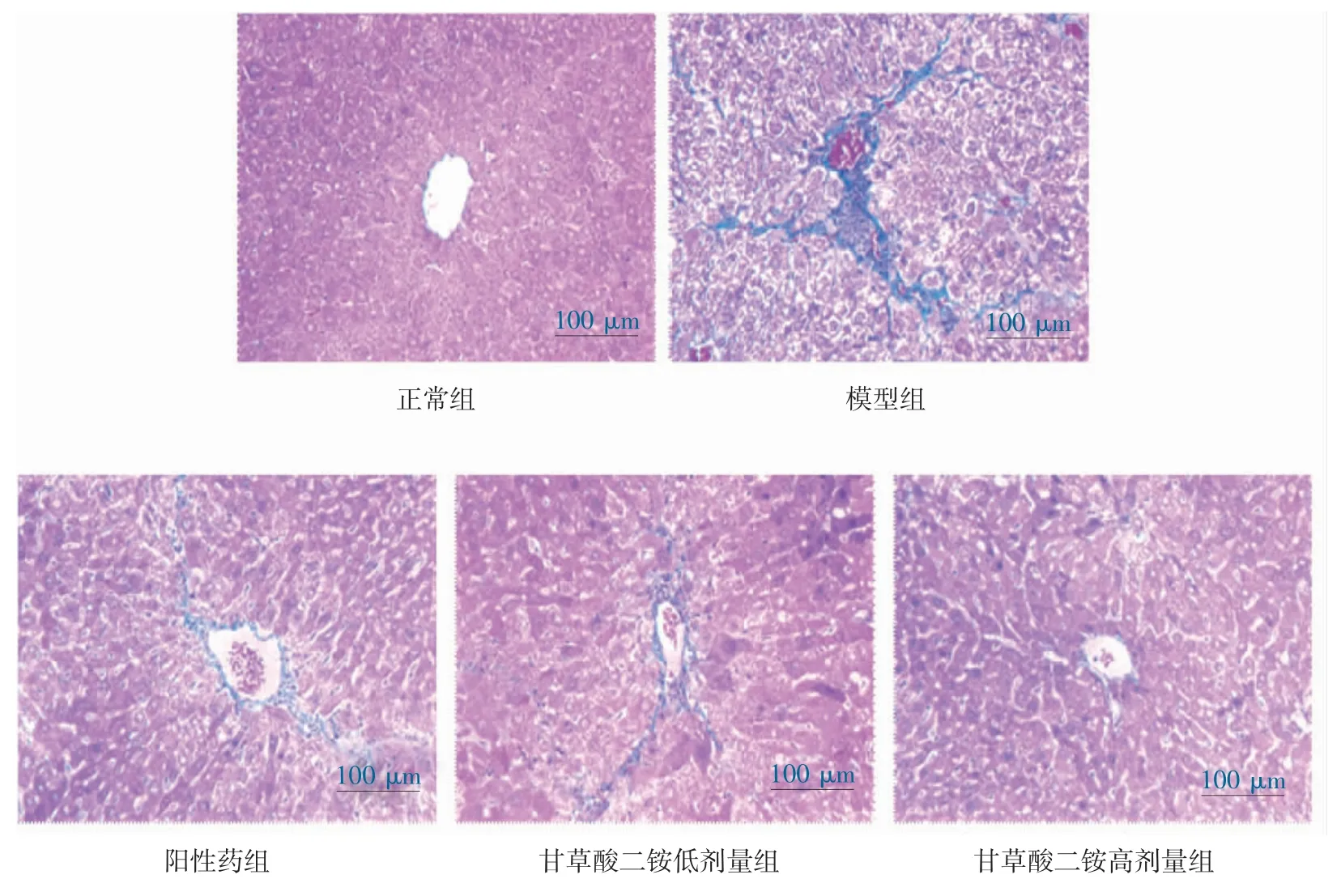
图2 各组小鼠肝组织massson 染色(200×)
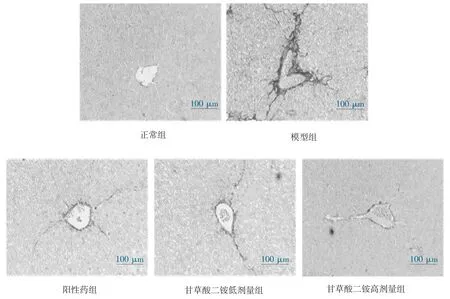
图3 各组小鼠肝组织天狼星红染色(200×)

图4 各组小鼠肝组织massson 染色阳性表达区域(n=10)
3.5 免疫组化染色结果 免疫组化染色表明,正常组小鼠肝组织中仅见少量α-SMA 表达。与正常组比较,模型组肝组织中可见大量α-SMA 阳性区域(P<0.01),呈棕褐色,主要集中在汇管区、中央静脉、假小叶纤维膈及临近的肝窦区周围;与模型组比较,阳性药组、甘草酸二铵低剂量组和甘草酸二铵高剂量组阳性表达呈不同程度的降低(P<0.01)。见图6和图7。
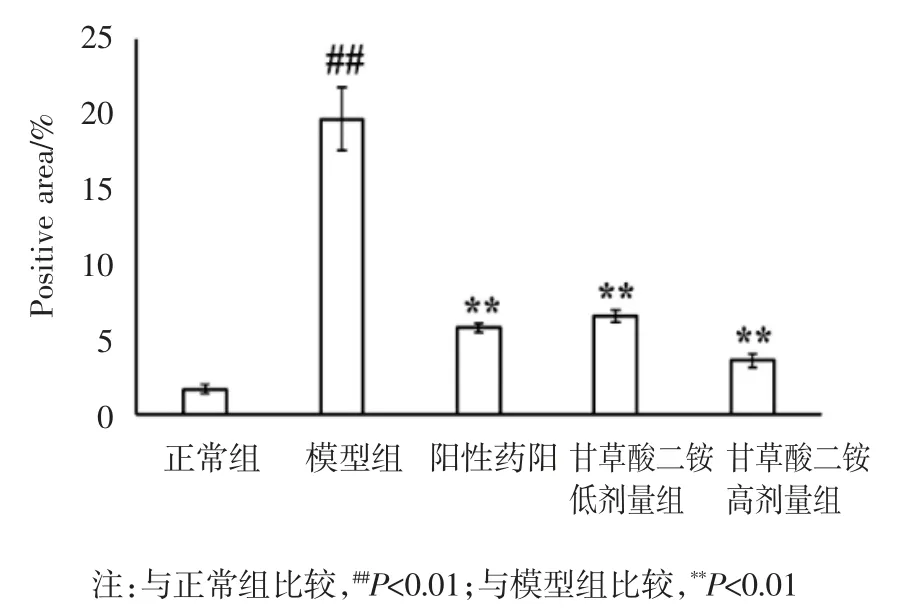
图5 各组小鼠肝组织天狼星红染色阳性表达区域(n=10)
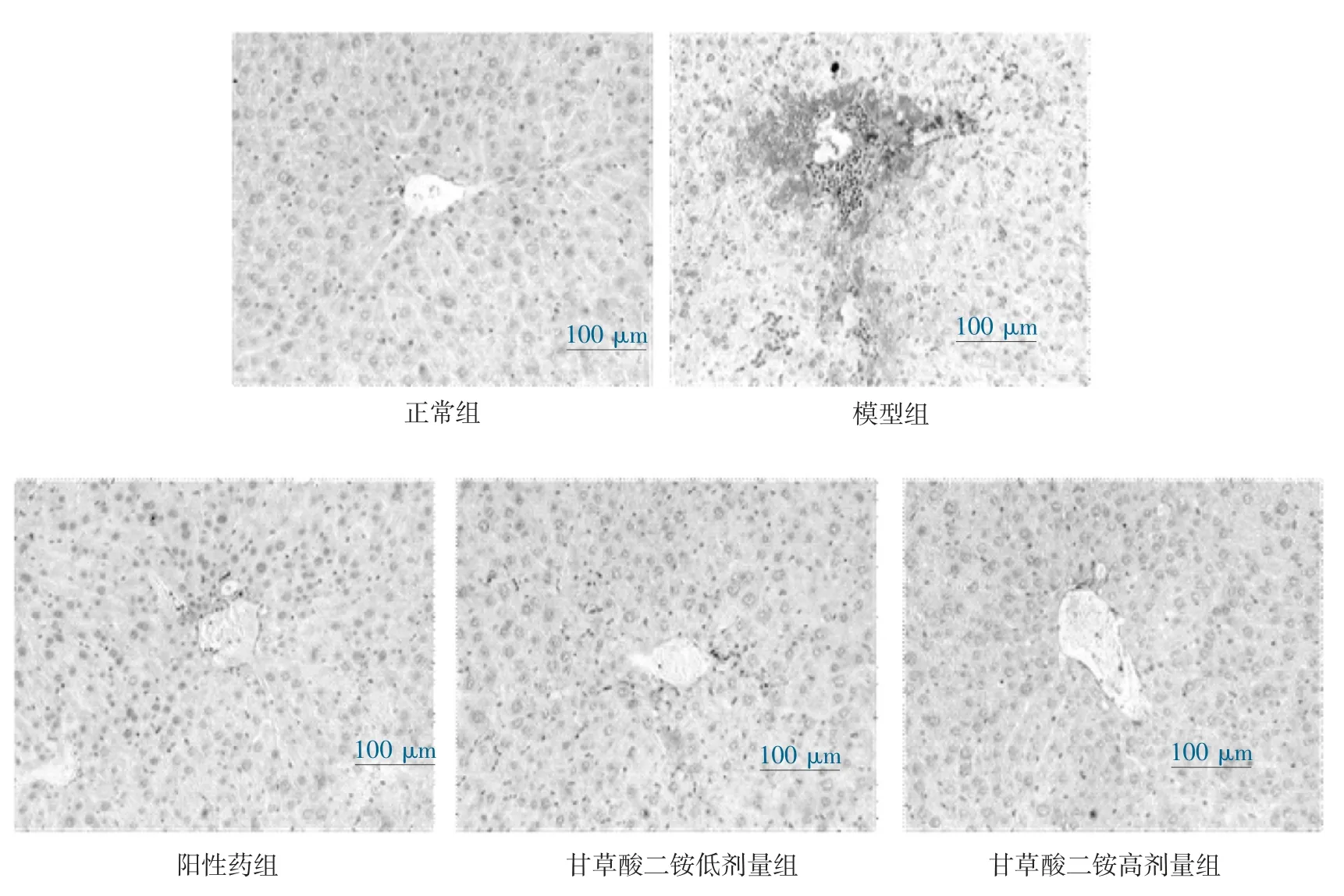
图6 各组小鼠肝组织α-SMA 染色(200×)
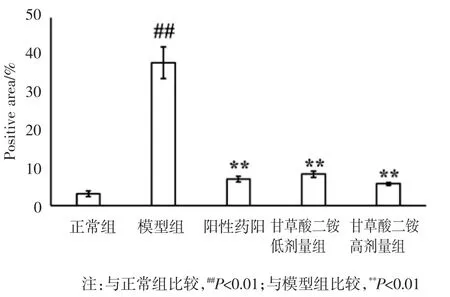
图7 各组小鼠肝组织α-SMA 染色阳性表达区域(n=10)
3.6 肝组织匀浆抗氧化指标水平比较 与正常组比较,模型组 SOD 和 GSH-P 活性明显降低(P<0.01),MDA 水平明显上升(P<0.01);与模型组比较,阳性药组、甘草酸二铵低剂量和甘草酸二铵高剂量组SOD和 GSH-P 活性显著升高(P<0.01),MDA 水平明显降低(P<0.01)。见表 4。
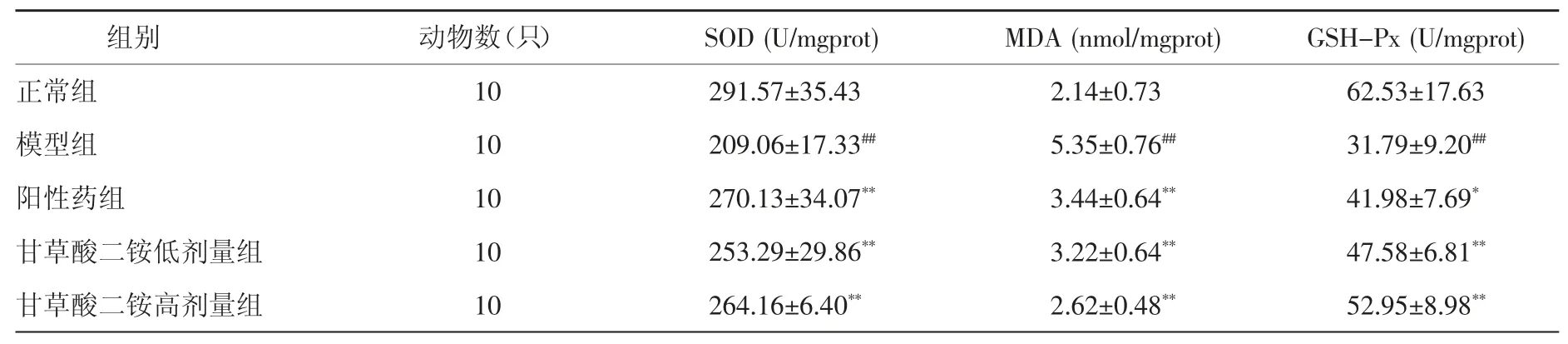
表4 造模给药后各组小鼠肝组织匀浆SOD、MDA 及GSH-Px 水平比较
3.7 甘草酸二铵对肝纤维化模型小鼠肝组织抗氧化水平的影响 qPCR 结果表明,与正常组比较,模型组小鼠肝组织中 Nrf2、HO-1、GCLC、NQO1 mRNA 表达显著下降(P<0.01);与模型组比较,阳性药组、甘草酸二铵低剂量和甘草酸二铵高剂量组Nrf2、HO-1、GCLC、NQO1 mRNA 明显上升(P<0.05,P<0.01)。见图 8。
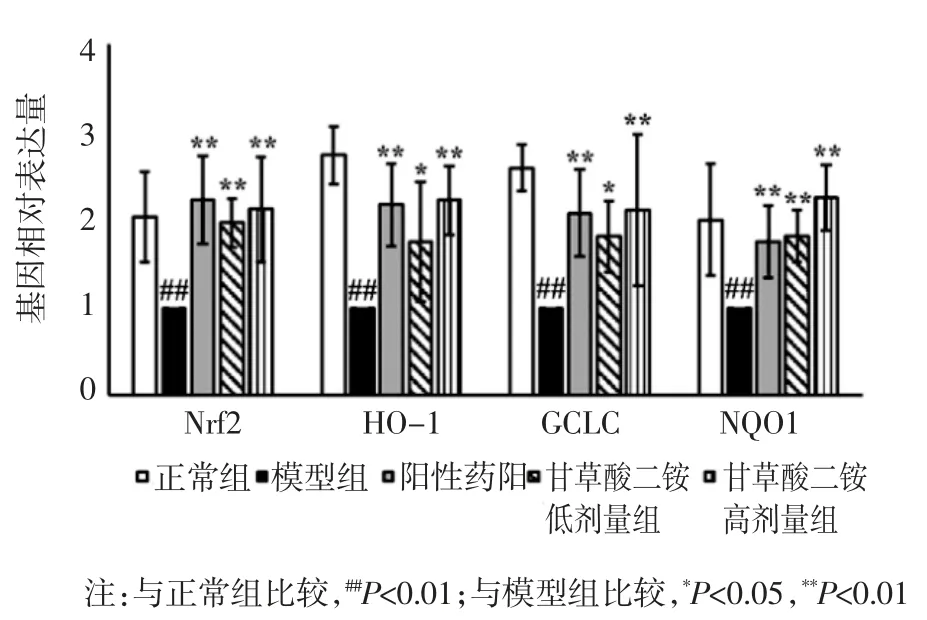
图8 各组小鼠肝组织Nrf2、HO-1、GCLC、NQO1 mRNA 表达水平(n=6)
4 讨论
肝纤维化是一种慢性疾病,可由肝毒性、生物因素(肝炎病毒、细菌、寄生虫等)、化学因素(药物、工业毒物、酒精等)和环境因素[3]引起。长期的肝纤维化可导致肝硬化、肝细胞癌和肝衰竭[4]。因此,改善慢性肝纤维化对于预防肝硬化和肝功能衰竭的发生至关重要。甘草酸二铵是中药甘草有效成分的第三代提取物,具有较强的抗炎、保护肝细胞膜及改善肝功能的作用。本实验旨在探讨甘草酸二铵对肝纤维化治疗的作用机制,判断其是否与调控氧化应激损伤有关,并为其临床用药提供药理学基础。
研究表明,多种因素可以导致肝脏发生纤维化,其中肝内氧化应激损伤是重要的机制之一[5], 参与到了肝脏内胶原成分的沉积, 因此,研究降低氧化应激水平的治疗方案, 是治疗肝纤维化的研究热点之一。Nrf2 通路是氧化应激的重要通路,有文献报道,Nrf2的异常表达可能与肝纤维化的发生发展密切相关[6]。Nrf2 入核后可诱导下游 HO-1、NQO1、GCLC 等基因表达[6-7],提高组织抗氧化能力进而起到保护的作用[8-10],因此提高 Nrf2、HO-1、NQO1、GCLC 等基因的表达是缓解氧化应激损伤的重要方案之一。本研究采用甘草酸二铵对CCl4所致肝纤维化模型进行了降低氧化应激水平作用机制的探讨,结果发现,该药明显改善模型动物肝脏纤维化水平和肝脏组织中氧化应激相关因子 Nrf2、HO-1、GCLC、NQO1 的表达,进一步诠释甘草酸二铵在治疗肝纤维化的作用机制,为甘草酸二铵通过缓解氧化应激损伤作用的治疗机制提供了基础研究的数据。
