CuO修饰Fe基载氧体的锡盟褐煤化学链燃烧特性分析*
2022-03-14李常颖宋长忠郝松涛霍心广
李常颖 宋长忠 郝松涛 李 泽 霍心广
(内蒙古工业大学能源与动力工程学院,010051 呼和浩特)
0 引 言
化学链燃烧(chemical looping combustion,CLC)是一种基于CO2零排放理念的新型燃烧方式,它通过燃料与金属氧化物或非金属氧化物的反应和再生,向燃料提供晶格氧,使燃料被氧化产生热量与气体产物。在化学链燃烧过程中燃料与空气不发生直接接触,而是利用载氧体传递氧和热量,通过两步化学反应完成燃烧过程,由于燃烧过程中燃料与空气无直接接触,避免了燃料型NOx的生成,且能实现化学能的梯级利用[1-3]。
在固体燃料化学链燃烧方面,OSCAR et al[4]采用钛铁矿作为载氧体,以松木作为燃料,在功率为1.5 kW串行流化床中进行了55 h的燃烧实验,发现钛铁矿在生物质化学链燃烧实验中具有很高的还原能力,且在持续循环过程中不会发生团聚烧结现象。沈天绪等[5]在功率为5 kW双级燃料反应器进行煤的化学链燃烧实验,发现较高的反应温度能显著提高燃烧效率,碳捕集率随着反应温度的升高而升高。张思文等[6]在流化床内研究碱土金属Ca对铁矿石载氧体反应活性的影响,结果表明随着Ca负载量的增加,煤化学链燃烧的反应速率加快,碳转化率呈现出明显提高趋势。载氧体反应活性是煤和生物质等固体燃料化学链燃烧的关键要素,但固体燃料的性质同样决定燃烧效率的高低。张帅等[7]采用由内蒙古褐煤、陕西烟煤和宁夏无烟煤分别在不同热解条件下制备的煤焦为燃料,以人工合成的铁铝为复合载氧体进行煤焦的化学链燃烧实验,结果表明煤阶越低,煤焦孔隙越发达,反应性能越佳;万奇顺等[8]以Fe4Al6为载氧体,以H2O为气化剂,在间歇式流化床中研究煤灰累积对煤焦化学链气化过程中载氧体的反应性能与结构的影响,结果表明在温度为800 ℃~900 ℃的化学链气化过程中,添加质量分数为5%~15%神木煤灰可降低载氧体还原反应的温度且提高其还原反应速率。ASTRY P A et al[9]发现锰基和铁基的矿石作为载氧体可以获得较高的CO2捕集效率,但生物质作为燃料时,由于其挥发分含量较高,导致耗氧量较高,造成燃烧效率较低。锰铁复合载氧体中掺杂钛后在特定条件下会释放气态氧,从而提高碳转化率。
从已有研究成果发现,Fe基载氧体因其经济成本较低、容易获得及环境友好等优势得到广泛关注,但因Fe基载氧体活性较低,成为限制其被大规模使用的瓶颈。在固体燃料化学链燃烧研究中,目前研究对象多集中在生物质燃料与常见煤种燃料上,锡盟褐煤由于水分较大、煤化程度较低、热值较低及灰分较高等特点,燃烧利用受到限制,关于锡盟褐煤在化学链燃烧中的研究较鲜见。为了对合成Fe基载氧体的性能进行优化且促进对作为内蒙古重要煤炭资源的锡盟褐煤进行清洁高效利用,本研究用共沉淀法制备Fe基复合载氧体,用锡林郭勒盟褐煤及其煤焦作为燃料,比较研究了不同质量分数CuO修饰的载氧体在褐煤化学链燃烧中的反应性能。
1 实验部分
1.1 载氧体制备
采用共沉淀法制备复合Fe基载氧体,并在Fe2O3/Al2O3载氧体上负载CuO组分,制备Fe2O3/Al2O3/CuO载氧体。本实验所制备的载氧体使用其对应的分析纯硝酸盐晶体(Fe(NO3)3·9H2O,Al(NO3)3·9H2O)、氨水与CuO粉末作为原料。
制备的铁基载氧体以CuO和Fe2O3作为活性组分,以Al2O3作为惰性载体,其质量分数设定为30%,CuO的添加质量分数分别设定为0%,10%与20%。载氧体制备过程如下:
按照预定的Fe2O3/Al2O3不同质量分数配比,称取对应质量的Fe(NO3)3·9H2O和Al(NO3)3·9H2O,放入磁力搅拌器中加水,加热搅拌后配制成盐溶液,加热至80 ℃时缓慢滴加氨水,直至溶液pH为9~10时,得到泥浆状沉淀物,继续搅拌,同时缓慢加入CuO粉末,然后冷却与干燥;将所得前驱体放入马弗炉中以10 ℃/min升温速率升温至900 ℃,锻烧6 h,得到载氧体样品;研磨后筛分出粒径为0.2 mm~0.3 mm的载氧体颗粒供实验使用。
1.2 载氧体的XRD表征
本研究制备的载氧体XRD表征使用荷兰PANalytical B.V.公司生产的Empyrean型X射线衍射仪来测定,使用Jade6.0软件进行数据分析。
三种复合载氧体的XRD晶相分析图谱如图1所示。由图1可知,未经CuO修饰的载氧体含有较强的 Fe2O3晶相和Al2O3晶相,说明该制备条件下载氧体完成了良好的结晶过程,形成了完整的晶相,且在XRD图谱中没有出现其他的尖晶石相;添加10%CuO修饰的Fe2O3/Al2O3载氧体,主要含有Fe2O3、CuFe2O4和Al2O3,未检测到CuO,原因可能是在高温下CuO与Fe2O3结合生成CuFe2O4,其反应方程式如式(1)所示;当添加20%CuO时,CuO修饰的载氧体中除了Fe2O3、CuFe2O4和Al2O3,还出现了CuO。
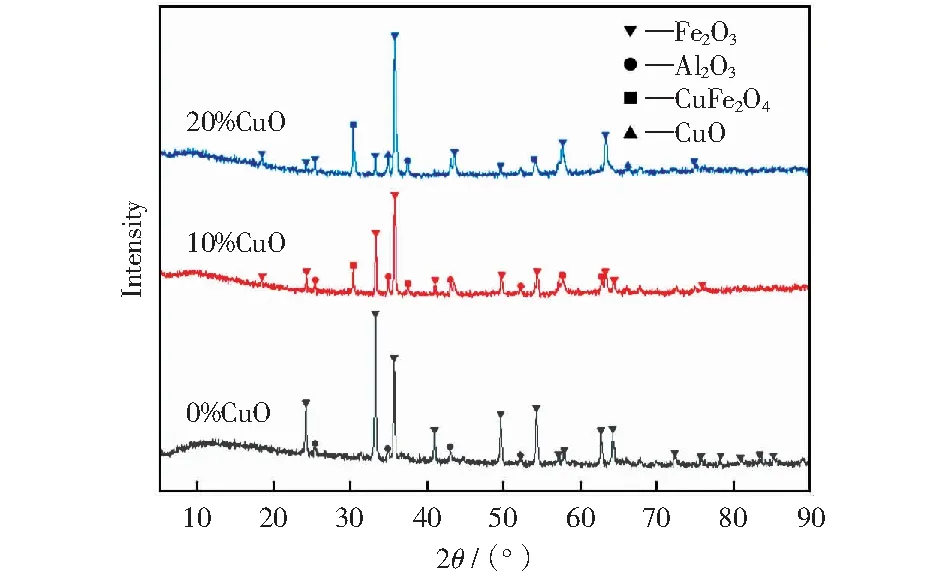
图1 载氧体的XRD谱
CuO+Fe2O3=CuFe2O4
(1)
CuFe2O4为扭曲的四方反尖晶石结构,且对称性略低,低对称性可增强金属离子在尖晶石结构中的还原性,利于提高载氧体的氧传输速率。CuO的低熔点性会加剧载氧体的烧结情况,特别是在多次循环测试条件下更容易导致载氧体表面孔隙结构的烧结[10]。因此,可以初步预期10%CuO修饰的Fe2O3/Al2O3载氧体更适合煤化学链燃烧的应用。
1.3 煤与煤焦的制备
实验用煤为锡林郭勒盟褐煤。将褐煤置于破碎机中粉碎与碾磨,然后筛分出粒径为0.1 mm~0.2 mm煤样,接着将煤样放入干燥箱内,在120 ℃下干燥2 h得到实验所需褐煤煤样。煤焦的制备:褐煤经120 ℃恒温条件下干燥12 h后,在固定床中且在600 ℃恒温条件下干燥1 h,在固定床中时需持续通入N2保持无氧环境,完成后当温度降至室温时取出样品,干燥封存以备后续实验使用。对干燥后的煤样进行工业分析和元素分析,结果见表1。
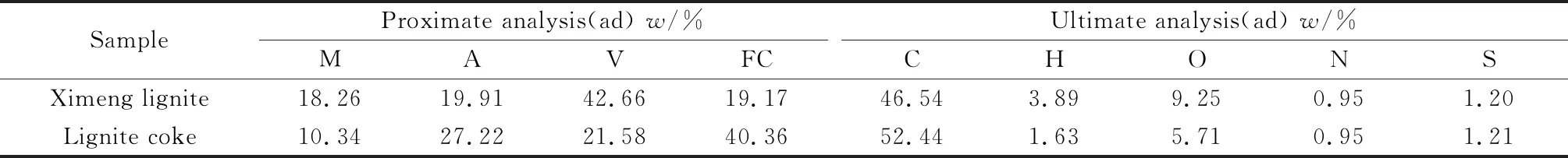
表1 褐煤与褐煤焦的工业分析和元素分析
1.4 实验装置与步骤
实验采用间歇式流化床实验系统,如图2所示。由图2可知,该系统主要包括流化床反应器、加热系统、进气系统与数据采集分析系统四部分。流化床反应器主体放置在加热炉内,其高为800 mm,内径为57 mm,材料为不锈钢,距底部300 mm处采用多孔布风板,设计床高度为50 mm。实验中在石英砂上放置50 g载氧体,使用温度控制器将反应器加热至设定温度900 ℃,在此过程中通入流化介质N2与O2,在O2气氛下可将载氧体充分氧化。反应器达到预设温度且保持稳定后,打开H2O(g)且关闭O2,在N2和H2O(g)气氛下对反应器吹扫10 min,N2和H2O(g)流量分别设置为1.6 L/min与0.6 L/min,吹扫结束后继续保持通气,打开顶端进料阀,将0.5 g煤样送入反应器内,同时对烟气进行在线分析与收集后分析。反应完全后,关闭H2O(g),切换通入O2将载氧体充分氧化,一次循环试验结束。重复上述步骤进行15次循环实验,分别记录1次、5次、10次与15次的实验结果,收集15次循环实验结束后的载氧体对其进行微观形貌分析。
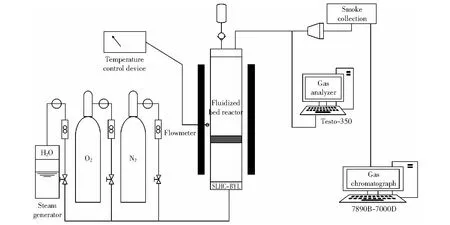
图2 流化床反应器系统
1.5 实验数据处理
实验中采用H2O(g)和N2作为气化和流化介质,其中N2不参与反应,因此可以根据N2进口流量和气体产物体积分数,计算反应器出口气体总流量,如式(2)所示[11]:
(2)
式中:nout为反应器出口气体总流量,mol·min-1;nN2为反应器进口N2的流量,mol·min-1;φCO,φCO2,φCH4和φH2分别为燃料反应器出口气体产物中CO,CO2,CH4和H2的体积分数,%。
碳转化速率γC通过碳平衡计算,mol·%·min-1,计算如式(3)所示:
γC=nout·(φCO+φCO2+φCH4)
(3)
碳转化率表示反应器出口含碳气体(CO,CO2,CH4)的量与固体燃料中碳的摩尔量NC的比,%,计算如式(4)所示:
(4)
2 结果与讨论
2.1 化学链燃烧特性
褐煤作为固体燃料在常规燃烧方式下首先发生热解反应,释放出挥发分,产生焦炭。在化学链燃烧过程中,一般被认为是气化和燃烧同时进行[12],燃料首先发生热解反应(见式(5)),产生焦炭和挥发分,挥发分与载氧体释放的晶格氧反应,焦炭在气化介质的作用下发生反应(见式(6)),产生的气化产物及焦炭与载氧体发生反应(见式(7)~式(10))。当加入CuO进行修饰后,可以预期CuO的氧解耦特性会促使可燃物与O2的直接反应(见式(11)~式(14))。
coal=volatiles+C
(5)
C+H2O(g)=CO+H2
(6)
CO+3Fe2O3=2Fe3O4+CO2
(7)
H2+3Fe2O3=2Fe3O4+H2O(g)
(8)
CH4+12Fe2O3=8Fe3O4+2H2O(g)+CO2
(9)
C+6Fe2O3=4Fe3O4+CO
(10)
2CO+O2=2CO2
(11)
2H2+O2=2H2O(g)
(12)
CH4+2O2=2H2O(g)+CO2
(13)
C+O2=CO2
(14)
反应器中的CH4主要来自煤的挥发分热裂解产物,CO主要由煤气化反应(见式(6))产生,CO2则主要来自CO与载氧体的反应(见式(7))。
图3所示为添加不同质量分数CuO载氧体的锡盟褐煤化学链燃烧过程中,随着反应时间的增加反应器出口各含碳气体体积分数的变化。从图3可以看出,三种Fe基载氧体的褐煤化学链燃烧中反应器出口各含碳气体都呈现出单峰特性分布,且出口含碳气体中CO2体积分数大,有利于CO2的捕集。此外,各气体都在第1分钟达到峰值,且在第10分钟以后浓度趋于平缓且接近零,说明此时褐煤的化学链燃烧反应过程结束。其中,燃烧过程中检测到H2含量过低,本文予以忽略。
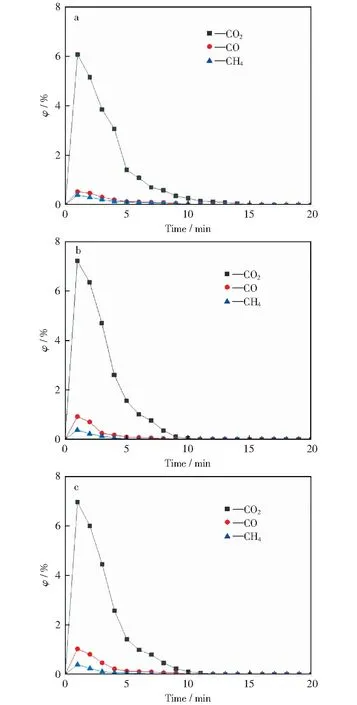
图3 出口各含碳气体体积分数随反应时间增加的变化
添加不同质量分数CuO载氧体随反应时间的增加碳转化率变化如图4所示。由图4可知,褐煤的碳转化率总体来说是随着反应时间的增加先快速增加,然后趋于平缓,在第10分钟达到峰值。基于CuO修饰的Fe2O3/Al2O3载氧体的褐煤化学链燃烧过程中,添加CuO的Fe2O3/Al2O3载氧体的CO2体积分数在第1分钟的峰值大于未添加CuO的载氧体的CO2体积分数,且修饰后两种载氧体的CO2峰值在CuO质量分数为10%时大于质量分数为20%时的CO2峰值,因实验中检测到的其余含碳气体含量较低,一定程度上导致了碳转化率的差异。具体来说,10%CuO修饰的载氧体化学链燃烧过程中碳转化率在第10分钟达到峰值94.84%,较无CuO修饰情况下的峰值89.49%提升明显,20%CuO修饰的载氧体的碳转化率能达到93.20%。由此可见,CuO作为活性组分可以有效改善Fe2O3/Al2O3载氧体的反应活性,促进褐煤碳转化率的提升,即促进了褐煤的转化。
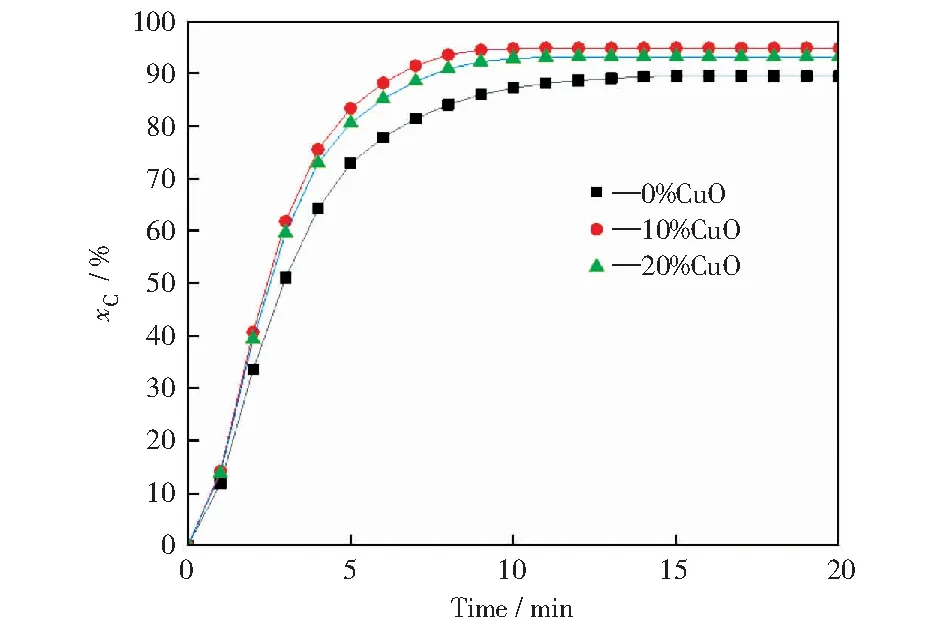
图4 不同CuO添加量载氧体的碳转化率随反应时间增加的变化
三种载氧体随时间增加碳转化速率变化曲线如图5所示。由图5可以看出,未经CuO修饰的载氧体褐煤化学链燃烧的碳转化速率曲线与经CuO修饰的变化趋势一致,均在3 min达到峰值,且未经CuO修饰的碳转化速率峰值小于两种经CuO修饰后的载氧体褐煤化学链燃烧,前者峰值为19.60 mol·%·min-1,后者中使用10%CuO修饰时峰值为23.81 mol·%·min-1,提高了4.21 mol·%·min-1,而使用20%CuO修饰时同样有所提升,峰值为22.90 mol·%·min-1。由此可知,加入CuO修饰的Fe基复合载氧体,对于其反应性确有提升,且在CuO质量分数为10%时提升效果明显。反应性提高的原因之一是高温环境下CuO具有在贫氧状态下释放气态氧的特性,O2可以和煤或气化产物直接反应,避免化学链燃烧过程中的限速反应,从而提升反应碳转化速率。其二,与20%CuO修饰的载氧体不同的是,10%CuO修饰的载氧体会出现CuFe2O4而无CuO,CuFe2O4的低对称性增强了金属离子在尖晶石结构中的还原性,利于提高载氧体的氧传输速率,这同样促进了燃烧中碳转化速率的提升。值得说明的是,XRD分析结果中,由于20%CuO修饰的载氧体中出现了CuO,在高温化学链燃烧的循环反应过程中,CuO本身的低熔点性会加剧载氧体的烧结情况,从而导致载氧体失活与流化等问题[13],特别是在多次循环的测试条件下更容易导致载氧体表面孔隙结构的烧结,本实验中20%CuO修饰的载氧化虽较未经CuO修饰的载氧体对褐煤化学链燃烧碳转化速率有所提升,但10%CuO修饰的载氧体显然是更好的选择。说明加以CuO修饰的载氧体的褐煤化学链燃烧碳转化速率有所提升,即Fe基载氧体的活性得以提升,且载氧化在CuO质量分数为10%修饰时效果更佳。
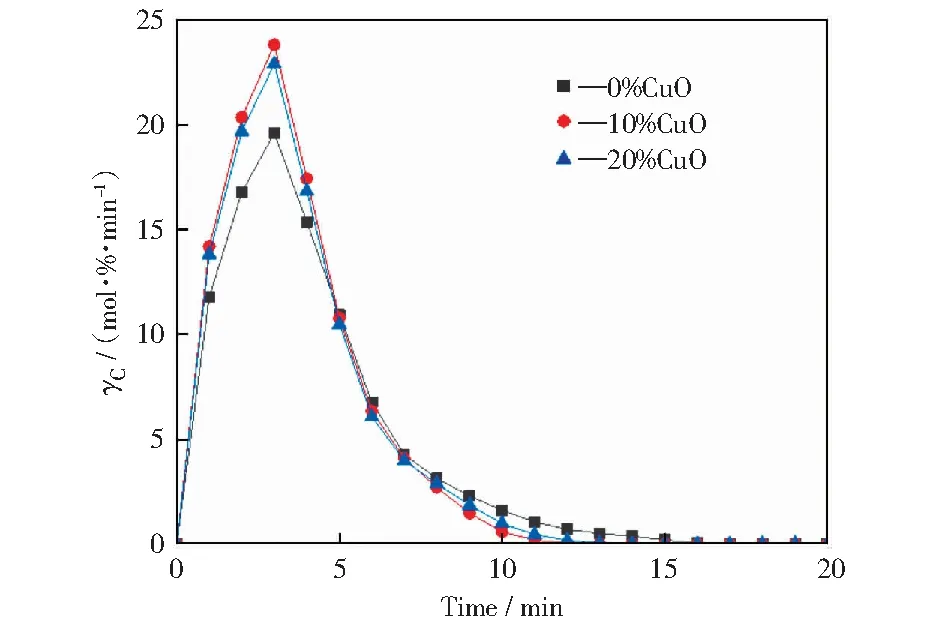
图5 不同CuO添加量载氧体的碳转化速率随时间增加的变化
碳转化速率随碳转化率变化曲线如图6所示。由图6可以看出,三种不同载氧体的褐煤化学链燃烧碳转化速率随碳转化率变化的曲线相似,均是随着碳转化率的增加,碳转化速率先升高后降低,反应后期碳转化速率的下降更为迅速。化学链燃烧前期碳转化速率迅速升高主要由于挥发分释放燃烧,后期碳转化速率主要是由焦炭的气化速率和扩散速率共同决定的[14]。在碳转化率约20%~60%阶段出现碳转化速率随碳转化率增加而变化缓慢的阶段,这是由于焦炭的气化速率降低,焦炭气化取代扩散过程成为燃料转化的限制过程。后期碳转化速率迅速降低可能是由于挥发分释放的结束及煤颗粒气化的结束,即燃烧过程的结束。因此,提高碳转化速率可强化挥发分转化过程,有文献[14]指出可采用活性较高的载氧体,如Cu基载氧化或Mn基载氧体。本实验中,就碳转化而言,经CuO修饰较未经CuO修饰的载氧体用于化学链燃烧的碳转化速率升高趋势保持得更久,在10%CuO修饰的载氧体化学链燃烧中更为明显。值得注意的是,它们达到最高碳转化速率的时间一致,即相同的时间内,不仅仅是碳转化率,碳转化速率也更高,这充分说明经CuO修饰后的载氧体对挥发分转化过程有强化作用。总的来说,本研究采用CuO修饰的Fe基载氧体获得的活性较高的载氧体,促进了燃料的转化效率,强化了挥发分转化过程,提高了碳转化速率,且这种提高在10%CuO修饰的载氧体褐煤化学链燃烧中最为有效。
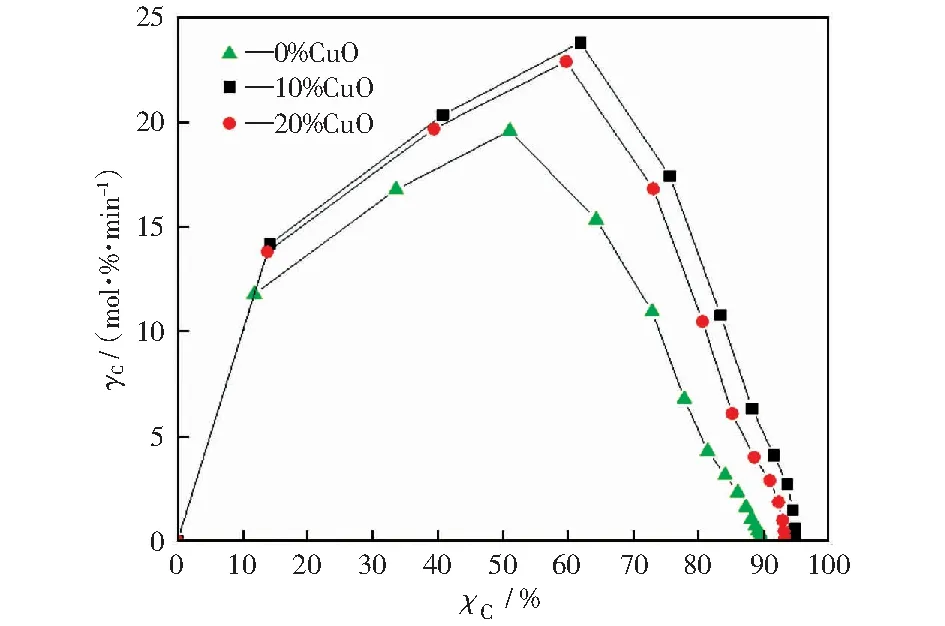
图6 碳转化速率随碳转化率变化
2.2 固体燃料孔隙结构的影响
选用了更适合褐煤化学链燃烧的经10%CuO修饰的复合铁基载氧体,初步研究了褐煤作为燃料对化学链反应的影响。
褐煤在热解过程中随着挥发分的析出会形成多孔结构的焦炭,该结构为吸附相提供了发生气化反应的场所,气化介质通过焦炭的微观结构扩散进入煤焦颗粒内部发生气化反应,同时生成的气化产物通过焦炭的孔隙结构扩散出来,与载氧体发生反应。由于褐煤原样颗粒在反应器中首先热解析出挥发分,然后形成的半焦与CO2发生气化反应,有一些如CO等可燃气体产物在床内没有足够的停留时间, 不能及时地完全被氧化就被上升气流携带离开反应器,造成碳转化率下降。而褐煤焦颗粒作为固体燃料直接投放至反应器中,其气化产生的还原性气体可迅速与载氧体发生反应。褐煤焦颗粒与褐煤颗粒的化学链燃烧过程中碳转化率随时间增加的变化情况如图7所示。由图7可知,在褐煤焦颗粒的化学链燃烧过程中碳转化率随着反应时间的增加而迅速增加,并且高于褐煤颗粒的碳转化率。此外,实验中褐煤焦炭转化率最高达95.4%,且在第9分钟到达峰值,该时间更是早于褐煤颗粒到达峰值的时间。这可为我们提供一种参考,即可设计褐煤燃料的化学链燃烧碳分离器,在反应器出口收集未与载氧体反应的煤焦颗粒,将其再次送入反应器中参与反应,则可使褐煤化学链燃烧起到更好的效果。
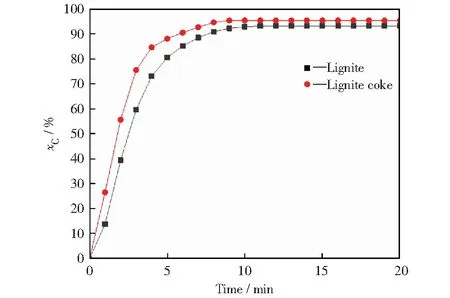
图7 碳转化率随反应时间增加的变化
2.3 循环次数的影响
载氧体的循环稳定性是考察其性能的重要指标之一。作为载氧体,多次循环导致的失活和流化等问题,特别是在多次循环条件下导致的载氧体表面孔隙结构烧结问题,都会严重影响载氧体的反应性能,所以有必要对Fe2O3/Al2O3载氧体添加CuO后褐煤的化学链燃烧循环进行实验。
选取本实验中最适合褐煤化学链燃烧的10%CuO修饰的载氧体进行实验。循环次数对反应器出口CO2体积分数随时间变化的影响如图8所示。由图8可以看出,在不同循环次数下,反应器出口CO2体积分数随着反应时间的变化呈单峰特性分布,且在第1分钟都达到峰值,随后开始降低,在第10分钟后几乎都降为0。另一方面,随着循环次数的增加,CO2在第1分钟的峰值略有下降,循环次数从1次到15次,CO2在第1分钟的峰值从7.22%减小到5.93%,这间接导致了褐煤化学链燃烧碳转化率的下降,但总体来说下降趋势并不明显。
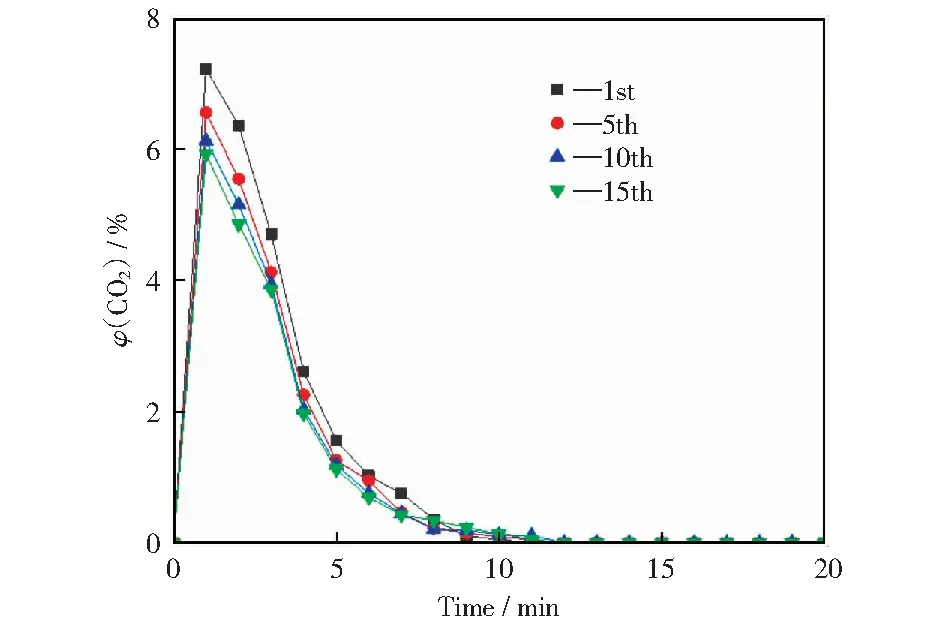
图8 循环次数对反应器出口CO2体积分数随时间变化的影响
采用场发射电子扫描观察复合载氧体循环15次后的微观形貌,分析其烧结情况。样品首先做喷金导电预处理,有利于在电镜下呈现清晰的微观形貌,观察结果如图9所示。由图9可知,循环反应后载氧体表面结构较为疏松,机械强度有所下降。此外图中可见载氧体孔隙仍较为发达,表面分散均匀,颗粒整体性较好,具有良好的比表面微观结构,仍然有利于化学链燃烧反应的进行。

图9 循环反应15次后载氧体的表面形貌SEM照片
循环次数对碳转化率的影响如表2所示。由表2可知,碳转化率随着循环次数的增加而略有降低但并不明显,同样证明载氧体保持了较好的反应性,直到第15次循环碳转化率仍有88.69%,这与未经CuO修饰的载氧体褐煤的一次化学链燃烧碳转化率差别不大。
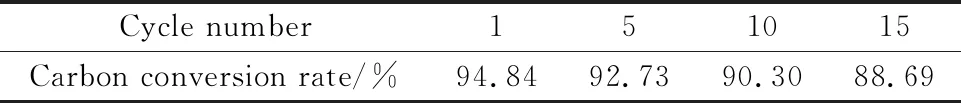
表2 化学链循环燃烧碳转化率
本实验制得的CuO修饰的Fe基载氧体在化学链循环实验中保持了较为稳定的性能,这也与杨伟进等[15]经Cu修饰的 Fe2O3/Al2O3载氧体在900 ℃下的等温循环过程中反应性能都很稳定的结果相类似。
3 结 论
1) 采用共沉淀法制备的CuO修饰的复合Fe基载氧体相比于单一活性金属氧化物的Fe基载氧体,具有更高的反应活性。10%CuO修饰的载氧体锡盟褐煤化学链燃烧中碳转化率达到94.84%,较未经CuO修饰情况下的89.49%提升明显,同时碳转化速率峰值为23.81 mol·%·min-1,相同时间内较未经CuO修饰情况提升了4.21 mol·%·min-1。
2) 用固定床制备的褐煤焦作为燃料,相比于褐煤原样作为燃料,使用10%CuO修饰的载氧体进行化学链燃烧时碳转化率到达峰值时间更早,且碳转化率高达95.80%。
3) 循环实验表明,10%CuO修饰的Fe基复合载氧体在锡盟褐煤化学链燃烧实验中仍保持了较为稳定的性能,这在一定程度上也证明了本实验中作为修饰物的CuO单独作为载氧体容易烧结的问题在制备Fe复合载氧体中同样得到改善。
